胃癌患者外周血和肿瘤灶中髓源性抑制细胞表达水平研究
2018-06-21周雅莹文锦丽周继豪
周雅莹,文锦丽,周继豪
(深圳市人民医院临床医学研究中心,广东 深圳 518020)
髓源性抑制细胞 (myeloid derived suppressor cells,MDSCs)是一群分化未成熟的髓来源细胞,正常生理状态下,该群细胞可分化为巨噬细胞、粒细胞和树突状细胞,当受到肿瘤来源的膜型和分泌型生物活性物质(Tumor derived factors,TDFs)刺激
时,则可通过多种途径参与免疫应答反应,引起机体自身的免疫功能下降,进而导致疾病的发展与恶化[1,2]。目前研究已经证实MDSCs的表达改变与乳腺癌、宫颈癌、结肠癌的发生发展相关[3-5]。本研究观察了胃癌患者外周血和肿瘤灶中MDSCs表达的变化,并分析该变化可能的相关因素,现报道如下。
1 研究对象与方法
1.1 一般资料 选取2015年3月-2017年4月经我院确诊的胃癌患者26例,其中男性15例,女性11例,平均年龄为59.85±10.88岁。选取2016年5月-2016年12月于我院进行体检的健康志愿者14例,其中男性8例,女性6例,平均年龄56.14±10.91岁。胃癌患者与健康体检者在年龄、性别构成上差异无统计学意义(P>0.05)。
1.2 入选标准 ①患者均为首次确诊为原发性胃癌;②患者均行胃癌根治术;③患者术前均未进行放疗、化疗;④患者均无其他系统肿瘤。
1.3 观察指标 记录患者一般资料,包括患者性别、年龄;记录患者肿瘤大小、有无淋巴结转移、TNM分期及分化程度。
1.4 实验方法 于术前、术后4周采集胃癌患者外周静脉血,采集健康体检者外周静脉血,各2ml,于术中采集胃癌患者肿瘤灶组织。血液标本以EDTA-Na2抗凝管保存。所有标本经处理后进行流式分析,检测以HLA-DR-/CD11b+/CD33+为MDSCs的表面标志物的细胞数量比例。抗体及红细胞裂解液选用美国Biolegend公司的鼠抗人HLA-DRECD单克隆抗体、鼠抗人CD33-Cy5单克隆抗体、鼠抗人CD11b-FITC单克隆抗体,PBS磷酸盐缓冲液为院内自制。
1.5 统计方法 将各组数据采用SPSS 17.0软件进行统计分析,各组数据采用均数±标准差 (±s)表示,计数资料比较采用χ2检验,计量数据采用t检验和方差分析,相关分析采用Pearson相关性分析。以P<0.05为有统计学意义。
2 结果
2.1 胃癌患者术前、术后4周与健康体检者外周血MDSCs表达 胃癌患者术前外周血HLA-DRCD11b+CD33+MDSCs表达高于健康体检者外周血的表达,差异有显著统计学意义(P<0.01),胃癌患者术前外周血HLA-DR-CD11b+CD33+MDSCs表达高于术后4周外周血的表达,差异有显著统计学意义(P<0.05),胃癌患者术后4周外周血HLADR-CD11b+CD33+MDSCs表达高于健康体检者外周血的表达,差异有显著统计学意义(P<0.01),见表1。
2.2 胃癌患者肿瘤灶和外周血MDSCs表达 胃癌患者肿瘤灶HLA-DR-CD11b+CD33+MDSCs表达高于外周血的表达,差异有统计学意义(P<0.01),胃癌患者肿瘤灶和外周血HLA-DR-CD11b+CD33+MDSCs表达成正相关(P<0.05),见表 2。
2.3 胃癌患者外周血MDSCs表达水平与临床资料的关系 胃癌患者外周血中HLA-DR-CD11b+CD33+MDSCs表达与肿瘤TNM分期、有无淋巴转移、肿瘤分化程度相关(P<0.05),与患者性别、年龄、肿瘤大小、浸润深度不相关(P>0.05),见表 3。
3 讨论
胃癌的发病率位于所有恶性肿瘤的第四位,死亡率列于第二位,是常见的恶性肿瘤。我国每年因胃癌而死亡的人数占所有由恶性肿瘤引起死亡总人数的近25%[6]。研究表明,肿瘤的发展可能与患者自身免疫功能受损有关[7,8]。MDSCs作为与肌体免疫应答和肿瘤免疫逃逸有关的一群细胞,已经被证实在众多肿瘤疾病中起着重要的作用[3-5,9]。因此,本研究以胃癌患者外周血、肿瘤组织和健康体检者外周血为研究对象,通过流式细胞仪检测以 HLA-DR-/CD11b+/CD33+为标记的 MDSCs所占比例,分析其表达特点和临床资料间的关系。

表1 胃癌患者术前、术后4周与健康体检者外周血MDSCs表达
表2 胃癌患者肿瘤灶与外周血MDSCs表达(±s)

表2 胃癌患者肿瘤灶与外周血MDSCs表达(±s)
?
表3 胃癌患者外周血MDSCs表达水平与临床资料的关系(±s)
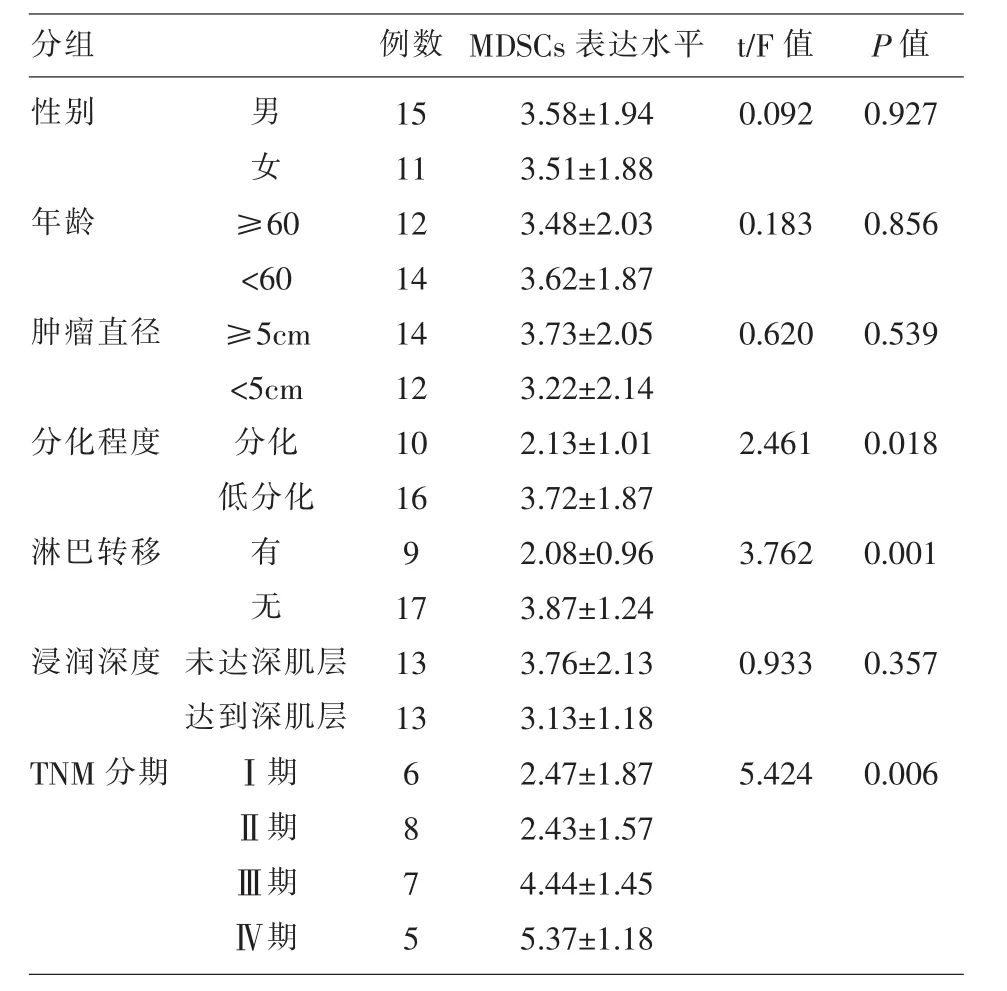
表3 胃癌患者外周血MDSCs表达水平与临床资料的关系(±s)
分组性别 男女0.0920.927年龄0.1830.856肿瘤直径0.6200.539分化程度≥60<60≥5cm<5cm分化低分化2.4610.018淋巴转移 有无3.7620.001浸润深度例数 MDSCs表达水平 t/F值 P值15 11 12 14 14 12 10 16 9 17 13 13 0.9330.357 TNM分期未达深肌层达到深肌层Ⅰ期Ⅱ期Ⅲ期Ⅳ期6 8 7 5 3.58±1.94 3.51±1.88 3.48±2.03 3.62±1.87 3.73±2.05 3.22±2.14 2.13±1.01 3.72±1.87 2.08±0.96 3.87±1.24 3.76±2.13 3.13±1.18 2.47±1.87 2.43±1.57 4.44±1.45 5.37±1.18 5.4240.006
本研究结果1表明,胃癌患者术前外周血MDSCs表达高于健康体检者,且手术后4周的外周血MDSCs表达虽较术前有所降低,但仍高于健康体检者。这可能与肿瘤组织释放一系列的肿瘤来源的TDFs刺激MDSCs前体细胞增殖分化为MDSCs有关,与Sinha[10]等的研究结果一致。当手术切除肿瘤灶后,TDFs的释放随之减少,MDSCs前体细胞转化为MDSCs的刺激因素减少,导致MDSCs的表达降低,但仍较体检健康者高,提示刺激MDSCs增殖转化因素的存在是有一定时间的,这种免疫受损的状态具体需要多久才能恢复正常,尚需进一步研究。
本研究结果2表明,胃癌患者肿瘤灶MDSCs表达高于外周血,且二者呈正相关关系。尽管有众多研究报道,肿瘤灶中MDSCs表达高于外周血的表达,但同时也有相反的报道。Feng[11],Sun[12],Eruslanov[13]等认为在非小细胞肺癌、肠癌、膀胱癌肿瘤灶中MDSCs表达高于外周血,Gros[14]等认为在黑色素瘤患者外周血中MDSCs表达高于肿瘤灶。这可能与肿瘤灶微环境中刺激MDSCs增殖转化的因素高于外周血有关,但具体受哪些因素调节,及肿瘤灶中微环境与外周血微环境的区别有何不同,仍需要进一步研究。
本研究结果3表明,胃癌患者外周血中MDSCs表达与肿瘤TNM分期、有无淋巴转移、肿瘤分化程度相关,与患者性别、年龄、肿瘤大小、浸润深度不相关。胃癌肿瘤TNM分期越高,外周血中MDSCs表达越高,这一结果与Diaz-Montero[15]在乳腺癌中的研究结果相一致,这一结果提示,随着肿瘤的发展,越来越多可刺激MDSCs增殖转化的因素上调了外周血MDSCs表达,同时由于MDSCs具有抑制肿瘤免疫系统作用,可使患者免疫系统受损,导致肿瘤进一步增殖和转移,进而印证了外周血中MDSCs表达与淋巴转移、肿瘤分化程度相关。因此,该结果提示,胃癌患者外周血MDSCs表达可反映出肿瘤发展情况,可以作为临床监测指标。
综上所述,胃癌患者外周血HLA-DR-CD11b+CD33+MDSCs表达可能与胃癌的发生发展密切相关,MDSCs有可能成为评估胃癌预后的指标。关于具体的机制研究还需进一步探讨。
[1]Gabrilovich DI,Nagaraj S.Myeloid-derived-suppressor cells as regulators of the immune system[J].Net Rev Immunol,2009,9(3):162-174.
[2]Talmadge JE,Gabrilovich DI.History of myeloid derived suppressor cells(MDSCs)in the macro-and micro-environment of tumourbearing hosts[J].Nat Rev Cancer,2013,13(10):739-753.
[3]Alizadeh D,Trad M,Hanke NT,et al.Doxorubicin eliminates myeloid-derived suppressor cells and enhances the efficacy of adoptive T-cell transfer in breast cancer[J].Cancer Res,2014,74(1):104-118.
[4]Kawano M,Mabuchi S,Matsumoto Y,et al.The significance of GCSF expression and myeloid-derived suppressor cells in the chemoresistance of uterine cervical cancer[J].Sci Rep-uk,2015,5:18217-18217.
[5]Wu P,Wu D,Ni C,et al. γδT17 cells promote the accumulation and expansion of myeloid-derived suppressor cells in human colorectal cancer[J].Immunity,2014,40(5):785-800.
[6]欧阳骞,陈慧娟,徐芳菲,等.辛伐他汀诱导胃癌BGC-823细胞凋亡的效应研究[J].实验与检验医学,2017,35(6):842-844.
[7]Lee K,Hwang H,Nam KT.Immune response and the tumor microenvironment:how they communicate to regulate gastric cancer[J].GUT LIVER,2014,8(2):131-139.
[8]祝仲珍,王占科,傅颖媛.肿瘤患者自体外周血CIK/DC-CIK细胞培养制备技术及临床应用研究进展 [J].实验与检验医学,2015,33(3):300-303.
[9]朱红胜,胡红心,刘莱,等.胃肠道恶性肿瘤患者外周血髓源抑制细胞的检测[J].实验与检验医学,2013,31(6):554-555+558.
[10]Sinha P,Okoro C,Foell D,et al.Proinflammatory S100 proteins regulate the accumulation of myeloid-derived suppressor cells[J].J Immunol,2008,181(7):4666-4675.
[11]Feng PH,Lee KY,Chang YL,et al.CD14+S100A9+monocytic myeloid-derived suppressor cells and their clinical relevance in non-small cell lung cancer[J].AM J Resp Crit Care,2012,186(10):1025-1036.
[12]Sun HL,Zhou X,Xue YF,et al.Increased frequency and clinical significance of myeloid-derived suppressor cells in human colorectal carcinoma[J].World J Gastroentero:WJG,2012,18(25):3303-3309.
[13]Eruslanov E,Neuberger M,Daurkin I,et al.Circulating and tumor-infiltrating myeloid cell subsets in patients with bladder cancer[J].Int J Cancer,2012,130(5):1109-1119.
[14]Gros A,Turcotte S,Wunderlich JR,et al.Myeloid cells obtained from the blood but not from the tumor can suppress T-cell proliferation in patients with melanoma[J].Clin Cancer Res,2012,18(19):5212-5223.
[15]Diaz-Montero CM,Salem ML,Nishimura MI,et al.Increased circulating myeloid-derived suppressor cells correlate with clinical cancer stage,metastatic tumor burden,and doxorubicin-cyclophosphamide chemotherapy[J].Cancer Immunol Immun,2009,58(1):49-59.
