压力感知导管行环肺静脉电隔离术治疗阵发性心房颤动13例
2018-06-21詹碧鸣陈杰龙程晓曙胡建新
肖 源, 詹碧鸣, 陈杰龙, 程晓曙, 胡建新
心房颤动(AF)患病率随年龄增加而增高[1],患者脑卒中、心功能不全和死亡风险均明显增加,生活质量下降[2-3]。 有关 AF 指南[4]推荐对药物难治性阵发性AF作导管射频消融的环肺静脉电隔离(circumferential pulmonary vein isolation,CPVI)术,防止AF发作(Ⅰ类A级)。消融术后较高复发率可能是限制其发展的重要因素,但复发机制尚无统一解释,多认为术中出现肺静脉漏点可能增加复发,且其形成原因与肺静脉消融时无法形成透壁损伤有关[5]。手术中术者多望通过连续性透壁损伤提高肺静脉隔离率,但损伤深度、面积过大有可能发生心脏压塞,而损伤深度、面积与射频功率和持续时间、电极温度、电极尺寸、灌注、局部血流、导管头端与心房壁贴靠等因素有关[6]。以往很多消融导管无法达到实时压力感知,仅凭借术者经验及手感并依据透视、腔内局部电图及阻抗等作消融。新出现的压力感知导管在消融过程中能实时监测导管远端与心房壁接触力(contact force,CF),动态优化射频消融功率和产生损伤的放电时间,避免血栓、心包积液及食管漏形成,为提高CPVI率,减少手术并发症发生提供了可能。本研究分析总结13例阵发性AF患者经压力感知导管治疗经验。现报道如下。
1 材料与方法
1.1 临床资料
选取2015年8月至2016年4月南昌大学第二附属医院采用压力感知导管(ThermoCool®、SmartTouchTM)行首次CPVI治疗的13例阵发性AF患者作为研究对象,其中男7例,女6例;年龄47~72 岁,平均(63.1±7.0)岁;伴有高血压 7 例,冠心病2例,糖尿病2例,1例术前动态心电图提示阵发性室上性心动过速(室上速)(表 1)。 纳入标准[7]:①年龄≥18岁非瓣膜性AF,且不愿长期坚持口服抗凝药物或有抗凝药物禁忌证,既往服用至少1种抗心律失常药物无效;②入组前12个月至少有1次发作病史记录的症状性阵发性AF,记录有12导联心电图或动态心电图(Holter);③食道超声或左心房CT排除左心耳血栓,有射频消融指征;④能够并愿意接受所有术前、术后和随访检查。排除标准:①接受过外科消融或导管消融治疗;②2个月内接受过经皮冠状动脉介入治疗(PCI)、瓣膜外科或介入手术(心室切开术、心房切开术、人工瓣膜置换或瓣膜修补术);③6个月内接受过冠状动脉旁路移植术,12个月内有血栓栓塞史,包括短暂性脑缺血发作(TIA);④持续性AF,失代偿性心力衰竭,美国纽约心脏病协会(NYHA)心功能分级Ⅲ~Ⅳ级;⑤植入埋藏式心脏复律除颤器(ICD)。
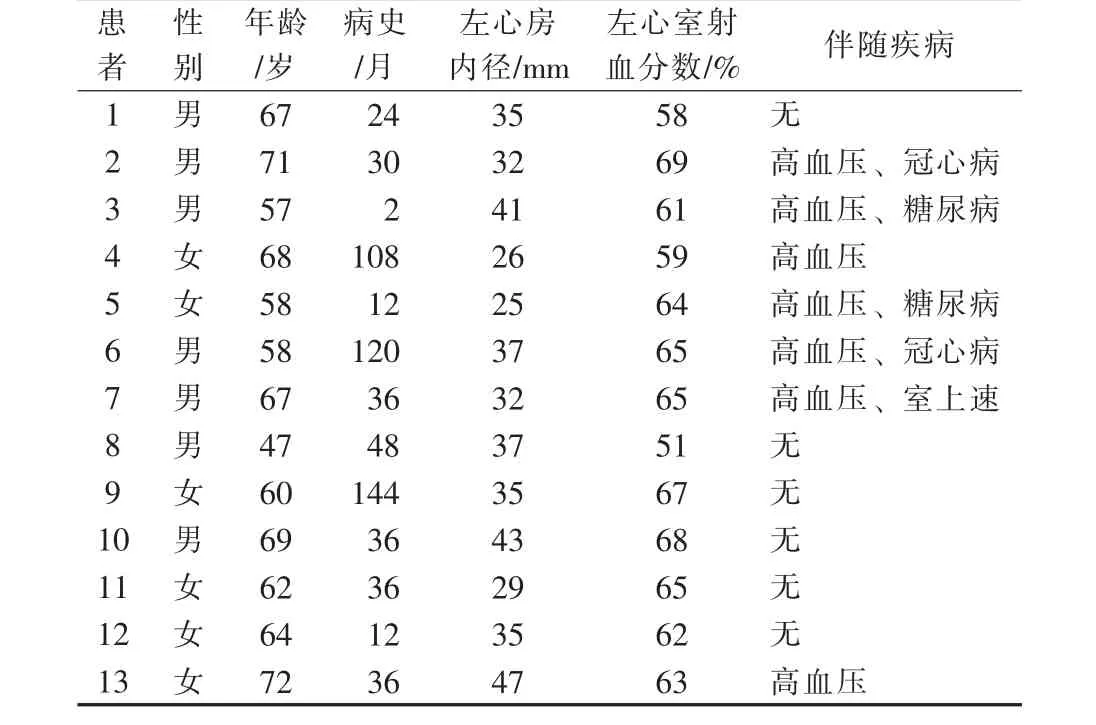
表1 13例阵发性AF患者一般资料
1.2 CPVI方法
术前停用抗心律失常药物至少5个半衰期,完善血常规、肝肾功能、凝血功能及心电图/动态心电图等检查。手术当日或前1日常规接受经食管超声心动图(TEE)或左心房CT检查。入院时停用抗凝药物,改以低分子肝素皮下注射(1次/12 h),手术当日停用。患者均签署知情同意书。
患者取平卧位,心电监护,左侧锁骨下静脉穿刺置入6 F鞘管,经左锁骨下静脉鞘管置入冠状静脉窦(CS)10电极作为Carto 3系统参考电极;右股静脉穿刺,J形导丝导引下分别置入2根8.0/8.5 F Swartz L1长鞘,穿刺针经Swartz L1长鞘穿刺房间隔,造影证实进入左心房;撤开穿刺针,将J形长导丝送入长鞘反复多次扩张房间隔穿刺口,回撤J形导丝及长鞘扩张管,以同样方法第2次穿刺房间隔,经其中1根长鞘送入Judkins 4.0右冠状动脉造影导管,送至左肺静脉口,另一长鞘送至右肺静脉口,于左肺静脉右前斜位45°、右肺静脉左前斜位45°作选择性造影,退出造影导管;分别经Swartz L1长鞘送入压力感知导管、15极Lasso标测电极(CS 7~8极为参考电极),Carto 3系统(美国Biosense Webster公司)导引下构建左心房3 D模型,勾勒二尖瓣瓣环、左心耳、左上肺静、左下肺静脉、右上肺静脉及右下肺静脉;压力感知导管分别在环肺静脉周围作消融线定口,预标环静脉消融线(预设能量30 W、温度上线43℃,导管消融阈值为最大移动稳定范围2 mm,最小时间3 s,导管CF上限阈值为40 g,下限阈值为5 g,压力警示值50 g),进行环静脉消融;肺静脉成功隔离后行左心房程序刺激,未诱发AF及心房扑动(房扑)等心律失常,消融后30 min异丙肾上腺素静脉诱发验证传入、传出双向传导阻滞,如果出现自主或诱发AF和/或房扑,评估是否于肺静脉口以外部位作其它射频消融治疗(心房复杂碎裂电位消融、线性消融、左心房和/或右心房中任何非肺静脉局灶消融等)。
1.3 随访策略
CPVI术后 3、6、9、12个月随访, 如果患者接受重复消融,不重新设置随访。收集AF/房性心动过速(房速)/房扑复发及治疗、心电图/24 h动态心电图及抗心律失常(包括抗凝)治疗等数据。术后3、6、9、12个月随访后分别予以电话传输心电图监测(TTM)仪监测8周,并传输记录每周数据;8周后直至12个月随访结束期间,若无心律失常症状发作,则每月监测记录1次。
2 结果
13例阵发性AF患者CPVI术中临床资料见表2。9例患者术中程序刺激未能诱发AF及房扑,予异丙肾上腺素静脉诱发验证观察到传入传出双向阻滞。3例患者未能终止AF或未观察到双向阻滞,其中患者7因普通心电图有发作性室上速,心内电生理检查证实为左侧旁路,遂行左侧旁道消融,后行心房心室程序S1S2刺激未诱发心律失常;患者9消融后观察到双侧肺静脉电位均有恢复,考虑为左肺静脉后上口及右肺静脉前上口电位传导缝隙形成,消融时AF发作,遂于术后作左心房房顶线消融,再行右肺静脉前庭补点消融,AF终止,后予程序刺激及药物刺激均未诱发;患者13于左心房基质标测时提示左心房后壁有少量低电压区域,遂行房顶线线性消融。另1例患者(患者2)术中出现心脏压塞,未行程序刺激及药物诱发,心包穿刺引流出不凝血约800 mL,转至心胸外科行开胸探查止血术,术中见左心耳根部内侧黏膜破损,出血明显,术后好转出院。所有患者术后均以胺碘酮预防心律失常发生,其中10例口服达比加群酯(110 mg,2次/d),3例口服华法林抗凝治疗。随访12个月后,患者8第9个月时TTM提示AF,患者11第6个月时动态心电图提示短阵房速,患者1、2、4第9个月时动态心电图提示短阵房速,但上述患者均无胸闷、心悸等不适。
3 讨论
导管射频消融仍为AF治疗主流术式,各种AF消融成功率为60%~85%,远期随访未复发率更低。因此,迫切需要进一步提高AF消融成功率[8],较高复发率也是亟待解决的问题。研究表明,肺静脉未达完全隔离和左心房与之前隔离的肺静脉间传导恢复,是AF复发重要因素[9]。常规消融导管消融后肺静脉漏点多,左心房-肺静脉间电传导恢复率高,已成为AF复发的主要原因[10]。有研究表明,与射频输出功率相比,CF与病变形成及大小有较大影响[11],且与压力-时间积分(FTI)、损伤大小、临床疗效等密切相关[11-13]。肺静脉间传导重新连接也与CF低(<10 g)有密切关系,消融点为理想贴靠(CF为15~40 g)时肺静脉传导恢复及 AF 复发降低[14-15],CF过大(>40 g)时易引起心脏压塞[16],适宜的 CF 对损伤深度、面积,避免肺静脉重新连接至关重要。压力感知导管通过感知连接导管尖端与导管轴间微弹簧精确形变实时反映导管-组织CF[17],并实时监测及调整,防止CF不足无法形成透壁损伤,但CF过高则增加心脏穿孔危险[18]。与压力感知导管相比,传统导管虽可依据透视、腔内局部电图及阻抗等作消融,但贴靠的CF变异程度仍较大,存在贴靠不佳情况,且稳定性也不够[18-19]。压力感知导管凭借良好的贴靠及稳定的CF,有助于增加消融程度及面积,减少左心房-肺静脉间重新连接,提高手术疗效。多数研究显示,压力感知导管应用能够减少手术时间及曝光时间[20-23]。也有meta分析提示,压力感知导管与其它导管相比,消融时并不能减少手术曝光时间[24]。但文献报道多认为压力感知导管消融能降低AF术后复发率[23-25]。本组患者随访12个月,13例中1例随访9个月时TTM记录到AF,4例动态心电图提示短阵性房速,总体复发率较低。
文献报道AF射频消融围手术期相关并发症发生率为3.9%~6%,心脏穿孔属严重并发症,易导致心脏压塞,是死亡主要原因[26-27]。 Bunch 等[28]报道显示心脏穿孔约60%发生于左心房,6.7%发生于右心房,右心室约33.3%,主要原因为术中未及时发现,直至出现血流动力学紊乱,86.7%患者需行超声导引下心包穿刺抽液术,其中包括延迟的较严重心包积液所致心脏压塞患者。一项纳入1 517例(其中采用压力感知导管248例)研究对象的前瞻性试验研究显示,CF应用导管组、非CF导管组围手术期主要并发症分别为2.1%、7.8%(P=0.010),心脏穿孔发生率分别为 0.0%、1.6%(RR=0.76,95%CI=0.74~0.79,P=0.031)[29]。 本组 1 例患者出现严重并发症(术中应用功率为42 W,平均CF为26 g),考虑与CF及能量过高有关,且术中未及时发现心脏穿孔也可能与其相关,最后予以外科手术解决心脏压塞,术中证实破损发生在左心耳根部内侧黏膜处。总之,压力监测可实时提供CF下预测的损伤面积,并及时反馈,主动调整功率输出,避免远端压力过高,较好地减少了并发症发生。
本研究虽属前瞻性研究,但样本量较小,且数据来源并非单一术者,对压力感知导管应用熟练度不够,具有一定局限性。采用压力感知导管行CPVI治疗药物难治的阵发性AF安全有效,但远期疗效及预后尚需多中心、大样本研究随访观察。
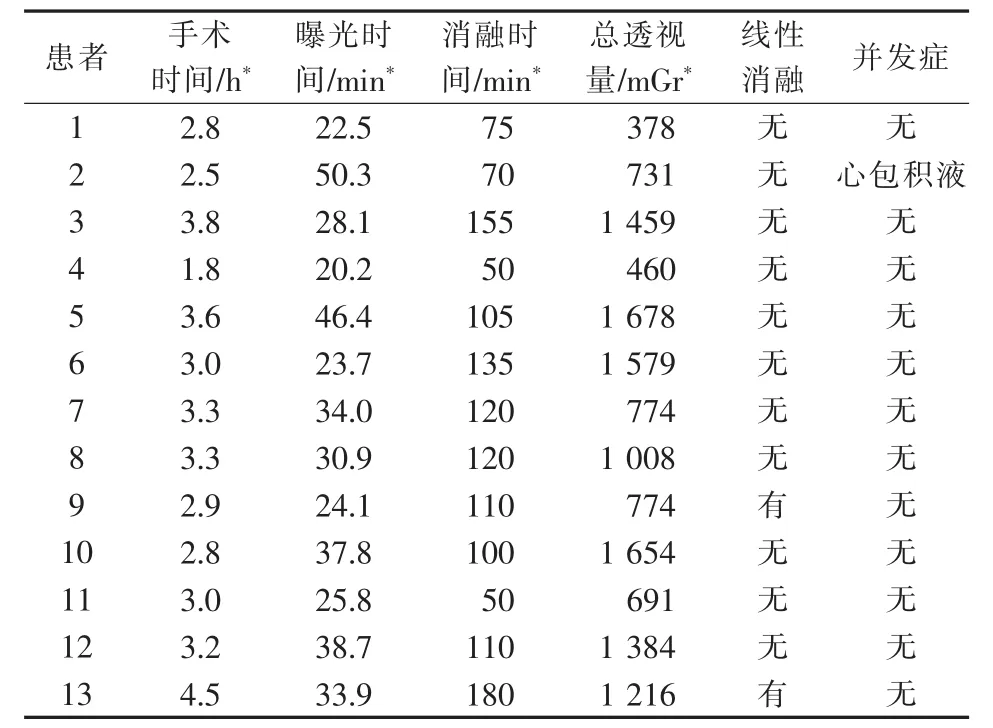
表2 13例阵发性AF患者CPVI术中临床资料
[1] Wilke T,Groth A,Mueller S,et al.Incidence and prevalence of atrial fibrillation: an analysis based on 8.3 million patients[J].Europace,2013,15:486-493.
[2] Benjamin EJ, Wolf PA, D'Agostino RB,et al.Impact of atrial fibrillation on the risk of death: the Framingham Heart Study[J].Circulation,1998,98:946-952.
[3] Chugh SS, Blackshear JL,Shen WK,et al.Epidemiology and natural history of atrial fibrillation: clinical implications[J].J Am Coll Cardiol, 2001, 37: 371-378.
[4] Calkins H, Kuck KH, Cappato R, et al.2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation:recommendations for patient selection, proceduraltechniques, patientmanagementand follow-up, definitions, endpoints, and research trial design[J].Europace,2012,14:528-606.
[5] Park CI,Lehrmann H,Keyl C,et al.Mechanisms of pulmonary vein reconnection after radiofrequency ablation of atrial fibrillation:the deterministic role of contact force and interlesion distance[J].J Cardiovasc Electrophysiol, 2014, 25: 701-708.
[6] Wittkampf FH, Nakagawa H.RF catheter ablation: lessons on lesions[J].Pacing Clin Electrophysiol, 2006, 29: 1285-1297.
[7] Knecht S, Reichlin T, Pavlovic N, et al.Contact force and impedance decrease during ablation depends on catheter location and orientation:insights from pulmonary vein isolation using a contact force-sensing catheter[J].J Interv Card Electrophysiol,2015,43: 297-306.
[8] 于宏颖,潘震华,李艳红,等.环肺静脉消融联合去迷走神经化治疗心房颤动的临床研究[J].介入放射学杂志,2014,23:569-571.
[9] Ganesan AN,Shipp NJ,Brooks AG,et al.Long-term outcomes of catheter ablation of atrial fibrillation:a systematic review and meta-analysis[J].J Am Heart Assoc, 2013, 2: e004549.
[10] Cappato R,Negroni S,Pecora D,et al.Prospective assessment of late conduction recurrence across radiofrequency lesions producing electrical disconnection at the pulmonary vein ostium in patients with atrial fibrillation[J].Circulation, 2003, 108:1599-1604.
[11] Yokoyama K,Nakagawa H,Shah DC,et al.Novel contact force sensor incorporated in irrigated radiofrequency ablation catheter predicts lesion size and incidence of steam pop and thrombus[J].Circ Arrhythm Electrophysiol, 2008, 1: 354-362.
[12] Lin H,Chen YH,Hou JW,et al.Role of contact force-guided radiofrequency catheter ablation for treatment of atrial fibrillation:a systematic review and meta-analysis[J].J Cardiovasc Electrophysiol, 2017, 28: 994-1005.
[13] Shah DC,Lambert H,Nakagawa H,et al.Area under the realtime contact force curve(force-time integral) predicts radiofrequency lesion size in an in vitro contractile model[J].J Cardiovasc Electrophysiol, 2010, 21: 1038-1043.
[14] Haldar S, Jarman JW, Panikker S, et al.Contact force sensing technology identifies sites of inadequate contact and reduces acute pulmonary vein reconnection:a prospective case control study[J].Int J Cardiol, 2013, 168: 1160-1166.
[15] Reddy VY,Shah D,Kautzner J,et al.The relationship between contact force and clinical outcome during radiofrequency catheter ablation of atrial fibrillation in the TOCCATA study[J].Heart Rhythm,2012,9:1789-1795.
[16]Nazeri A, Ganapathy A, Massumi A, et al.Contact-force recovery can predict cardiac perforation during radiofrequency ablation[J].Pacing Clin Electrophysiol, 2014, 37: 1129-1132.
[17]谭红伟,张旭敏,邹 誉,等.压力感知导管消融治疗心房颤动的效果观察[J].山东医药, 2016, 56: 44-46.
[18]姚 焰.导管消融心房颤动的新进展[J].中国循环杂志,2014,29: 661-663.
[19] Kumar S, Haqqani HM, Chan M, et al.Predictive value of impedance changes for real-time contact force measurements during catheter ablation of atrial arrhythmias in humans [J].Heart Rhythm,2013,10:962-969.
[20] Lee G, Hunter RJ, Lovell MJ, et al.Use of a contact forcesensing ablation catheter with advanced catheter location significantly reduces fluoroscopy time and radiation dose in catheter ablation of atrial fibrillation[J].Europace, 2016, 18:211-218.
[21] Naniwadekar A, Joshi K, Greenspan A, et al.Use of the new contact force sensing ablation catheter dramatically reduces fluoroscopy time during atrial fibrillation ablation procedures[J].Indian Pacing Electrophysiol J, 2016, 16: 83-87.
[22] Jarman JW, Panikker S, Das M, et al.Relationship between contact force sensing technology and medium-term outcome of atrial fibrillation ablation:a multicenter study of 600 patients[J].J Cardiovasc Electrophysiol, 2015, 26: 378-384.
[23]Marijon E, Fazaa S, Narayanan K, et al.Real-time contact force sensing for pulmonary vein isolation in the setting of paroxysmal atrial fibrillation: procedural and 1-year results[J].J Cardiovasc Electrophysiol, 2014, 25: 130-137.
[24]Qi Z, Luo X, Wu B, et al.Contact force-guided catheter ablation for the treatment of atrial fibrillation:a meta-analysis of randomized, controlled trials[J].Braz J Med Biol Res, 2016,49:e5127.
[25] Afzal MR, Chatta J, Samanta A, et al.Use of contact force sensing technology during radiofrequency ablation reduces recurrence of atrial fibrillation:a systematic review and metaanalysis[J].Heart Rhythm, 2015, 12: 1990-1996.
[26]Cappato R,Calkins H,Chen S A,et al.Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation[J].Circulation, 2005, 111: 1100-1105.
[27] Bertaglia E, Zoppo F, Tondo C, et al.Early complications of pulmonaryvein catheterablation foratrialfibrillation: a multicenter prospective registry on procedural safety[J].Heart Rhythm,2007,4:1265-1271.
[28] Bunch TJ, Asirvatham SJ, Friedman PA, et al.Outcomes after cardiac perforation during radiofrequency ablation of the atrium[J].J Cardiovasc Electrophysiol, 2005, 16: 1172-1179.
[29] Akca F, Janse P, Theuns DA, et al.A prospective study on safety of catheter ablation procedures:contact force guided ablation could reduce the risk of cardiac perforation[J].Int J Cardiol, 2015, 179: 441-448.
