罗氏海盘车性腺脂质的微波提取及其成分分析
2018-06-21楼乔明王云鹏张进杰杨文鸽徐大伦
楼乔明,徐 华,王云鹏,张进杰,杨文鸽,徐大伦
(宁波大学海洋学院,宁波 315211)
0 引 言
海星(stelleroids,starfishes),又名海盘车,为棘皮动物门(Echinodermata)海星纲(Asteroidea)动物,是海洋常见大型无脊椎动物之一。目前全世界约有海星1 800种,中国沿海约有100多种,年捕捞量达数十万t[1]。海星性腺,又称海星黄,是海星重要的可食用部位,其富含大量活性成分,如皂苷、生物碱、多糖、蛋白质、多肽和氨基酸等,具有抗癌、抗病毒、降血压和降血脂等多种生理和药理活性[2]。罗氏海盘车(Asterias rollestoni)广泛分布于中国黄海、东海海域以及俄罗斯远东和日本沿海,是重要的海洋药物和功能食品原料,具有很高的营养价值和开发潜力[3-4]。目前,国内外关于罗氏海盘车的研究主要集中在皂苷、多糖、生物碱等方面[5-7],而对其性腺的脂质提取、脂质成分分析及营养评价等方面均鲜有研究报道。
微波辅助提取技术是在传统有机溶剂萃取基础上发展起来的一种新型萃取技术,其通过微波加热作用,加速被萃取成分向萃取溶剂界面扩散,具有萃取时间短、效率高、能耗低和适于工业化生产等优点[8]。近年来,微波辅助提取技术受到国内外众多学者的关注,并已日益应用于油脂提取[9-11]。因此,本研究以罗氏海盘车为原料,采用微波辅助提取技术对其性腺脂质的提取工艺进行优化,并采用核磁共振和气相色谱-质谱分别对其脂质成分和脂肪酸组成进行分析,以期为罗氏海盘车性腺脂质的微波提取和成分分析以及海星资源的综合开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
罗氏海盘车购于烟台九田海鲜批发城,个体质量(75.66±15.04)g,性腺指数(28.71±4.29)%。取罗氏海盘车性腺,经冷冻干燥、粉碎和40目过筛,储存于4 ℃冰箱中备用。
氘代氯仿(CDCl3,氘代度99.8%+0.03%四甲基硅烷)购于阿拉丁试剂(上海)有限公司;37种脂肪酸甲酯混标、鱼油脂肪酸甲酯混标购于美国Sigma公司;正己烷、乙酸乙酯、丙酮、乙醇、石油醚等分析纯购于国药集团化学试剂有限公司。
1.2 仪器与设备
MARS 6型微波消解系统,美国CEM公司;RV-10型旋转蒸发仪,德国IKA公司;AVANCE Ⅲ 400 MHz超导核磁共振谱仪,瑞士Bruker公司;7890A型气相色谱仪,美国Agilent公司;M7-80EI型质谱仪,北京普析通用仪器有限公司。
1.3 试验方法
1.3.1 脂质提取工艺流程
取2 g罗氏海盘车性腺粉末置于萃取管中,加入提取溶剂,并在适当条件下进行提取;提取结束后将提取液过滤,滤液在37 ℃条件下,经40 kPa减压浓缩10 min,并于105 ℃干燥至恒质量,并按公式(1)计算脂质提取率。

1.3.2 单因素试验
在微波功率800 W、液料比5 mL/g、提取时间10 min和提取温度60 ℃的常规参数条件下,测定不同提取溶剂(正己烷、丙酮、乙酸乙酯、乙醇、石油醚)对罗氏海盘车性腺脂质提取率的影响。采用最佳提取溶剂,以液料比(3、4、5、6、7 mL/g)、提取时间(6、8、10、12、14 min)和提取温度(30、40、50、60、70 ℃)3个单因素变量替换工艺流程中相应的常规参数,测定上述 3个因素对罗氏海盘车性腺脂质提取率的影响。
1.3.3 正交优化试验
在单因素试验基础上,以脂质提取率为指标,采用极差法对液料比、提取时间和提取温度进行正交优化试验,正交因素水平表见表1。

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal test
1.3.4 核磁共振分析
取50 mg罗氏海盘车性腺脂质,加入0.6 mL氘代氯仿溶解,转移至核磁管中用于核磁共振分析。氢谱参数:脉冲序列zg30,检测温度为296.4 K,90°脉冲宽度P1为10.00 μs,谱宽为8 012.82 Hz,脉冲延迟时间D1为1 s,采样点数为65 536,扫描次数为8,空扫次数为2;碳谱参数:脉冲序列zgpg30,检测温度297.1 K,90°脉冲宽度P1为9.50 μs,谱宽为24 038.46 Hz,脉冲延迟时间D1为2 s,采样点数为65 536,扫描次数为1 024,空扫次数为 4。氢谱和碳谱的化学位移均以四甲基硅烷(tetramethylsilane,TMS)为标准校正。使用MestReNova软件对图谱进行处理和分析。
1.3.5 脂肪酸分析
甲酯化衍生法[12]:取10 mg罗氏海盘车性腺脂质,加入1 mL 10%浓硫酸-甲醇溶液,于60℃水浴中甲酯化30 min,冷却后加入1 mL正己烷振荡,静置分层取上清液进行GC-MS分析。
色谱条件:DB-WAX毛细管柱(30 m × 0.25 mm ×0.25 μm),进样口温度250 ℃,检测器温度250 ℃;升温程序:初始温度150 ℃,保持2 min,以5 ℃/min升至200 ℃,保持5 min,再以5 ℃/min升至250 ℃,保持10 min,整个分析过程37 min;进样量1.0 μL,分流比50∶1;以氦气为载气,载气流量1 mL/min。
质谱条件:GC-MS接口温度 250℃,EI(electron impact)离子源,离子源温度200℃,电离能量70 eV,质量扫描范围:m/z 50~650 u。
1.3.6 脂肪酸营养评价
参考朱成科等[13]计算罗氏海盘车性腺的脂肪酸致动脉粥样硬化指数(atherogenic index,AI)和血栓形成指数(thrombogenic index,TI),以评估罗氏海盘车性腺脂肪酸对人类心血管疾病发生的影响,AI及 TI计算见式(2)~(3)。

式中MUFA(monounsaturated fatty acids)为单不饱和脂肪酸,PUFAn-6(n-6 polyunsaturated fatty acids)为n-6型多不饱和脂肪酸,PUFAn-3(n-3 polyunsaturated fatty acids)为n-3型多不饱和脂肪酸,C12:0、C14:0 、C16:0、C18:0分别为不同种类的脂肪酸。
1.4 数据处理
单因素试验和正交优化试验平行测定 3次,采用单因素方差分析法(ANOVE,Tukey检验)进行显著性检验,并通过Duncan’s法进行单因素多重比较分析,P<0.05为差异显著。
2 结果与分析
2.1 单因素试验
将提取溶剂、液料比、提取时间和提取温度设为试验因素,测定上述 4种因素的不同水平对罗氏海盘车性腺脂质提取率的影响,试验结果见图1。
由图 1a可知,3种溶剂对提取率无显著差异(P>0.05);而正己烷和石油醚的提取率显著低于乙酸乙酯、丙酮和乙醇(P<0.05),这是由溶剂的介电常数和脂质在溶剂中的溶解性所共同决定。5种溶剂对脂质均具有较好的溶解性,但石油醚和正己烷的介电常数较低,对微波辐射能的吸收较弱,致使 2种溶剂的提取效果不佳[14]。孙协军等[15]采用微波辅助提取技术对盐藻油进行提取,发现乙酸乙酯的提取率最高,丙酮次之,而石油醚最低,这与本研究的结果一致。因此,选取乙酸乙酯作为提取溶剂,用于后续单因素试验和正交优化试验。
由图1b可知,当液料比为3~6 mL/g时,脂质提取率随液料比的增大而显著增加(P<0.05);当液料比为6 mL/g时,脂质提取率达到最大值(31.84%);继续增加液料比对脂质提取率无显著影响(P>0.05)。这是因为液料比的增加使原料与提取溶剂之间的接触面积和脂质浓度差增大,进而提高传质速率和脂质提取率;但当液料比太大时,部分微波被提取溶剂吸收,而使原料内部的微波作用减少,细胞破碎能力减弱,致使脂质提取率降低[16]。

图1 不同因素对罗氏海盘车性腺脂质提取率的影响Fig. 1 Effects of different factors on extraction rates of Asterias rollestoni gonad lipids
由图1c可知,当提取时间为6~10 min时,脂质提取率随提取时间的增加而显著增大(P<0.05);当提取时间为12 min时,脂质提取率达到最大值;之后,随着提取时间的继续增加,提取率显著降低(P<0.05),这是由于提取时间增加导致原料中部分低沸点成分的挥发所致[17]。
由图1d可知,当提取温度低于60 ℃时,脂质提取率随提取温度的升高而显著增大(P<0.05);当提取温度为60 ℃时,脂质提取率达到最大值(31.26%);之后,继续升高提取温度,脂质提取率显著降低(P<0.05),这是因为高温导致溶剂和部分挥发性油脂损失,从而导致脂质提取率降低[18]。
2.2 正交优化试验
在单因素试验基础上,以乙酸乙酯为提取溶剂,选取液料比(A)、提取时间(B)和提取温度(C)为试验因素,脂质提取率为试验指标,按表 1中的正交试验方法考察各因素对罗氏海盘车性腺脂质提取率的影响,正交试验设计及结果列于表2。

表2 正交实验设计及结果Table 2 Designs and results of orthogonal test
由表 2可知,在微波辅助提取罗氏海盘车性腺脂质的过程中,不同因素对罗氏海盘车性腺脂质提取率的影响大小依次为:液料比>提取温度>提取时间,即液料比对脂质提取率的影响最大,提取温度次之,提取时间最小;上述3因素的最优组合为:A3B2C2,即液料比7 mL/g、提取时间12 min、提取温度60 ℃,在此优化条件下进行验证试验,罗氏海盘车性腺脂质提取率为33.82%。经比较发现,微波提取法的提取率略低于Folch法(35.39%)。Folch法作为脂质提取的经典方法,其所用提取溶剂(三氯甲烷-甲醇)对脂质具有较好的溶解性,且提取时间较长,故脂质提取完全[19];而微波提取法溶剂用量少、毒性低、提取时间短,更适合脂质的工业化生产[8],因此微波提取法是罗氏海盘车性腺脂质提取的有效方法。
2.3 核磁共振分析
2.3.1 氢谱(1H-NMR)分析
根据1H-NMR谱中化学位移和信号模式,并参考Ruiz-Aracama等[20-22]对信号峰进行归属,结果列于表3。化学位移5.41~5.34 ppm谱峰归属为所有不饱和脂肪酸碳碳双键上的氢;5.29~5.26 ppm谱峰为甘油醇次甲基上的氢;4.33~4.29和4.17~4.13 ppm谱峰为甘油醇亚甲基上的氢;3.31 ppm为磷脂酰胆碱(phosphatidylcholine,PC)中与氮原子相连的甲基((CH3)3N-)上的氢;2.85~2.82 ppm谱峰为多不饱和脂肪酸中2个碳碳双键之间的亚甲基上的氢;1.00~0.96 ppm为n-3型多不饱和脂肪酸末端-CH3上的氢,0.90~0.86 ppm谱峰为除n-3型多不饱和脂肪酸之外的其他脂肪酸末端-CH3上的氢;0.94和0.55 ppm谱峰归属为胆固醇中C17位(-CH)和C18位(-CH3)上的氢。
在1H-NMR中,谱峰面积与物质的摩尔浓度成正比[23-24],因此通过2.12~2.00 ppm谱峰可得不饱和脂肪酸与总脂肪酸的摩尔比为0.70,通过1.73~1.69 ppm谱峰可得 C20:5n-3(eicosapentaenoic acid,EPA)和 C20:4n-6(arachidonic acid,ARA)总量与总脂肪酸的摩尔比为0.17,通过1.00~0.96 ppm谱峰可得n-3型多不饱和脂肪酸与总脂肪酸的摩尔比为0.21,此外通过0.55 ppm谱峰可得胆固醇与总脂肪酸的摩尔比为0.02。

表3 罗氏海盘车性腺脂质的1H-NMR谱峰归属Table 3 Peak assignments of 1H-NMR spectrum of Asterias rollestoni gonad lipids
2.3.2 碳谱(13C-NMR)分析
根据13C-NMR谱中化学位移和信号模式,并参考Pollesello等[25-27]对信号峰进行归属,结果列于表4。
表中可知,在羰基谱区(177~172 ppm),176.69 ppm归属为游离脂肪酸羰基碳原子,173.36~172.56 ppm为磷脂和甘油三酯中的羰基碳原子;在烯烃谱区(140~127 ppm),130.23~129.32、128.96~127.62 ppm 分别归属为单不饱和脂肪酸和多不饱和脂肪酸烯烃碳原子;在甘油谱区(75~50 ppm),69.00~68.88、62.07 ppm分别归属为甘油三酯中甘油骨架上 sn-2和sn1,3位碳原子,70.06、62.76 ppm分别归属为磷脂中甘油骨架上sn-2和sn-1位碳原子,54.45 ppm归属为磷脂酰胆碱(PC)中与氮原子相连的甲基碳原子((C H3)3N-)。胆固醇 C3、C17、C9特征峰信号分别出现在71.73、56.17和49.47 ppm。亚甲基谱区(40~20 ppm)包含脂质中脂肪酸链长等信息,20.56 ppm归属为n-3型多不饱和脂肪酸中与端甲基相连的亚甲基碳原子;在甲基谱区(15~11 ppm),14.27~14.00 ppm归属为所有脂肪酸端甲基碳原子,胆固醇C18(-C H3)特征峰信号位于11.83 ppm处。

表4 罗氏海盘车性腺脂质的13C-NMR谱峰归属Table 4 Peak assignments of 13C-NMR spectrum of Asterias rollestoni gonad lipids
通过13C-NMR的谱峰面积对罗氏海盘车性腺脂质进行定量分析可知:甘油三酯与磷脂的摩尔比为 6.53,游离脂肪酸和胆固醇与总脂肪酸的摩尔比为分别为0.01和0.02,表明罗氏海盘车性腺脂质的主要成分为甘油三酯和磷脂,胆固醇和游离脂肪酸含量较低。
2.4 脂肪酸分析
罗氏海盘车性腺脂质经甲酯化衍生和气相色谱-质谱分析,其总离子流色谱分析结果列于表5。从罗氏海盘车性腺脂质中共检测出28种脂肪酸,由C12-C22脂肪酸组成,以 C14:0、C16:0、C18:1n-7、C20:1n-11、C20:5n-3(EPA)和 C22:6n-3(DHA)为主;其中单不饱和脂肪酸占总质量分数的38.77%,高于饱和脂肪酸(34.64%)和多不饱和脂肪酸(26.59%)。罗氏海盘车性腺饱和脂肪酸以C14:0(10.45%)、C16:0(10.69%)、C18:0(7.38%)和 C20:0(5.08%)为主,并含有少量的奇数碳饱和脂肪酸(C15:0和C17:0)和多支链饱和脂肪酸(4,8,12-TMTA)。单不饱和脂肪酸以 C18:1n-7(14.47%)和 C20:1n-11(15.23%)为主,其中,C20:1n-11为海洋动物来源单不饱和脂肪酸的重要组成特征[28]。多不饱和脂肪酸以C20:5n-3(16.81%)和C22:6n-3(4.75%)为主,二者的质量分数达 21.56%,远高于海胆(9.73%)[29]和海参(19.97%)[30]等棘皮动物。同时,罗氏海盘车性腺中n-3 PUFA总质量分数高达23.62%,而n-6 PUFA仅为2.71%,致使两者比值为8.72,远高于国际粮农组织(FAO)和世界卫生组织(WHO)推荐的n-3/n-6日常膳食比值(0.1~0.2)[31],可作为C20:5n-3和C22:6n-3等n-3型多不饱和脂肪酸的重要膳食来源。此外,罗氏海盘车性腺的脂肪酸致动脉粥样硬化指数(AI)和血栓形成指数(TI)分别为0.81和0.29,远低于羊肉(AI为1.00,TI为1.58),表明罗氏海盘车性腺脂肪酸具有较高的不饱和度,能有效调节血脂,预防动脉粥样硬化和血栓形成[11]。
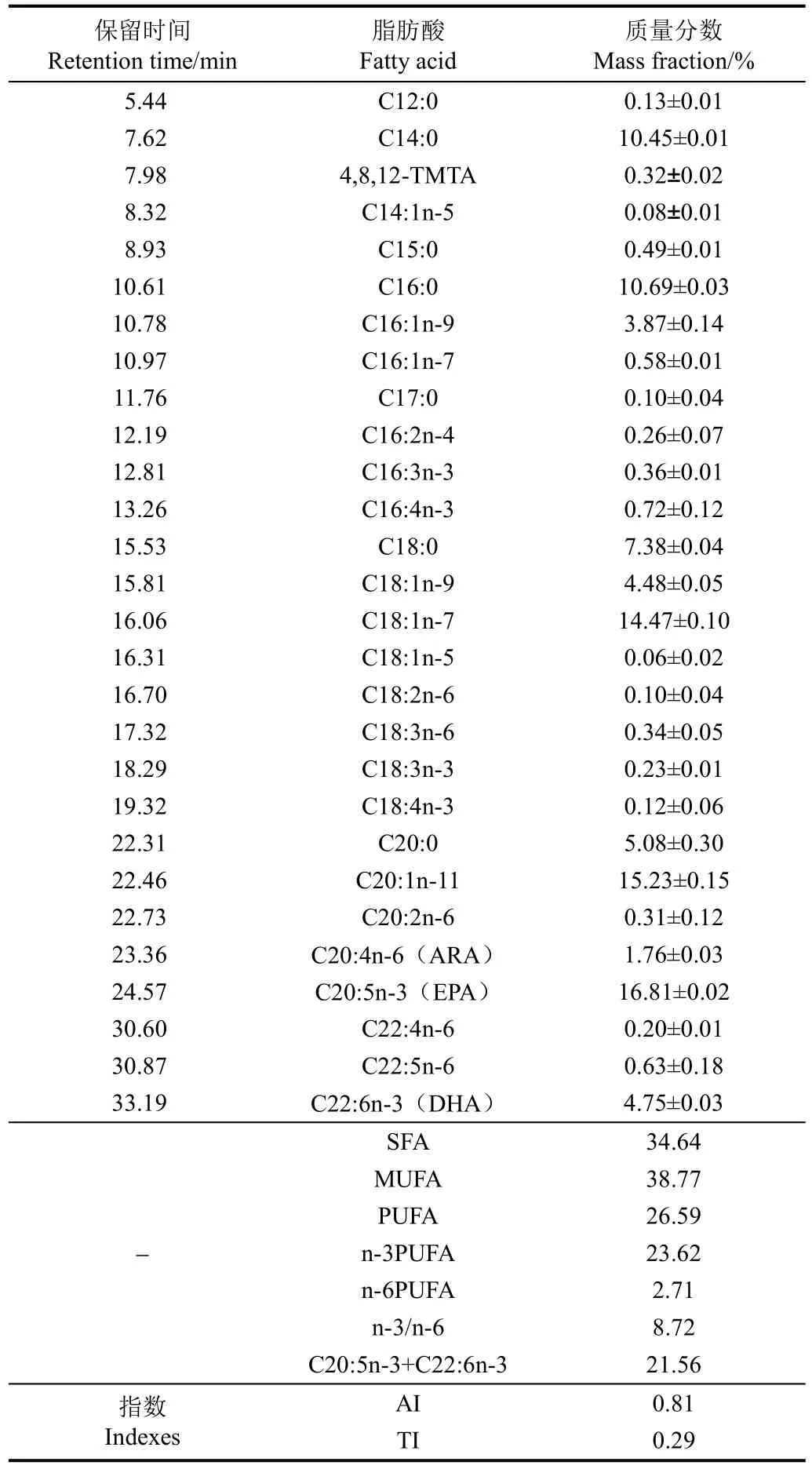
表5 罗氏海盘车性腺脂质的脂肪酸组成Table 5 Fatty acid composition of Asterias rollestoni gonad lipids
3 结 论
1)采用微波辅助提取技术对罗氏海盘车性腺脂质的提取工艺进行优化,通过单因素试验和正交优化试验得到最佳提取工艺条件:以乙酸乙酯为提取溶剂、液料比7 mL/g、提取时间12 min、提取温度60℃,在此优化条件下,罗氏海盘车性腺的脂质提取率为33.82%。
2)罗氏海盘车性腺脂质成分主要为甘油三酯和磷脂,胆固醇和游离脂肪酸含量较低;而脂肪酸以C14:0、C16:0、C18:1n-7、C20:1n-11、C20:5n-3和C22:6n-3为主,其中C20:5n-3和C22:6n-3含量高达21.56%,且脂肪酸致动脉粥样硬化指数和血栓形成指数分别为0.81和0.29,表明罗氏海盘车性腺脂质能有效预防动脉粥样硬化和血栓形成,具有很高营养价值和脂质开发潜力,可作为C20:5n-3和C22:6n-3等功能性脂肪酸的重要膳食来源。
[1] 杜磊,薛长湖,王静凤,等. 海星极性脂脂质体的抗肿瘤活性研究[J]. 中国海洋药物,2011,30(3):47-50.Du Lei, Xue Changhu, Wang Jingfeng, et al. Study on the antitumor effects of Asterias rollestoni polar lipid liposomes[J]. Chinese Journal of Marine Drugs, 2011, 30(3):47-50. (in Chinese with English abstract)
[2] 李虎,陆云阳,孙雨芊,等. 中华疣海星化学成分的研究[J]. 中南药学,2017(4):409-412.Li Hu, Lu Yunyang, Sun Yuqian, et al. Chemical constituents of Pentaceraster chinensis[J]. Central South Pharmacy,2017(4): 409-412. (in Chinese with English abstract)
[3] 张国琛,李莎,张倩,等. 脱毒海星微波真空干燥工艺优化[J]. 农业工程学报,2015,31(16):289-295.Zhang Guochen, Li Sha, Zhang Qian, et al. Optimization of microwave-vacuum drying for detoxified starfish[J].Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(16):289-295. (in Chinese with English abstract)
[4] 张立新,范晓,韩丽君. 罗氏海盘车(Asterias rollestoni)中几种化合物的提取分离和结构鉴定[J]. 天然产物研究与开发,2005,17(1):35-37.Zhang Lixin, Fan Xiao, Han Lijun. Studies on the chemical constituents of the marine starfish Asterias rollestoni[J].Natural Product Research and Development, 2005, 17(1):35-37. (in Chinese with English abstract)
[5] Yang X W, Miao Z, Ma X N, et al. Asterolloside, a novel enolic saccharide from the sea star Asterias rollestoni Bell[J].Tetrahedron Letters, 2015, 56(45): 6174-6176.
[6] Zhang W J, Wang J, Jin W H, et al. The antioxidant activities and neuroprotective effect of polysaccharides from the starfish Asterias rollestoni[J]. Carbohydrate Polymers, 2013,95(1): 9-15.
[7] 宋龙,吕律,王远红,等. 罗氏海盘车(Asterias rollestoni)中2种生物碱的分离纯化及其抗肿瘤活性研究[J]. 中国海洋药物,2016,35(1):50-54.Song Long, Lv Lv, Wang Yuanhong, et al. The preparation and purification of two alkaloids derived from Asterias rollestoni and studies on their antitumor activities[J]. Chinese Journal of Marine Drugs, 2016, 35(1): 50-54. (in Chinese with English abstract)
[8] 韩宗元,李晓静,吴秀月,等. 微波辅助提取桔皮果胶的理化及凝胶特性比较[J]. 农业工程学报,2016,32(23):309-314.Han Zongyuan, Li Xiaojing, Wu Xiuyue, et al.Physicochemical and gel properties of tangerine peel pectins in microwave extraction processing[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(23): 309-314. (in Chinese with English abstract)
[9] Medina A L, Silva M A O, Barbosa H D, et al. Rapid microwave assisted extraction of meat lipids[J]. Food Research International, 2015, 78: 124-130.
[10] Hu B, Li C, Zhang Z, et al. Microwave-assisted extraction of silkworm pupal oil and evaluation of its fatty acid composition, physicochemical properties and antioxidant activities[J]. Food Chemistry, 2017, 231: 348-355.
[11] Taghvaei M, Jafari S M, Assadpoor E, et al. Optimization of microwave-assisted extraction of cottonseed oil and evaluation of its oxidative stability and physicochemical properties[J]. Food Chemistry, 2014, 160(1): 90-97.
[12] 楼乔明,王玉明,徐杰,等. 栉孔扇贝和海湾扇贝脂质及其脂肪酸组成分析[J]. 中国食品学报,2012,12(11):198-203.Lou Qiaoming, Wang Yuming, Xu Jie, et al. Analysis of lipid profile and fatty acid compositions of Chlamys Farreri and Argopecten Irradians[J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(11): 198-203. (in Chinese with English abstract)
[13] 朱成科,朱龙,黄辉,等. 野生与养殖岩原鲤肌肉营养成分的比较分析[J]. 营养学报,2017,39(2):203-205.Zhu Chengke, Zhu Long, Huang Hui, et al. Comparison of nutrients composition in muscles of wild and bred Procypris rabaudi[J]. Acta Nutrimenta Sinica, 2017, 39(2): 203-205.(in Chinese with English abstract)
[14] 胡滨,陈一资,杨勇,等. 响应面法优化微波辅助提取松籽油的工艺研究[J]. 中国粮油学报,2016,31(1):52-59.Hu Bin, Chen Yizi, Yang Yong, et al. Optimization of microwave-assisted extraction pine seed oil using response surface methodology[J]. Journal of the Chinese Cereals and Oils Association, 2016, 31(1): 52-59. (in Chinese with English abstract)
[15] 孙协军,刘淼,李秀霞,等. 盐藻油微波辅助提取工艺优化及脂肪酸组成分析[J]. 中国粮油学报,2016,31(1):70-75.Sun Xiejun, Liu Miao, Li Xiuxia, et al. Optimization of microwave-assisted extraction technology of oil from Dunaliella Salina and its fatty acid component[J]. Journal of the Chinese Cereals and Oils Association, 2016, 31(1): 70-75. (in Chinese with English abstract)
[16] 胡滨,潘婉舒,刘换丽,等. 微波辅助提取榛子油及其脂肪酸组成分析[J]. 中国食品学报,2016,16(12):151-161.Hu Bin, Pan Wanshu, Liu Huanli, et al. Microwave-assisted extraction and fatty acid composition analysis of hazelnut oil[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(12): 151-161. (in Chinese with English abstract)
[17] 扶庆权. 响应面法优化微波辅助提取海蓬子籽油工艺[J].食品科学,2014,35(20):98-104.Fu Qingquan. Optimization of microwave-assisted extraction of seed oil from Salicornia bigenlovii Torr. using response surface methodology[J]. Food Science, 2014, 35(20): 98-104. (in Chinese with English abstract)
[18] 雷昌贵,孟宇竹,蔡花真,等. 西瓜籽油微波辅助提取工艺的优化[J]. 中国粮油学报,2013,28(2):43-47.Lei Changgui, Meng Yuzhu, Cai Huazhen, et al.Optimization of microwave-assisted extraction technique for watermelon seed oil[J]. Journal of the Chinese Cereals and Oils Association, 2013, 28(2): 43-47. (in Chinese with English abstract)
[19] Halim R, Danquah M K, Webley P A. Extraction of oil from microalgae for biodiesel production: A review[J].Biotechnology Advances, 2012, 30(3): 709-732.
[20] Ruiz-Aracama A, Goicoechea E, Guillén M D. Direct study of minor extra-virgin olive oil components without any sample modification.1H NMR multisupression experiment:A powerful tool[J]. Food Chemistry, 2017, 228: 301-314.
[21] Dora C P, Kushwah V, Katiyar S S, et al. Improved metabolic stability and therapeutic efficacy of a novel molecular gemcitabine phospholipid complex[J]. International Journal of Pharmaceutics, 2017, 530(1): 113-127.
[22] Nieva-Echevarría B, Goicoechea E, Manzanos M J, et al. The influence of frying technique, cooking oil and fish species on the changes occurring in fish lipids and oil during shallow-frying, studied by1H NMR[J]. Food Research International, 2016, 84: 150-159.
[23] 兰君,谭延振,宋晓金,等. 裂殖壶菌SD116油脂的胞内核磁共振研究[J]. 生物物理学报,2014,30(3):193-206.Lan Jun, Tan Yanzhen, Song Xiaojin, et al. Investigation on the lipid of Aurantiochytrium sp. SD116 by in-Cell NMR[J].Acta Biophysica Sinica, 2014, 30(3): 193-206. (in Chinese with English abstract)
[24] Guillén M D, Carton I, Goicoechea E, et al. Characterization of cod liver oil by spectroscopic techniques. New approaches for the determination of compositional parameters, acyl groups, and cholesterol from1H nuclear magnetic resonance and Fourier transform infrared spectral data[J]. Journal of Agricultural and Food Chemistry, 2008, 56(19): 9072-9079.
[25] Pollesello P, Eriksson O, Hockerstedt K. Analysis of total lipid extracts from human liver by13C and1H nuclear magnetic resonance spectroscopy[J]. Analytical Biochemistry,1996, 236(1): 41-48.
[26] Falch E, Størseth T R, Aursand M. Multi-component analysis of marine lipids in fish gonads with emphasis on phospholipids using high resolution NMR spectroscopy[J].Chemistry and Physics of Lipids, 2006, 144(1): 4-16.
[27] Falch E, Størseth T R, Aursand M. High resolution NMR for studying lipid hydrolysis and esterification in cod (Gadus morhua) gonads[J]. Chemistry and Physics of Lipids, 2007,147(1): 46-57.
[28] 楼乔明,张问,刘连亮,等. 狭鳕鱼皮脂肪酸组成分析及其营养评价[J]. 核农学报,2016,30(2):332-337.Lou Qiaoming, Zhang Wen, Liu Lianliang, et al. Analysis and nutritional evaluation of fatty acids in fishskin of Theragra chalcogramma[J]. Acta Agriculturae Nucleatae Sinica, 2016,30(2): 332-337. (in Chinese with English abstract)
[29] Archana A, Babu K R. Nutrient composition and antioxidant activity of gonads of sea urchin Stomopneustes variolaris[J].Food Chemistry, 2016, 197: 597-602.
[30] 刘小芳,薛长湖,王玉明,等. 乳山刺参体壁和内脏营养成分比较分析[J]. 水产学报,2011,35(4):587-593.Liu Xiaofang, Xue Changhu, Wang Yuming, et al.Comparative analysis of nutritive composition in body wall and internal organs of sea cucumber (Apostichopus japonicus)at Rushan[J]. Journal of Fisheries of China, 2011, 35(4):587-593. (in Chinese with English abstract)
[31] Innis S M. The role of dietary n-6 and n-3 fatty acids in the developing brain[J]. Developmental Neuroscience, 2000,22(5/6): 474-480.
