冻结-高压湿热解冻对多种淀粉中支链淀粉断裂的影响
2018-06-21王丹丽蒋荣霞刘梦婕连喜军
王丹丽,蒋荣霞,刘梦婕,连喜军※
(1. 天津商业大学理学院,天津 300134;2. 天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
0 引 言
冷冻是延长含小麦、甘薯、马铃薯和玉米淀粉等的食品货架期的有效方法[1-2]。高压湿热解冻法是食用冷冻食品前通常采用的处理方法。在冻融处理过程中通常有2种方法可以控制淀粉类食品的品质,一种是选择冻融处理的最佳条件,这样可以最大的程度减少凝胶淀粉中的质量损失并避免食品变质,比如脱水收缩、回生以及凝胶淀粉中的质地变化[3-6];另一种方法是培育含容易断裂侧链少的植物品种。许多植物中都含有淀粉,其中谷类淀粉(小麦和玉米)及根类淀粉(甘薯和马铃薯)应用最为广泛[7-9]。Zhao等[10]通过研究4种常用淀粉(包括小麦淀粉,玉米淀粉,马铃薯淀粉和木薯淀粉)冻融稳定性,发现小麦淀粉的稳定性最差,因为其凝胶淀粉在冻融过程失水最多。文献报道冷冻时间和贮存温度对含淀粉类食物的品质有很大的影响[11]。De-Kock等[12]报道含淀粉食品的硬度随着冷冻速度的增加而增大,而更低的冷冻温度和更长的冷冻时间会使食品粘性下降。与在较低的温度下融化相比,在更高温度下融化的淀粉凝胶具有更低的脱水收缩值[13]。冻融处理的淀粉表现出高的酶解敏感性[14]。高的酶解敏感性可能归因于淀粉的多孔性[15]、直链淀粉含量的变化或支链链长分布的变化[14-17]。然而,在高压下,冻融是否会导致凝胶淀粉链的断裂尚不清楚,而这一点可以通过测定淀粉糊中直链含量的变化反映出来。当凝胶淀粉被冷冻时,凝胶中形成的冰与水相比,体积会变大。形成冰的作用力可能会使淀粉颗粒破裂,从而使支链从颗粒中释放出来,这些支链在高压湿热解冻时会断裂成直链或多糖,因此凝胶淀粉中直链的含量会随着解冻时间而发生变化。到目前为止,鲜有文献开展此类研究,大多文献涉及冻融作用对淀粉的脱水收缩或回生的影响[18-19]。Tao等[14]将冻融处理后直链淀粉含量的下降归因于直链淀粉析出或冻结压力导致碘液对直链淀粉双螺旋的吸附力变弱。这种不确定的解释需要更详细试验的来证明。因此,本文的目标是研究加热温度、加热时间、冷冻时间和解冻时间对淀粉糊中直链淀粉含量的影响,找出使直链淀粉含量达到最大值的冷冻时间。这一时间将是特定淀粉在食品加工中最长的冷冻时间。另外,通过观察未冷冻和冻融后淀粉的微结构,更好的理解淀粉特性和冻融处理之间的关系。基于不同淀粉冻融过程链长分布的变化,推断了所研究淀粉链的最可能的断裂方式。本文为含小麦、甘薯、马铃薯和玉米淀粉食品冻结工艺的选择提供了相关理论基础。
1 材料和方法。
1.1 材料
小麦,甘薯,马铃薯和玉米淀粉(直链质量分数分别为19.3%,25.5%,22.4%和27.2%)由石家庄中心糖业有限公司提供。正丁醇和酒精购买至天津市富宇精细化工有限公司。普鲁兰酶(酶委员会编号:3.2.1.41;5 000 U/mL),麦芽糖,麦芽三糖,麦芽四糖,麦芽五糖,麦芽六糖,麦芽七糖购至美国Sigma-Aldrich有限公司。
1.2 试验仪器
高效体积排阻柱色谱系统(high performance size exclusion column chromatography system,HPSEC),该系统配有多角度激光光散射检测器(multi-angle laser light scattering detecotr,MALS),折光率检测器(refractive index detector,RI)。串联双柱(300 mm×7.5 mm,PL aquagel-OH MIXED,8 μm凝胶色谱柱,英国,什罗普郡Polymer有限公司)。DAWN DSP-F型激光光度计,采用He-Ne激光(λ=623.8 nm)为光源。K-5贯流分析池(美国怀雅特技术公司,美国圣塔芭芭拉)。RID-10A型差示折光仪(日本岛津公司)。0.4 μm薄膜滤器(Membrane Solutions有限责任公司)。高效阴离子交换色谱中HPAEC-PAD系统包含DIONEX (DX-600)离子色谱仪,ED 50电化学检测器(以Pt为工作电极),AS 40自动采样器(戴安公司,美国森尼韦尔)。OLYMPUS IX71型光学显微镜。扫描电镜(型号为JEOL型1850,日本东京)。
1.3 方法
1.3.1 凝胶淀粉的冻融处理
将浓度为10%的淀粉水悬浮液加热至95 ℃,持续搅拌以避免颗粒沉降。悬浮液在 95 ℃下分别保持 10、20和40 min,然后冷却至26 ℃。将样品在–18 ℃下分别冷冻 12,24和 48 h。随后将样品置于蒸汽压力罐中,在110 ℃下分别解冻 20、40、60 min。对照样品在95 ℃下不断搅拌40 min后冷却至26 ℃。然后将所有样品在干燥箱中(干燥箱内空气温度为55~60 ℃)干燥至恒质量。
1.3.2 直链淀粉含量的测定
试验采用正丁醇沉淀法分离和测定直链淀粉[20–22]。将5 g样品溶解至100 mL 浓度0.05% NaCl溶液中释放出凝胶化淀粉中的直链淀粉。将该溶液在室温下持续搅拌2 h然后离心分离(3 040×g,5 min)。通过加入3倍体积的 1-丁醇,使上清液中的直链淀粉沉淀,然后通过离心分离(3 040×g,5 min)。将以上过程重复直至不再有沉淀析出。将所有沉淀收集并在55~60 ℃下的干燥箱中干燥至恒质量。直链淀粉含量计算公式如式(1)。
直链淀粉含量 =(沉淀质量/淀粉质量)×100% (1)
1.3.3 分子量分布曲线
分子量分布曲线的确定按文献[23]所述。将样品(100 g)加入80 mL的去离子水中,然后在沸水中加热并搅拌20 min使样品完全溶解。通过5 μm的醋酸纤维素滤膜过滤后,将溶解后的样品放入高效体积排阻柱色谱系统中。流动相速度为 0.5 mL/min。流动相为含 0.02%NaN3的0.1 mol/L NaNO3溶液,该溶液通过0.4 μm薄膜滤器过滤。分子量计算时,比折光指数增量(dn/dc)值为0.150,数据处理采用ASTRA软件(4.73.04版)。
1.3.4 链长分布曲线
样品的链长分布利用配有脉冲电流检测器的高效阴离子交换色谱测定(HPAEC-PAD)[23-24]。将样品(100 mg)溶解在 30 mL 4.0 mol/L KOH中以阻止淀粉结团,用6.0 mol/L HCl将溶液的 pH调整至 6.0。将普鲁兰酶(0.5 U)分别加至每份溶液中,保持45 ℃下不断搅拌并水解24 h。然后,将溶液在沸水浴中加热10 min使酶失活。脱支的样品溶液以 21 500×g加速度下离心后通过0.45 μm 的薄膜过滤器过滤,然后注入 HPAEC-PAD 系统。标准三电位波形采用以下周期和脉冲电位:T1=0.40 s,采样时间为 0.20 s,E1=0.05 V;T2=0.20 s,E2=0.75 V;T3=0.40 s,E3=-0.15 V。数据通过戴安液相层析仪软件收集。洗提液用蒸馏去离子水制备并用氦气喷雾。洗脱液A包含200 mmol/L NaOH,洗脱液B在200 mmol/L NaOH中加入了50 mmol/L乙酸钠。
1.3.5 原糊化淀粉和冻融淀粉的光学显微照片
用接种针取少量糊化淀粉放于基片上并分散均匀。将基片在室温下干燥后得到样品的光学显微照片,所有照片均被放大200倍。
1.3.6 样品形貌分析
用无水乙醇将淀粉制备成悬浮液,取一滴悬浮液放在银胶带上(粘贴面朝下),将银胶带粘到一块铜盘上并在表面喷金处理Au/Pd(60/40)。用扫描电镜观察样品。
1.3.7 数据统计
试验分别选取了 4个因素:包括糊化温度(60, 80,100 ℃),糊化时间(10, 20 40 min),冷冻时间(24, 48,72 h)及融化时间(20, 40, 60 min),每个因素分别取了3个变量。每个数据均取自 3个重复试验的均值。利用方差分析和最小显著差(least significant difference,LSD)分析数据的差异显著性(Excel)。
2 结果和讨论
2.1 冻融前后直链含量变化
为了减少冻融处理对淀粉脱水收缩的影响[3],人们采用过多种方法[25-26]。虽然这些方法起到一定作用,但此类方法增加了产品的成本因而限制了其在工业化生产中的应用。因此冻融处理时采用适当的参数就尤为重要。直链淀粉分子重新排列组合是冻融淀粉老化的主要原因[27],所以测定冻融处理过程中凝胶化淀粉中直链淀粉含量的变化是是控制老化的一个重要参数。
表1、表2、表3和表4给出了加热温度、冷冻时间和融化时间等因素对小麦、甘薯、马铃薯和玉米直链淀粉的影响。可以确定,在高压湿热条件下,随着融化时间的延长,直链淀粉含量变化的趋势是不确定的。
直链淀粉第一次增加是由于冻结-解冻过程更多淀粉球破裂导致更多直链淀粉从淀粉球中析出导致;第二次直链淀粉增加是由支链淀粉断裂产生的,因为冻融解冻后直链淀粉的含量远远高于原淀粉中直链淀粉含量,经我们测定,直链淀粉增加的样品支链淀粉含量明显减少了。通过对平均值计算分析,找到了直链淀粉含量最大值和最小值。
由表1看出,对小麦淀粉,直链淀粉含量的最大值和最小值分别约61.2%和6.0%,相应的加热温度、加热时间、冷冻时间和解冻时间分别为60 ℃,20 min,48 h,60 min以及100 ℃,40 min,48 h,60 min。对于甘薯淀粉,最大值和最小值分别约69.8%和0.2%,相应的参数分别为100 ℃,10 min,48 h,60 min 以及 80 ℃,20 min,24 h,20 min。对于马铃薯淀粉,最大值和最小值分别约89.0%和0.7%,相应的参数分别为80 ℃,40 min,48 h,20 min以及80 ℃,40 min,24 h,40 min。对于玉米淀粉,最大值和最小值分别约 53.7%和 1.53%,相应的参数分别为100 ℃,40 min,72 h,60 min 以及 60 ℃,10 min,24 h,20 min。可以看出,支链淀粉断裂为直链淀粉的困难程度依次为:玉米>小麦>甘薯>马铃薯,因此玉米淀粉是最适合作为冷冻的食物。因为直链淀粉更易回生[28],含有此类淀粉的冷冻食物在加工中应避开这些可以使直链淀粉含量达到最大值的参数。Wang等[29]认为在冻融处理过程中凝胶的弹性变化可以归结为淀粉分子聚集的增加及水的塑化作用的减小。本文的结果表明前者可能是主要因素,因为直链淀粉含量的变化较大而且它比支链淀粉聚合的快。

表1 小麦淀粉在不同条件下冻融处理时直链淀粉含量的变化Table 1 Variations of amylose contents in wheat under different freezing-thawing treatments

表2 甘薯淀粉在不同条件下冻融处理时直链淀粉含量的变化Table 2 Variations of amylose contents in sweet potato under different freezing-thawing treatments

表3 马铃薯淀粉在不同条件下冻融处理时直链淀粉含量的变化Table 3 Variations of amylose contents in potato under different freezing-thawing treatments

表4 玉米淀粉在不同条件下冻融处理时直链淀粉含量的变化Table 4 Variations of amylose contents in maize under different freezing-thawing treatments
2.2 分子量分布图
图1为4种淀粉的分子量分布图。

图1 冻融前后4种淀粉的分子量分布图Fig.1 Molecular weight distribution curve before and after freeze-thaw treatments
从图1可以看出,小麦,甘薯,马铃薯和玉米4种淀粉在冻融处理前后的摩尔分子量分布分别为:6.9×105~77.9(前)2.7×104~77.9(后),7.4×105~77.9(前)7.4×105~77.9(后),6.9×105~77.9(前)8.5×103~77.9(后)和 6.9×105~77.9(前)3.7×103~77.9(后)。这一结果与 Hizukuri等[30]报道一致,但甘薯的分子量大大低于我们之前的报道[31],这可能由于淀粉来源于不同植物。可以看出,没有经过冻融处理的淀粉有含有较多的大分子量链,而冻融后的淀粉有较多小分子量链。分子量分布曲线根据不同的分子质量分成不同的区域,归一化面积与分子量 M的对数值 lnM之间的关系如图 2所示。
图2可以清晰表示出4种淀粉不同范围分子量在冻融前后的变化趋势。在冻融处理后,4种淀粉中低分子量部分均显著的增加。小麦淀粉里低分子量链的含量超过70%,对于甘薯淀粉,冻融后该部分含量从34%增加到了53%,而马铃薯和玉米淀粉中该部分的含量在冻融处理后达到100%。这表明部分支链断裂且链长变短导致淀粉分子量的减小。
2.3 链长分布
通过HPAEC测定淀粉在冻融前后的链长分布,结果如图3所示。

图2 归一化面积与分子量M的对数值lnM关系图Fig.2 Normalized area (%) to molecular weight log value lnM
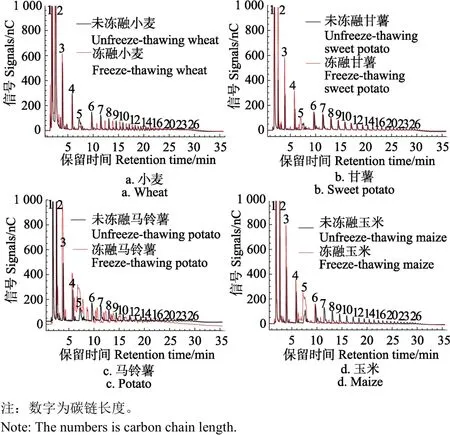
图3 4种淀粉冻融前后链长分布比较Fig.3 Chromatograms comparison of four kinds of starches before and after freeze-thawing treatments
所测结果与文献[32]所述不同,该文献只描述了支链的链长分布。本文样品中不仅包含原有的直链,还包括用支链淀粉酶脱支得到的直链(如图4)。
由图 4可见,冻融处理后聚合度(葡萄糖的数目)变化明显。高聚合度的多糖的含量降低而低聚合度的多糖明显升高。
由图4可以看出,在小麦淀粉中,5糖,6糖和7糖质量分数下降较多,分别下降了76.5%、71.3%和70.7%,而2糖的质量分数上升最多,上升了35.8%;在甘薯淀粉中,质量分数明显减少的是10、11、13糖,分别减少了43.8%、46.7%和44.4%,而2糖、3糖和4糖质量分数增多,分别增加了389.4%、122.3%和109.4%。在马铃薯淀粉中,5糖和6糖下降较多,质量分数分别下降了58.4%和54.9%,同时2糖、3糖和4糖明显增多,分别增加了72.9%、180.8%和57.9%。在玉米淀粉中,7糖、8糖和9糖下降较多,其质量分数分别下降了 85.0%、80.3%和79.4%,而3、4、5糖的质量分数增加较多,分别增加了101.5%、32.4%和212.8%。

图4 冻融前后4种淀粉葡萄糖残基数目分布比较Fig.4 Comparison of percentage of dextrose number distribution in four kinds of starch chains before and after freeze-thawing treatments
通过对 4种淀粉在冻融处理过程中葡萄糖数目的增减,推论出4种淀粉中支链淀粉链长的断裂模式,如图5所示。
对于小麦支链淀粉,冻融解冻过程支链淀粉中侧链长度为5、6、7个葡萄糖残基的侧链对应3种可能的断裂方式:2+2+1、2+2+2及2+2+2+1;对于甘薯支链淀粉,支链淀粉中侧链长度为10、11和13个葡萄糖残基的侧链对应 3种可能的断裂方式:3+3+4、2+2+3+4及2+2+2+3+4;对于马铃薯支链淀粉,支链淀粉中侧链长度为5和6个葡萄糖残基的侧链对应3种可能的断裂方式:2+3、2+4、3+3;而玉米支链淀粉中,支链淀粉中侧链长度为7、8、9个葡萄糖残基的侧链对应3种可能的断裂方式:2+5,3+5,和3+3+3(其中1表示1个葡萄糖;2表示含2个葡萄糖的麦芽糖、3表示含3个葡萄糖的麦芽多糖、4表示含4个葡萄糖的麦芽多糖和5表示含5个葡萄糖的麦芽多糖)。换句话说,培育合成特定链长侧链少的植物品种(小麦为侧链长度为 5、6、7葡萄糖;甘薯为侧链长度为10、11、13葡萄糖;马铃薯为侧链长度为5、6葡萄糖;玉米为侧链长度为7、8、9葡萄糖)就有可能解决文献[33]中出现的淀粉冻融后性质发生明显变化的问题,因为这些淀粉中经冻融处理容易发生断裂的侧链比较少。

图5 依据链长分布得到的4种支链淀粉可能断裂方式Fig.5 Possible breakage way of four amylopectins based on Chain length distribution researches
2.4 形态特性
通过显微照片(图6)和扫描电子显微镜(图7)可以看出,原淀粉颗粒、未冻融颗粒(即凝胶淀粉)及冻融后淀粉在形态上发生了显著的变化。对于未冻融处理的淀粉(图 6a1-d1)凝胶化后淀粉显微图中存在很多溶胀但未破裂的颗粒,但是冻融处理后凝胶化淀粉(图 6 a2-d2)中未胀破颗粒极少,仅在小麦和马铃薯淀粉有少量存在,说明这2种淀粉球更抗冻融处理。产生这一现象的原因可能是由于这2类淀粉的颗粒分布范围较宽[34-35],一些小颗粒膨胀但是很难破裂。有文献报道,荸荠淀粉的颗粒结构只要经过7次冻融处理后,几乎全部破裂[29]。这一原因有待进一步研究,以便培育出具有抗冻融特性的新植物品种。

图6 光学显微照片Fig.6 Optical micrographs
图7 为4种原淀粉、未冻融凝胶化淀粉和冻融后的凝胶化淀粉的SEM照片,其中,原淀粉(a1-d1; a2-d2);未冻融凝胶淀粉(a3-d3),冻融后凝胶淀粉(a4-d4)。由图7 a1-d1, a2-d2可见,原淀粉颗粒表面光滑,呈圆形或椭圆形,与文献[36]一致。然而,由图7 b2-1和图7d2-1可以很明显的看出,在放大倍数超过4 000倍后,甘薯和玉米淀粉颗粒表面变得粗糙,而这些粗糙的表面可能非常利于吸收水分从而使颗粒膨胀。在图7a2-1,小麦淀粉颗粒嵌入了胚乳组织且更多的非颗粒物质出现。与凝胶淀粉(图 7a3-d3)相比,冻融后淀粉(图 7a4-d4)最显著的区别是出现了分层的结构,而这与文献[6]报道一致。

图7 SEM照片Fig.7 Scanning electron micrograph
3 结 论
冻融处理后更多淀粉球破裂导致更多直链淀粉从淀粉球中析出导致第一次直链淀粉含量增加;支链淀粉断裂成直链淀粉导致第二次直链淀粉含量增加。通过试验找到了 4种淀粉冻融过程直链淀粉含量达到最大值时冷冻时间,即对小麦、甘薯和马铃薯淀粉为冷冻处理48 h,对玉米淀粉为 72 h。含有小麦、甘薯、马铃薯和玉米淀粉的淀粉类食物,其冷冻贮藏时间不应超过72 h。4种淀粉的易断裂侧链不同,表明具有相同葡萄糖基的链在不同淀粉颗粒中的空间结构和排列方式不同。冷冻时,有些空间排列的链容易断裂,通过深入研究和控制这些侧链的空间排列,有望大大提高淀粉质食品的冻融稳定性品质。
[1] Mylona Z, Kolokotroni M, Tassou S A. Frozen food retail:Measuring and modelling energy use and space environmental systems in an operational supermarket[J]. Energ Buildings,2017, 144: 129-143.
[2] Cheng L, Sun D W, Zhu Z, et al. Emerging techniques for assisting and accelerating food freezing processes: A review of recent research progresses[J]. Crit Rev Food Sci, 2017,57(4): 769-781.
[3] Zhang G H, Sosulski F W. Determination of water separation from cooked starch and flour pastes after refrigeration and freeze-thaw[J]. J Food Sci, 1998, 63(1): 134-139.
[4] Ye J, Hu X, Zhang F, et al. Freeze-thaw stability of rice starch modified by improved extrusion cooking technology[J].Carbohyd Polym, 2016, 151: 113-118.
[5] Chen H, Fu X, Luo Z. Effect of gum arabic on freeze-thaw stability, pasting and rheological properties of tapioca starch and its derivatives[J]. Food Hydrocolloid, 2015, 51: 355-360.
[6] Yamazaki E, Sago T, Kasubuchi Y, et al. Improvement on the freeze–thaw stability of maize starch gel by the polysaccharide from leaves of Corchorus olitorius L.[J].Carbohyd Polym, 2013, 94(1): 555-560.
[7] Klaochanpong N, Puttanlek C, Rungsardthong V, et al.Physicochemical and structural properties of debranched waxy rice, waxy maize and waxy potato starches[J]. Food Hydrocolloid, 2015, 45: 218-226.
[8] Singh J, Singh N. Studies on the morphological, thermal and rheological properties of starch separated from some Indian potato cultivars[J]. Food Chem, 2001, 75(1): 67-77.
[9] Wu K, Dai S, Gan R, et al. Thermal and rheological properties of mung bean starch blends with potato, sweet potato, rice, and sorghum starches[J]. Food Bioprocess Tech,2016, 9(8): 1408-1421.
[10] Zhao Q, Yue X, Mao D, et al. Comparative study of physical properties of four kinds of commonly used starches[J]. Food Mach, 2005, 21: 22-24.
[11] Yu S, Ma Y, Sun D. Effects of freezing rates on starch retrogradation and textural properties of cooked rice during storage[J]. LWT–Food Sci Technol, 2010, 43(7): 1138-1143.[12] De-Kock S, Minnaar A, Berry D, et al. The effect of freezing rate on the quality of cellular and non-cellular par-cooked starchy convenience foods[J]. LWT–Food Sci Technol, 1995,28(1): 87-95.
[13] Varavinit S, Anuntavuttikul S, Shobsngob S. Influence of freezing and thawing techniques on stability of sago and tapioca starch pastes[J]. Starch/Stäke, 2000, 52(6/7): 214-217.
[14] Tao H, Wang P, Ali B, et al. Structural and functional properties of wheat starch affected by multiple freezing/thawing cycles[J]. Starch/Stäke, 2015, 67(7/8): 683-691.
[15] Karathanos V T, Saravacos G D. Porosity and pore size distribution of starch materials[J]. J Food Eng, 1993, 18(3):259-280.
[16] Jane J L, Wong K, McPherson A E. Branch-structure difference in starches of A- and B-type X-ray patterns revealed by their Naegeli dextrins[J]. Carbohyd Res, 1997,300(3): 219-227.
[17] Wang L, Xie B, Xiong G, et al. The effect of freeze–thaw cycles on microstructure and physicochemical properties of four starch gels[J]. Food Hydrocolloid, 2013, 31(1): 61-67.
[18] Charoenrein S, Preechathammawong N. Undercooling associated with slow freezing and its influence on the microstructure and properties of rice starch gels[J]. J Food Eng, 2010, 100(2): 310-314.
[19] White P, Abbas I, Johnson L. Freeze-thaw stability and refrigerated-storage retrogradation of starches[J]. Starch/Stäke,1989, 41(5): 176-180.
[20] Morrison W R, Laignelet B. An improved colorimetric procedure for determining apparent and total amylose in cereal and other starches[J]. J Cereal Sci, 1983, 1(1): 9-20.
[21] Kalichevsky M T, Ring S G. Incompatibility of amylose and amylopectin in aqueous solution[J]. Carbohyd Res, 1987,162(2): 323-328.
[22] Lehmann U, Rössler C, Schmiedl D, et al. Production and physicochemical characterization of resistant starch type III derived from pea starch[J]. Food/Nahrung. 2003, 47(1): 60-63.
[23] Philpot K, Martin M, Butardo V, et al. Environmental factors that affect the ability of amylose to contribute to retrogradation in gels made from rice flour[J]. J Agr. Food Chem., 2006, 54(14): 5182-5190.
[24] Miao M, Xiong S, Ye F, et al. Development of maize starch with a slow digestion property using maltogenic α-amylase[J].Carbohyd Polym, 2014, 103: 164-169.
[25] Lee M H, Baek M H, Cha D S, et al. Freeze–thaw stabilization of sweet potato starch gel by polysaccharide gums[J]. Food Hydrocolloid, 2002, 16(4): 345-352.
[26] Arocas A, Sanz T, Fiszman S M. Improving effect of xanthan and locust bean gums on the freeze-thaw stability of white sauces made with different native starches[J]. Food Hydrocolloid., 2009, 23(8): 2478-2484.
[27] Arunyanart T, Charoenrein S. Effect of sucrose on the freeze–thaw stability of rice starch gels: Correlation with microstructure and freezable water[J]. Carbohyd Polym, 2008,74(3): 514-518.
[28] Miles M J, Morris V J, Orford P D, et al. The roles of amylose and amylopectin in the gelation and retrogradation of starch[J]. Carbohyd Res, 1985, 135(2): 271-281.
[29] Wang L, Yin Z, Wu J, et al. A study on freeze–thaw characteristics and microstructure of Chinese water chestnut starch gels[J]. J Food Eng, 2008, 88(2): 186-192.
[30] Hizukuri S, Takagi T. Estimation of the distribution of molecular weight for amylose by the low-angle laser-lightscattering technique combined with high-performance gel chromatography[J]. Carbohyd Res, 1984, 134(1): 1-10.
[31] Lian X, Dong S, Gao K, et al. Sweet potato amylose and amylopectin with narrower distribution of molar mass and chain length obtained by a repeated retrogradation–hydrolysis procedure[J]. J Appl Polym, 2016, 133(34): 8311-8319.
[32] Silverio J, Fredriksson H, Andersson R, et al. The effect of temperature cycling on the amylopectin retrogradation of starches with different amylopectin unit-chain length distribution[J]. Carbohyd Polym, 2000, 42(2): 175-184.
[33] Jobling S A, Westcott R J, Tayal A, et al. Production of a freeze-thaw-stable potato starch by antisense inhibition of three starch synthase genes[J]. Nat Biotech, 2002, 20: 295-299.
[34] Wilson J D, Bechtel D B, Todd T C, et al. Measurement of wheat starch granule size distribution using image analysis and laser diffraction technology[J]. Cereal chem, 2006, 83(3):259-268.
[35] Noda T, Takigawa S, Matsuura-Endo C, et al.Physicochemical properties and amylopectin structures of large, small, and extremely small potato starch granules[J].Carbohyd Polym, 2005, 60(2): 245-251.
[36] Jane J L, Kasemsuwan T, Leas S, et al. Anthology of Starch Granule Morphology by Scanning Electron Microscopy[J].Starch/Stäke, 1994, 46(4): 121-129.
