直读显色快速检测绿茶中的茶氨酸
2018-06-21朱城波吴小妹冯丽霞黄象鹏庞林江杨虎清方正伟王颖赖姝毓张宜明
朱城波,吴小妹,冯丽霞,黄象鹏,庞林江,杨虎清,方正伟,王颖,赖姝毓,张宜明,2*
1. 浙江农林大学农业与食品科学学院,浙江 杭州 311300;2. 宜宾学院博士后创新实践基地,四川 宜宾 644000
游离氨基酸通过多种途径参与茶叶色、香、味的形成,进而影响品质[1-3],茶氨酸是茶叶鲜味与鲜香的主要呈味物质[4-6],属非蛋白质态可溶性氨基酸,占茶叶干重 1%~2%[7-10]。茶氨酸最早被日本学者 Sakato从日本绿茶中发现,具有焦糖香和鲜爽味,能缓解茶叶的苦涩味[11]。有研究显示茶氨酸与绿茶滋味的相关系数高达 0.787~0.876[12]。目前检测茶氨酸的方法主要依赖高效液相色谱法(HPLC)和毛细管电泳测定法[13-14],需要繁琐的前处理与衍生过程(柱前或柱后),且设备购置与维护成本高昂。随着茶氨酸在膳食补充剂、保健食品等领域被广泛开发应用,得到一种能够快速直读检测茶氨酸的方法显得十分必要。
近年来,农产品品质与安全的快速检测与分析成为研究人员关注的焦点,常见的主要手段有快速显色、金标试纸条、农残检测酶抑制纸片法以及层析法等[15-18]。利用纸层析或者薄层层析可以实现对茶叶中氨基酸的快速、半定量分析[15,19]。尽管与纸层析原理类似,但一般认为薄层层析拥有更好的分离效能。为得到相应的显色信号,传统薄层色谱显色是以显色剂在薄层板上喷雾而成,但这种手工操作的显色方式有着显而易见缺点包括无法实现快速自显色、重现性差、定量不准确等问题。进一步,研究人员将一定量的显色剂如茚三酮溶解于展开剂中,其显色效果较喷雾法有所改善[15,20-21]。尽管如此,由于氨基酸性质各异,可能导致显色混杂并影响比移值Rf值的测定。更为重要的是,无论喷雾还是将显色剂混合在展开剂中都将导致薄层层析条带非显色区的本底颜色加深,减弱了显色的信噪比,不利于裸眼直读以及仪器判读。
本研究首先利用溶胶-凝胶反应制备了自显色活性的纳米显色剂,通过多种表征手段证实茚三酮可以稳定固定在纳米二氧化钛材料中。将该纳米材料分散液作为一种纳米显色剂打印在高效薄层条带上从而构筑成直读显色条带。用沸水浸提绿茶茶样,经薄层层析及其表面固定的纳米显色剂显色可直接用于茶汤中茶氨酸的定性及半定量判别,同时利用高效液相方法验证本研究的快速直读检测策略。
1 材料与方法
1.1 材料与试剂
天目云雾茶(2016年春),产于杭州临安市太湖源东坑村顶谷云雾茶业有限公司。甲醇(优级纯,天津市四有精细化学品有限公司);L-茶氨酸(纯度大于99%,上海源叶生物科技有限公司);异丙醇(分析纯,天津市永大化学试剂有限公司);冰乙酸(分析纯,上海凌峰化学试剂有限公司);茚三酮(纯度大于99%,国药集团化学试剂有限公司);乙酸乙酯;无水乙醇(分析纯,安徽安特食品股份有限公司);甲苯(分析纯,杭州双林化工试剂厂);钛酸四丁酯(纯度大于99%,北京百灵威科技有限公司);实验室用普通定量滤纸。
以甲苯和乙醇按照体积比 1︰1配制混合溶剂,以此配制0.1 mol·L-1的钛酸四丁酯前驱体溶液。2.5%茚三酮水解溶液:用分析天平称取2.5 g茚三酮粉末,将其溶于50 mL无水乙醇溶液中,待彻底溶解后加入50 mL蒸馏水,均匀混合。
配制样品稀释液为异丙醇和水混合液(V︰V=1︰1)。茶氨酸标准贮备液:取50 mg茶氨酸粉末标准品用稀释液溶解定容至 100 mL,此溶液中每1 mL中含有0.5 mg茶氨酸,依次配制浓度为 0.5、0.25、0.125、0.06、0.03 mg·mL-1的茶氨酸溶液。喷雾显色剂:喷雾显色剂(2%茚三酮):取2 g茚三酮粉末溶于50 mL乙醇加水定容至 100 mL,用喷壶装好置于暗处保存。薄层展开剂为 V75%乙醇︰V冰乙酸=10︰1。
1.2 仪器与设备
点样毛细管;SP-Ⅱ电动点样机(上海科哲仪器设备公司);展开缸(10 cm×20 cm);硅胶G60薄层层析板(德国默克);真空抽滤装置;分析天平;均质器(IKA,美国);恒温水浴锅。日立L-8900全自动氨基酸分析仪及相关色谱柱。
1.3 纳米显色剂制备与表征
滤膜材质为普通定量滤纸,将滤膜剪成圆形尺寸与抽滤装置上的砂芯漏斗相适应。利用抽滤装置将前驱体溶液流入滤膜,使滤膜表面充分吸附前驱体,以无水乙醇充分洗涤后加入2.5%的茚三酮溶液,水解反应3 min后再次乙醇冲洗并将滤纸抽滤干燥。该溶胶-凝胶的方法首先在滤纸表面吸附钛酸四丁酯,后续水解形成纳米二氧化钛过程中,茚三酮分子被交联固定和吸附包裹的方式进入滤纸纤维素表面的纳米结构中,完成了相应的沉积/水解一个循环。通过重复以上吸附、洗涤、水解、再洗涤与干燥过程最终形成茚三酮/纳米二氧化钛复合物。将合成包覆有茚三酮/纳米二氧化钛复合物的滤膜经乙醇浸泡,以均质器均质可以得到分散均匀的淡乳白色的茚三酮/纳米二氧化钛复合物,具体合成路线见图1及前期专利(发明专利ZL 201510817477.3)[22]。
精确移取制备好的纳米显色剂乙醇分散液(10 mg·mL-1)10 µL 于透射电镜铜网上,待室温自然挥发至干燥,以透射电镜观察滤纸纤维表面形成的纳米显色剂形貌。再另取1 mL左右该分散液,室温挥发至干燥得10 mg纳米显色剂,经溴化钾压片等过程供红外光谱表征。
1.4 茶汤制备与提取
茶叶磨碎过 1 mm筛网,准确称取(3.00±0.01)g磨碎茶样于 500 mL锥形瓶中,加入沸水450 mL,在沸水浴中浸提45 min(每隔10 min摇瓶1次),趁热过滤,冷却后定容至500 mL得供试液[15]。研究表明热浸提同冷浸提相比浸提更为完全,氨基酸总量相差 3倍左右[23]。
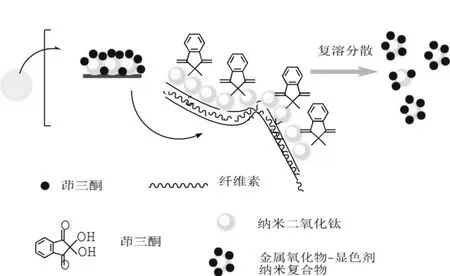
图1 茚三酮/纳米二氧化钛的合成路线Fig. 1 The construction scheme of ninhydrin/nano-titanium dioxide nanomaterials
脱色:乙酸乙酯脱色。将浸提茶汤和乙酸乙酯按照 2︰1的比例进行混合均匀,振荡脱色。充分振荡5 min,静置1 h,弃上层酯层,下清水溶液冷藏保存。同原茶汤对比色泽明显偏淡,且脱色后茶汤利于长期保存。
1.5 直读显色条带制备
1.5.1 薄层板的预处理
薄层板除杂、活化:将铝基板裁成4 cm×7 cm,铝基板长边距上下沿1 cm处分别左右标记,取95%甲醇5 mL于展开缸中做展开剂,薄层板展开结束,60℃烘干,裁去上沿 1 cm含有杂质部分,得到标准的4 cm×6 cm铝基板于干燥器中密封保存。
1.5.2 纳米显色直读薄层板
进样针吸取 15 μL纳米显色剂分散液(10 mg·mL-1)打印在茶氨酸对应Rf值水平线上,打印宽度为2 mm,60℃干燥后放入干燥器备用。
1.6 点样、展开与显色
点样:在薄层板距下沿 1.0 cm水平处均匀标记点样起始点,铝基薄层板置于点样机60℃加热盘上准确将 2 μL样品全量点样。用毛细点样管沾取样品轻点在薄层板标记点上,点状点样,控制点样大小直径不超过2 mm,干燥后备用。
薄层层析:取4 mL展开剂于展开缸中,用镊子将薄层板点样端浸入展开缸中,要求展开剂液面低于点样线,展开起始点保持恒定,层析时间设置为30 min,室温设定25℃。
喷雾显色和自显色:层析结束取出,在电动点样机上烘干,用镊子夹取薄层板,喷壶均匀喷洒显色剂两次,于105℃点样机上干燥显色1 min。与此对应,直读显色条带不喷洒显色剂,仅将展开后的条带直接放置于加热板上待其自显色完成(加热平板105℃,15 s内完成显色)。
1.7 茶样HPLC检测分析
日立L-8900高速全自动氨基酸分析仪及试剂包(分离试剂包 B1~B6,衍生化试剂包R1~R3),分析条件:柱温:57℃,柱后衍生化反应温度:135℃;分离柱:4.6 mm×60 mm[#2622PH] , 除 氨 柱 : 4.6 mm×40 mm[#2650L],反应柱:4.6 mm×40 mm,分离温度:57℃,衍生温度:135℃,分离梯度以及其他仪器条件见文献[24]。
2 结果与分析
2.1 茚三酮/纳米二氧化钛的表征
通过透射电镜,可以清晰的观察到纤维表面构筑成的纳米颗粒显色剂,经过三层组装之后,其粒径分布在20~50 nm之间,见图2-a,证明在纤维素表面形成了纳米二氧化钛颗粒。将制备好的纳米显色颗粒通过冲洗研磨等手段可以获得高度分散的茚三酮/纳米二氧化钛分散液(图2-b),该分散液可以保持近三周稳定的悬浮状态。
为进一步证实茚三酮被成功构筑在纳米二氧化钛结构中,我们将制备好的纳米颗粒干燥后进行红外光谱测试,可以佐证茚三酮是否组装在纳米二氧化钛上形成纳米显色剂复合物,有关详细信息见附件。

图2 茚三酮/纳米二氧化钛微观结构透射电镜图及水溶液中高度分散状态Fig. 2 Microstructure of ninhydrin/nano-titanium dioxide observed by transmission electron microscopy and highly dispersed state in aqueous solution
将上述制备好的纳米显色剂分散液(10 mg·mL-1)打印在层析板上后,由于纳米二氧化钛的多层包裹和键合交联作用,纳米显色剂被有效固定且均匀分布在在层析板固定相表面,在层析过程中不会发生色带和斑点的扩散。此外,由于纳米材料的极高比表面积,其显色的灵敏度获得提高的同时,显色所用的时间也大大减少。本研究中用于复合茚三酮使用的纳米二氧化钛,其性质稳定而且无色,不影响氨基酸的显色且打印后的层析条带与原始状态无差异,有助于后面的分析显色过程。
2.2 展开剂优化与茶氨酸定性分析
因氨基酸溶液为水相,由于毛细管吸附力的存在,点样时样液易上移。因此,在点样和在贮备液配制过程中,均以异丙醇水(V︰V=1︰1)为稀释液溶解茶氨酸,改变了溶液极性,解决了氨基酸点样吸附困难的问题。
通过收集国内外相关研究与试验发现传统的氨基酸展开剂V正丁醇︰V乙醇︰V水=4︰1︰1层析效果不佳,且耗时长,正丁醇在薄层板上迁移缓慢。通过反复对比有关展开剂并参考有关研究采用 75%的乙醇溶液作为展开剂[21],进一步优化后发现V75%乙醇︰V冰乙酸=10︰1作为展开剂效果较好,各氨基酸无明显拖尾(图3)。由于各种氨基酸理化性质不同,其在吸附剂表面的吸附/解吸附能力各异,经展开后各氨基酸形成不同的比移值Rf值如表 1所示。其中,本研究的目标化合物茶氨酸的比移值为0.702,与其他 3种氨基酸差异明显。因此下一步直读显色层析板的纳米显色剂打印位置选择在该比移值处。
2.3 茶汤色素干扰鉴别及脱色
在前述氨基酸展开剂优化基础上,采用制备的直读显色条带对氨基酸标准和茶叶提取液进行初步分析,分析结果如图4所示。
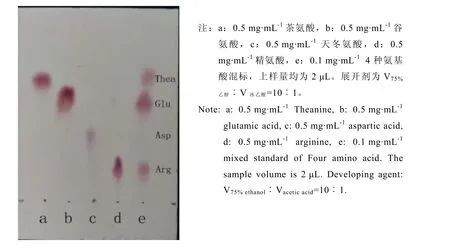
图3 4种氨基酸单标及混标的薄层展开效果(喷雾显色法)Fig. 3 The TLC (spray colorization) picture of the single standards or mixed standard of four amino acids

表1 4种氨基酸的Rf值Table 1 The shift value (Rf) of four kinds of amino acids
构筑的直读显色条带可以对 4种目标氨基酸进行直读显色,标准品显色效果良好,背景清晰。观察注意到4种氨基酸单标(a~d通道)迁移与4种氨基酸混标(e通道)迁移位置完全一致。由于本研究着重分析茶氨酸,因此为避免氨基酸显色之间相互影响,确定了下一步实验方案为每个通道只针对一种氨基酸打印一个显色区。图4中右图中4个通道分别对应4种氨基酸,显色结果表明茶叶提取物样品直读显色与标准品之间有较大差异,颜色偏黄。推测原因在于样品提取液中含有较多的共存酚类化合物,这些酚类化合物可与氨基酸显色过程中产生的醛类化合物形成酚醛类物质呈现淡黄色,影响了显色效果。为此,有必要对茶汤进行预处理。一般认为,乙酸乙酯是茶叶中茶多酚、咖啡因的良好提取溶剂,本次实验中乙酸乙酯萃取后的茶汤显色与标准品较一致,表明该方法适于该直读显色测定的样品预处理(图5)。
图 5证明该纳米显色材料在茶氨酸定性试验测定中效果较好,显色条带集中、干扰颜色信号少,而且显色耗时短、灵敏度高。
2.4 茶氨酸半定量分析、最低显色浓度、显色范围
图6中f、g两通道为脱色茶汤及脱色茶汤加标,将其颜色深浅同图左茶氨酸标准浓度梯度进行比对,可明显观察到f通道颜色深浅在 c和 d通道之间,说明茶汤中的茶氨酸含量介于0.125~0.06 mg·mL-1之间,如取中间值则约0.1 mg·mL-1左右。加标浓度可以进一步验证该估计值的准确(见g通道),加标0.10 mg·mL-1后颜色与b通道相接近,表明加入的标准氨基酸被试纸条带准确的识别出来。h和i通道是脱色后茶汤稀释液直读检测及加标后显色结果,进一步验证了本方法的有效性。这种确定的定量关系还可以通过图像软件佐证。将图片导入电脑系统自带的普通图像软件,对工作曲线原始图片中各显色点取RGB值,利用软件采集获得每个工作曲线点的 R值、G值和 B值,各代表红、绿和蓝色色度值。经过多次拟合发现氨基酸浓度的对数值和 R值之间有着最好的线性关系,其相关系数可以达到0.9924。证明本研究中采用裸眼目视比色是可行的,其线性也是可信的。
通过重复制备多次显色工作曲线,还可以判断本方法的最低显色浓度和线性范围,在上样量 2微升时最低显色浓度为 0.03 mg·mL-1,最大显色浓度为1.2 mg·mL-1。
2.5 实际样品验证
以 HPLC方法可以对构筑的直读显色方法展开确证。相关信息见附件材料,HPLC证明本直读显色结果在可行性范围内,本研究成功构筑出一种可以通过肉眼直读观察多通道同时检测茶叶中氨基酸的直读显色条带。
2.6 纳米显色剂显色机理与优势探讨
一般而言,在层析完成后层析斑点的面积大小和颜色深度与样品浓度直接相关。在本研究中,我们为了有利于肉眼判断,我们统一设定显色区的颜色深浅度作为半定量指标,类似于柱色谱中的峰高指标。另外,本研究构筑的纳米显色剂尺度远小于层析板的硅胶固定相颗粒,当待测组分迁移到该位置时,易因为毛细管吸附作用被硅胶表面打印的纳米显色剂吸附至上层,因而不会产生原来显色斑点的晕轮现象,即中心颜色深于外周。因此,从这点来说,以颜色深度直接判断是可行的。
通过一系列合成步骤合成的茚三酮/纳米二氧化钛复合物既具备了茚三酮作为灵敏显色剂的功能,也具备了纳米二氧化钛的优异性能。纯净的纳米二氧化钛呈纯白色,因而不影响后续的显色反应。显色后清晰稳定可保持3 d左右。而常规茚三酮喷雾法具有显色不稳定的特点,显色后易褪色,见图7中图和右图。喷雾法喷洒的茚三酮显色斑点扩散、面积大且模糊,色斑显色不均匀,边缘部分出现暗红色杂质,难以裸眼直读比对显色结果。因此,茚三酮/纳米二氧化钛复合物相较于单纯的茚三酮化学性质更稳定,利于长期保存。综上可知,该纳米材料非常适用于茶叶中氨基酸的定性及半定量实验。本研究尚未对其他几种氨基酸展开分析,根据本研究的研究结果,在今后可继续开展对其他几种氨基酸的直读分析,有望建立茶叶特定品种的标准谱图。
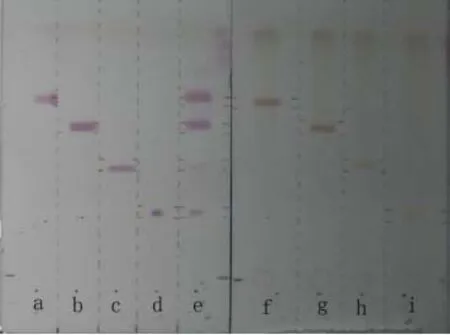
图4 4种氨基酸单标及混标的直读显色条带显色效果Fig. 4 The direct-reading coloration results for different amino acid standards
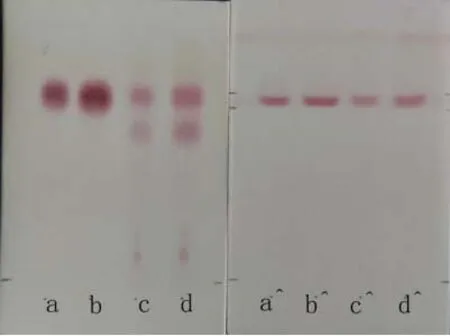
图5 乙酸乙酯处理后茶汤中的茶氨酸直读显色效果Fig. 5 The direct-reading colorimetric result of the theanine in extraction solution of tea after being decolorized by ethyl acetate
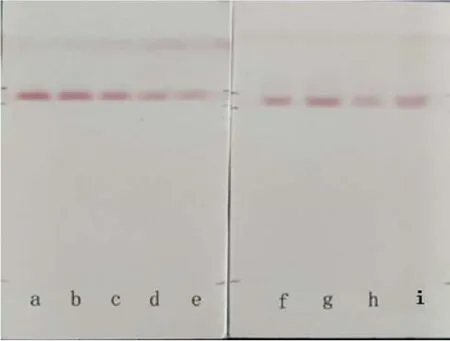
图6 茶氨酸的5个浓度梯度显色及脱色茶汤直读显色分析Fig. 6 Direct-reading coloration results of five concentration gradients of theanine standard solution and direct coloration analysis of the decolorized extraction solution of tea
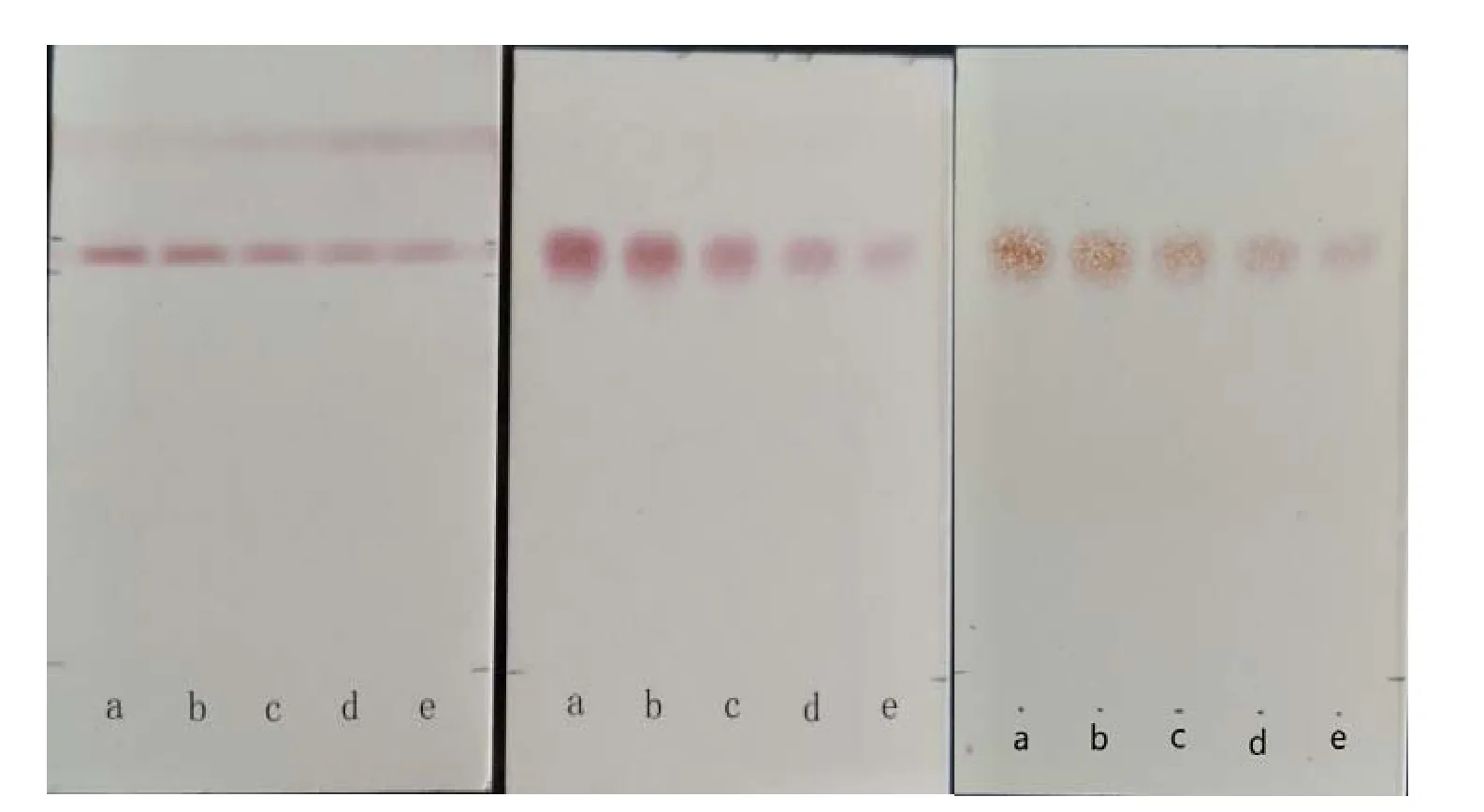
图7 两种显色模式的显色效果对比Fig. 7 The comparison of the two coloration modes
3 结论
本研究通过构筑纳米显色材料,结合单向展开对脱色茶汤进行薄层层析,构建出一种便携的直读显色条带,能快速半定量检测茶叶茶氨酸。在优化后的展开条件下能够有效地分离茶叶提取物中混合氨基酸,自显色后条带色斑均匀清晰,所构筑的新型纳米显色剂对目标氨基酸茶氨酸实现了灵敏的直读显色,其颜色深浅度与其浓度之间有明确的半定量关系。最低显色浓度为 0.03 mg·mL-1,线性范围在0.03~1.2 mg·mL-1。标准品添加法以及 HPLC法均证明该法可靠性好。与传统层析方法检测氨基酸相比,本研究构建的直读显色条带具有显色稳定、简便快捷等优势,在农产品品质鉴定与现场快速检测氨基酸等领域有着广泛的应用前景。
[1] Haskell CF, Kennedy DO, Milne AL, et al. The effects of L-theanine, caffeine and their combination on cognition and mood [J]. Biological Psychology, 2008, 77(2): 113-122.
[2] Wang HF, Tsai YS, Lin ML, et al, Comparison of bioactive components in GABA tea and green tea produced in Taiwan[J]. Food Chemistry 2006, 96(4): 648-653.
[3] Scharbert S, Hofmann T. Molecular definition of black tea taste by means of quantitative studies, taste reconstitution,and omission experiments [J]. Journal of Agricultural and Food Chemistry, 2005, 53: 5377-5384.
[4] 毛清黎. 茶叶氨基酸的研究进展[J]. 氨基酸和生物资源,1989(4): 16-21.
[5] 程启坤, 阮宇成, 王月根, 等. 绿茶滋味化学鉴定法[J].茶叶科学, 1985, 5(1): 7-17.
[6] 刘爽, 杨停, 谭俊峰, 等. 绿茶滋味定量描述分析及其化学成分的相关性研究[J]. 中国农学通报, 2014, 30(24): 40-46.
[7] Ruan JY, Gerendas J, Hardter R, et al. Effect of nitrogen form and root-zone pH on growth and nitrogen uptake of tea (Camellia sinensis) plants [J]. Annals of Botany, 2007, 99(2): 301-310.
[8] Deng WW, Ogita S, Ashihara H, Biosynthesis of theanine(gamma-ethylamino-L-glutamic acid) in seedlings ofCamellia sinensis[J]. Phytochemistry Letters, 2008, 1(2): 115-119.
[9] Oh K, Kato T, Xu HL. Transport of nitrogen assimilation in xylem vessels of green tea plants fed with NH4-N and NO3-N[J]. Pedosphere, 2008, 18(2): 222-226.
[10] Ruan J, Haerdter R, Gerendas J. Impact of nitrogen supply on carbon/nitrogen allocation: a case study on amino acids and catechins in green tea [Camellia sinensis(L.) O. Kuntze]plants [J]. Plant Biology, 2010(12): 724-734.
[11] Sasaoka K, Kito M, Onishi Y. Some properties of theanine synthesizing enzyme in tea seedlings [J]. Agricultural and Biological Chemistry, 1965, 29(11): 984-988.
[12] 黄建琴. 氨基酸在茶叶制造中的转化机理及对茶叶品质的影响[J]. 氨基酸和生物资源, 1992(1): 26-29.
[13] Wood PL, Khan MA, Moskal JR. Neurochemical analysis of amino acids, polyamines and carboxylic acids: GC-MS quantitation of tBDMS derivatives using ammonia positive chemical ionization [J].Journal of Chromatography B, 2006, 831: 313-319.
[14] Thippeswamy R, Gouda KGM, Rao DH, et al. Determination of theanine in commercial tea by liquid chromatography with fluorescence and diode array ultraviolet detection [J]. Journal of Agricultural and Food Chemistry, 2006, 54(19): 7014-7019.
[15] 杨四润, 张冬莲, 方乔慧, 等. γ-氨基丁酸茶薄层检测方法的建立[J]. 食品安全质量检测学报, 2012, 3(1): 33-39.
[16] 王督, 张文, 李培武, 等. 胶体金免疫层析法快速定量分析粮油农产品中黄曲霉毒素 B1[J]. 中国油料作物学报,2014, 36(4): 529-532.
[17] 张锂. 薄层层析酶化学法测定马拉硫磷残留[J]. 兰州工业学院学报, 2017, 24(6): 82-85.
[18] 刘顺字, 郭淑贞, 林双娣, 等. 酶抑制法在农药残留快速检测过程中的应用分析[J]. 湖南农业科学, 2017(7): 85-87, 91.
[19] 杨丽, 尤丽, 叶金秀, 等. 纸层析分离鉴定氨基酸实验的改进[J]. 云南民族大学学报(自然科学版), 2011, 20(3): 229-231
[20] 王海龙, 崔智慧, 岳秀兰. 氨基酸薄层层析茚三酮显色改良[J]. 包头医学院学报, 2003, 19(4): 312-360.
[21] 马雪泷, 邹鹏飞, 王荡强, 等. 纸层析-分光光度法检测茶氨酸[J]. 植物生理学报, 2012, 48(4): 413-417.
[22] 张宜明, 叶海鹏, 李顺, 等. 茚三酮/纳米二氧化钛复合物及其制备方法和用途: CN201510817477.3[P].2016-01-27[2017-12-05].http://www.wanfangdata.com.cn/details/detail.do?_type=pat ent&id=CN201510817477.3.
[23] 阮宇成, 王月根. 茶氨酸的简化定量法[J]. 茶叶通讯.1981(3): 41-45.
[24] 张丹丹, 叶小辉, 赵峰, 等. 基于游离氨基酸组分的白茶滋味品质研究[J]. 福建农业学报, 2016, 31(5): 515-520.
