利用网络药理学方法预测金丝桃苷治疗动脉粥样硬化的作用靶点及作用机制△
2018-06-21刘驰袁宇赵文婷胡丽萍
刘驰,袁宇,赵文婷,胡丽萍
(辽宁中医药大学,辽宁 沈阳 110847)
中药是一个高度复杂的化学物质体系,其复杂性表现为化学成分的复杂,以及与人体相互作用关系的复杂。中药研究者通过多途径、多靶点、整体调节机制探索中药的药效作用。但迄今为止,中药药效物质基础和作用机制研究尚无根本性突破,原因是缺乏对中药高度复杂性及系统性进行研究的手段,如何揭示并系统阐明中药化学物质组成与药效间的复杂关系,是中药新药研发的热点和关键[1]。
网络药理学是在系统生物学和多向药理学快速发展的基础上提出的药物设计新方法和新策略,它基于“疾病-基因-靶点-药物”相互作用网络的基础,通过分析基因网络库、蛋白网络库、疾病网络库、药物网络库等现有数据库的信息资料,结合从实验中获得的谱图数据,利用专业网络分析软件及算法,系统的、整体的揭示疾病-疾病、疾病表型-靶点蛋白、靶点蛋白-药物、药物-药物之间的联系[2]。网络药理学的出现为中药成分-靶点-疾病-机制的研究提供了新的方法。
山楂作为常用中药材,临床上应用广泛,其药理作用主要包括调节血脂、助消化、保肝、降血压、抗氧化、抗肿瘤等[3]。有实验证明,山楂的降血脂作用显著,并对动脉粥样硬化(atherosclerosis,AS)有治疗作用[4-5]。然而山楂(果肉、核及叶)所含化学成分较多,目前为止从山楂中发现且分离得到的物质有150多种,包括黄酮及其苷、有机酸、黄烷及其聚合物等[6]。现有研究发现,山楂黄酮是降血脂的主要成分,而金丝桃苷(Hyperin,Hyperoside,Hyp)是山楂黄酮的主要组分之一,可能对于治疗高血脂症,阻止血管动脉粥样硬化的形成具有重要的意义[7]。
目前,对Hyp治疗AS的作用靶点及其分子机制相关研究较少,需要进一步挖掘和整合,因此本文利用网络药理学方法构建“成分-靶点-疾病-通路”相互作用关系网络,预测Hyp治疗AS的作用靶点及其作用机制,为后续实验提供参考性依据。
1 材料
TCMSP数据库(http://ibts.hkbu.edu.hk/LSP/tcmsp.php);Uniprot数据库(http://www.uniprot.org/);GAD数据库(https://geneticassociationdb.nih.gov/);DAVID数据库(https://david.ncifcrf.gov/);Cytoscape-v3.2.1。
2 方法
2.1 Hyp相关靶点预测
TCMSP数据库是西北农林科技大学研究开发的中药系统药理学数据库和分析平台,该数据库包含499味草药以及每味草药的化合物成分,针对每个化合物提供了较全面的人体吸收、分布、代谢和排泄性质评价数据,同时提供了潜在活性分子的靶点及疾病信息,通过TCMSP数据库查询Hyp作用靶点,检索得到Hyp相关靶点蛋白名称。全球蛋白质资源数据库Uniprot是一个集中收录蛋白质资源并能与其他资源相互联系的数据库,也是收录蛋白质序列目录最广泛、功能注释最全面的一个数据库,利用Uniprot数据库将靶点蛋白名称转换成相对应的基因名称并去除非人源的靶点基因名称,为后期PPI网络的拓扑分析做准备。
2.2 AS相关靶点预测
GAD数据库由美国国立卫生院开发和维护,数据库的信息以基因为核心,支持在线查询某种特定疾病相关的基因或某个基因相关的疾病信息。首先对整个GAD数据库的数据进行下载,然后查询AS作用靶点,剔除重复项后直接得到AS相关靶点基因名称。
2.3 Hyp靶点蛋白质相互作用关系PPI网络构建
将准备好的Hyp作用靶点的基因名称导入Cytoscape-v3.2.1软件,绘制Hyp作用靶点与靶点相关蛋白的相互作用关系网络图。具体操作步骤:1)打开Cytoscape-v3.2.1软件中的Bisogenet插件,将Hyp作用靶点基因名称导入Input Identifiers。2)参数设置。导入基因名后可见“Network building options”,“Network building options”下面包括4个按钮,分别为“Identifiers”、“Data Settings”、“Method”和“Output”。首先,点击“Identifiers”可见选项“Organism”和“Map Input identifiers list to”,在“Organism”中选择“Homo sapiens(Human)”,在“Map Input identifiers list to”选择“Gene identifiers only”。其次,点击“Data Settings”可见“BioRelation Types”下面“Protein protein Interaction”选项,打开“Protein protein Interaction”后可在“Data Sources”选项下进行数据库选择,最终选择“BIOGRID”数据库。最后,“Method”和“Output”按钮中内容为默认选项,可以不做处理。3)点击Submit进行PPI网络构建。
2.4 AS靶点蛋白质相互作用关系PPI网络构建
将准备好的AS作用靶点的基因名称导入Cytoscape-v3.2.1软件,绘制AS作用靶点与靶点相关的蛋白的相互作用关系网络图。具体操作步骤:1)打开Cytoscape-v3.2.1软件中的Bisogenet插件,将AS作用靶点基因名称导入Input Identifiers。2)参数设置。导入基因名后可见“Network building options”,“Network building options”下面包括4个按钮,分别为“Identifiers”、“Data Settings”、“Method”和“Output”。首先,点击“Identifiers”可见选项“Organism”和“Map Input identifiers list to”,在“Organism”中选择“Homo sapiens(Human)”,在“Map Input identifiers list to”选择“Gene identifiers only”。其次,点击“Data Settings”可见“BioRelation Types”下面“Protein protein Interaction”选项,打开“Protein protein Interaction”后可在“Data Sources”选项下进行数据库选择,最终选择“BIOGRID”数据库。最后,“Method”和“Output”按钮中内容为默认选项,可以不做处理。3)点击Submit进行PPI网络构建。
2.5 PPI网络的拓扑分析和核心靶点的筛选
首先,通过Hyp靶点相互作用关系PPI网络和AS靶点相互作用关系PPI网络构建交集网络。其次,使用Cytoscape-v3.2.1软件中CytoNCA插件对新建立的交集网络进行拓扑分析,操作步骤:1)选择“Tool”后下拉菜单选择“NetworkAnalyzer”,接着在“NetworkAnalyzer”的子菜单中选择“Network Analysis”,然后在“Network Analysis”的子菜单中选择“Analyze Network”。2)除Degree(DC)和Select All Centralities外,勾选其他选项进行分析。3)选择“File”后下拉菜单选择“exprot”,接着在“exprot”的子菜单中选择“table”,在“table”的子菜单中选择“Export Table”,然后在“Export Table”的子菜单中选择“Merged Network defaul node”导出拓扑数据。4)根据导出的拓扑数据计算Degree的中位数。最后,用Degree值筛选核心靶点。筛选条件参数设置:①点击“Select”按钮选择“+”,接着选择“column fliter”下拉菜单中的“Node:Degree”可以进行Degree值范围设置。②对Degree值范围的界定,上限为拓扑数据中Degree的最大值,下限为Degree的中位数的两倍。
2.6 对核心靶点进行GO注释分析和KEGG通路分析
利用DAVID数据库(https://david.ncifcrf.gov/)进行GO注释分析和KEGG通路分析。设置参数,1)Upload:Step 1-输入核心靶点基因名称,Step 2-official genesymbol,Step 3-Gene List,Step 4-Submit List。2)List:Homo sapiens-Select Species。3)Background:Homo sapiens-use。参数设置完成后得到Gene_Ontology(GO注释分析)和Pathways(KEGG通路分析)数据,根据得到的数据结果进行进一步的筛选,筛选条件符合P<0.05和P<0.01。
3 结果
3.1 Hyp靶点信息及PPI网络图
通过TCMSP数据库检索得到Hyp靶点蛋白质9个,剔除非人源靶点后最终得到8个靶点蛋白质,将8个靶点蛋白名称转化成8个靶点基因名称,靶点相关信息见表1。将8个靶点基因名称导入Cytoscape-v3.2.1软件,生成Hyp靶点蛋白质相互作用关系PPI网络,结果显示与Hyp相关的节点蛋白质278个,边缘蛋白质2308个,Hyp的PPI网络图见图1。

表1 金丝桃苷相关靶点信息
3.2 AS靶点信息及PPI网络图
通过GAD数据库检索得到AS靶点基因172个,靶点基因信息见图2。将172个靶点基因名称导入Cytoscape-v3.2.1软件,生成AS靶点蛋白质相互作用关系PPI网络,结果显示与AS相关节点蛋白质1851个,边缘蛋白质25 980个,AS的PPI网络图见图3。
3.3 核心靶点信息
建立Hyp的PPI网络和AS的PPI网络的交集网络后,可以得到93个节点蛋白质和676个边缘蛋白质构成的交集网络图,交集网络图见图4。对交集网络图的拓扑数据中Degree值进行排序,得到Degree最大值为57,计算所得Degree值中位数为13,将核心靶点筛选条件范围设置为26~57,最终筛选结果得到10个核心靶点蛋白质,具体核心靶点蛋白质信息见图5。

注:靶点;靶点相关节点蛋白质。图1 金丝桃苷PPI网络图

图2 动脉粥样硬化相关靶点信息

图3 动脉粥样硬化PPI网络图
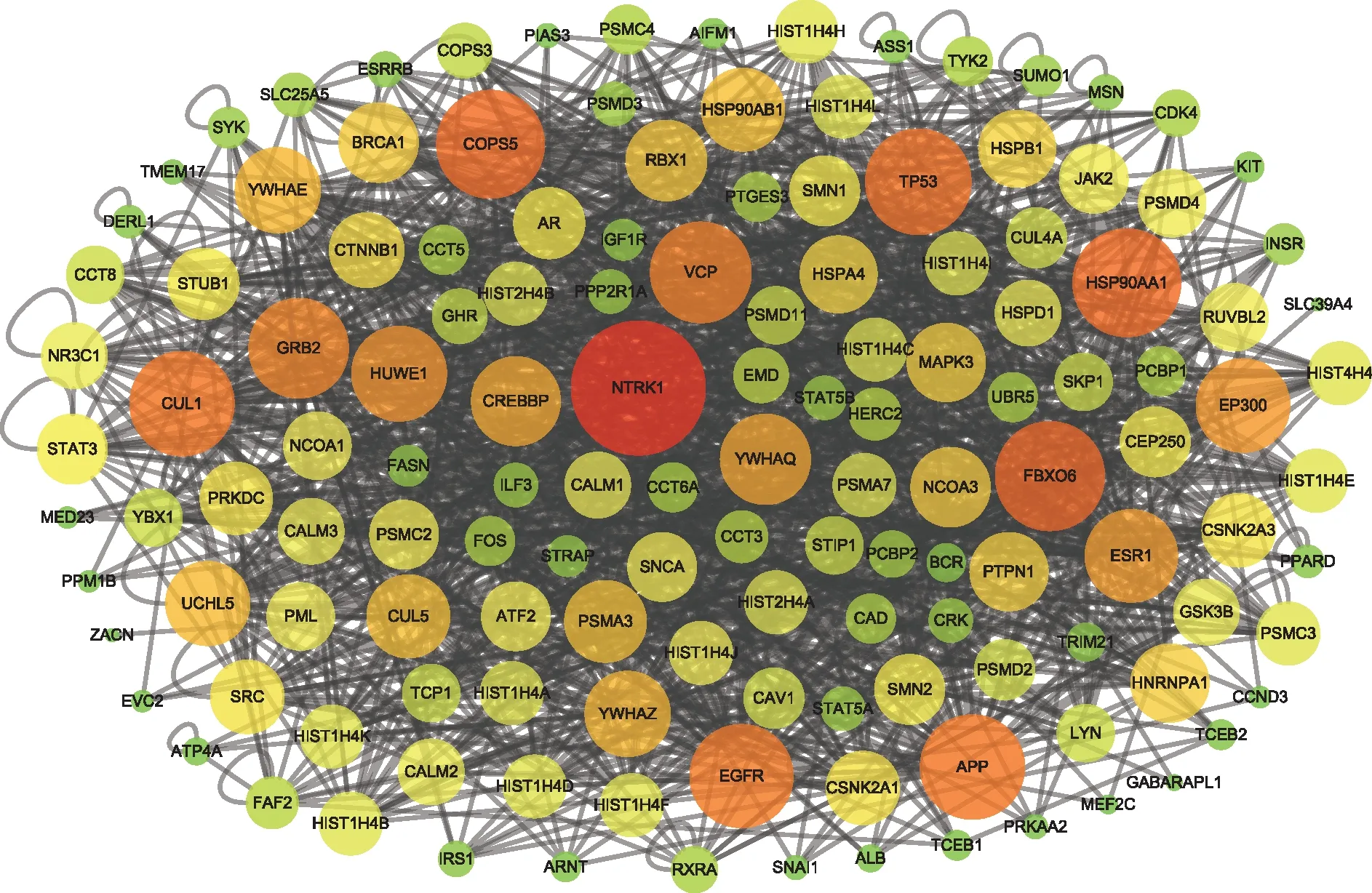
注:表示Degree值由小到大。图4 金丝桃苷PPI网络和动脉粥样硬化PPI网络的交集网络

图5 核心靶点蛋白质
3.4 核心靶点的GO注释分析和KEGG通路分析结果可视化
通过DAVID数据库分析,GO注释分析结果显示有9个基因有注释数据,42个生物过程中有富集,设置筛选条件后,符合P<0.05的生物过程有29个,符合P<0.01的生物过程有12个,GO注释分析信息见图6。KEGG通路分析结果显示有9个基因有注释数据,17条通路有富集,设置筛选条件后,符合P<0.05的通路有7条,符合P<0.01的信号通路有4条,KEGG通路分析信息见图7。在GO注释分析和KEGG通路分析中都有富集的是磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)信号通路和丝裂原活化蛋白激酶(MAPK)信号通路。

图6 金丝桃苷治疗动脉粥样硬化的GO注释分析

图7 金丝桃苷治疗动脉粥样硬化的KEGG通路分析
4 讨论
动脉粥样硬化是导致冠心病的主要病理学基础。早在18世纪中叶病理学家发现50%~70%的急性心肌梗死患者冠状动脉固定狭窄<50%。1910年Osler认为,冠状动脉粥样硬化时,任何用力均可引起心肌缺血。动脉粥样硬化的发病机制一直是研究热点,目前认为可能是多种发病机制共同作用的结果,涉及复杂和庞大的细胞内信号转导网络,包括血管损伤、炎症、凋亡、细胞增殖和氧化应激等[8]。
我们前期实验证明山楂总黄酮在降血脂和心肌缺血保护方面发挥重要的作用。金丝桃苷又名槲皮素-3-O-β-D吡喃半乳糖苷,是山楂中的主要化学成分之一,属于黄酮醇类化合物,目前最突出的药理活性是抗氧化应激、抗细胞凋亡、抗血栓和抗炎[9-10]。因此探索金丝桃苷对于动脉粥样硬化的干预作用具有重要意义。
为了找到Hyp作用于AS的关键分子或调节结点,本文利用网络药理学的方法首先预测AS作用靶点蛋白质172个和Hyp作用靶点蛋白质8个,然后构建AS靶点蛋白质相关的蛋白质PPI网络和Hyp靶点蛋白质相关的蛋白质PPI网络,取两个蛋白质PPI网络的交集,得到交集节点蛋白质93个,最后经过筛选得到10个核心靶点蛋白质,分别为EGFR、GRB2、NTRK1、HSP90AA1、HSP90AB1、FBO6、PSMA3、PTPN1、HUWE1和VCP。通过靶点蛋白进行GO注释分析和KEGG通路分析,分析结果显示PI3K/AKT和MAPK两条信号通路在GO注释分析和KEGG通路中都有富集,因此,Hyp治疗AS可能是通过PI3K/AKT和MAPK两条信号通路而发挥作用。
表皮生长因子受体(Human epidermal growth factor receptor,HER/erbB)家族是酪氨酸激酶受体(RTKs),他们包括4种同源的跨膜蛋白:HER1(EGFR或erbB1)、HER2(neu或erbB2)、HER3(erbB3)和HER4(erbB4)[11]。表皮生长因子受体信号通路启动首先是受体和配体形成二聚体,其中EGFR与HER2形成的异二聚体最常见,然后C-末端酪氨酸的磷酸化为具有SH2结构域或者PTB结构域的蛋白质信号分子提供结合位点,这些信号分子包括:衔接蛋白(如GRB2)和激酶(如PI3K),进行信号传递。启动含有SH2结构域的信号转导分子来激活MAPK级联反应(含有衔接蛋白GRB2)和PI3K信号通路(含有激酶PI3K)[12]。因此,EGFR和GRB2两个核心靶点蛋白质可能在PI3K/AKT和MAPK两条信号通路中起到关键的作用。
PI3K属于磷脂激酶家族,主要通过两种方式激活:一种是与具有磷酸化酪氨酸残基的生长因子受体(如EGFR)等或者衔接蛋白相互作用,引起聚二体构象改变而被激活;另一种是通过Ras和催化亚基直接结合导致PI3K活化,活化的PI3K进一步催化胞质膜上PIP3的生成,PIP3与含有PH结构域的信号蛋白AKT结合而活化AKT[13-14]。PI3K/AKT信号通路在细胞增殖和凋亡方面发挥重要作用。
MAPK信号主要特点是具有MAPK级联反应,MAPK至少有12种,分属于ERK家族、p38家族和JNK家族,在不同的细胞中,MAPK通路成员组成及诱导的细胞应答有所不同。ERK在生长因子介导的细胞增殖过程中发挥重要作用。Ras属于ERK家族,Ras/MAPK信号通路转导表皮生长因子(EGF)信号,其基本过程是EGF与HER2形成异二聚体,激活受体的蛋白激酶活性,受体自身酪氨酸残基磷酸化形成SH2结合位点,从而结合含有SH2结构域的接头蛋白GRB2,进一步活化SOS分子,活化的SOS结合Ras蛋白,促进Ras释放GDP、结合GTP,活化的Ras蛋白(Ras-GTP)可以激活MAPK级联反应,通过磷酸化作用激活多种效应蛋白,从而发挥作用[15-16]。MAPK信号通路与细胞增殖、分化、转化和凋亡密切相关。
综上所述,Hyp治疗AS的机制可能是通过EGFR和GRB2两个核心靶点蛋白质调控PI3K/AKT和MAPK两条信号通路,参与AS相关因子、蛋白和受体等重要调控分子的活化而影响AS的病理进程。
[1] 戎文慧,詹正嵩,朴淳一,等.中药发展现状与思考[J].白求恩军医学院学报,2011,9(3):203-205.
[2] 刘志华,孙晓波.网络药理学:中医药现代化的新机遇[J].药学学报,2012,47(6):696-703.
[3] 吴士杰,李秋津,肖学凤,等.山楂化学成分及药理作用的研究[J].药物评价研究,2010,33(4):316-319.
[4] 高英英,马雷,王姗姗,等.山楂叶总黄酮对大鼠动脉粥样硬化血管内皮损伤机制影响的研究[J].齐齐哈尔医学院学报,2015,36(31):4684-4686.
[5] 高英英,欧芹,魏晓东,等.山楂叶总黄酮对AS模型大鼠PPARα、LXR、ABCA1mRNA表达的影响[J].中国老年学杂志,2011,31(13):2502-2504.
[6] 王超群,郭敏,易敏之,等.山楂化学成分及高效液相色谱分析方法研究进展[J].中国中医药信息杂志,2006,13(11):93-95.
[7] 李贵海,孙敬勇,张希林,等.山楂降血脂有效成分的实验研究[J].中草药,2002,33(1):50-52.
[8] 张运.动脉粥样硬化研究的当前问题[J].中国医药科学,2012,2(1):9-11.
[9] 马舒伟,张挥球,张俊峰.金丝桃苷的心血管药理作用研究进展[J].黑龙江医药,2010,23(1):53-54.
[10] 李锦松,陈剑鸿,孟民杰.金丝桃苷药理作用及其作用机制的研究进展[J].广东药学院学报,2015,31(2):270-272.
[11] 陈锦飞,顾冬英.HER基因家族与乳腺癌诊断和治疗的研究进展[J].中国肿瘤外科杂志,2009,1(3):129-131.
[12] 吴健虹,谢秋玲,陈小佳,等.表皮生长因子受体EGFR及其信号传导[J].生命科学,2006,18(2):117-122.
[13] 孙栋勋,蔡志毅.EGFR/PI3K/Akt细胞信号传导通路与肿瘤[J].检验医学,2014,29(7):768-773.
[14] 刘姣,李明春.PI3K/Akt通路与表皮生长因子受体酪氨酸激酶抑制剂产生耐药性的关系研究进展[J].中国药理学通报,2013,29(12):1648-1650.
[15] 崔虎,关立克.丝裂原活化蛋白激酶(MAPK)在动脉粥样硬化中的意义[J].吉林医学,2013,34(1):132-134.
[16] 查锡良,药立波.生物化学与分子生物学[M].8版.北京:人民卫生出版社,2016:394-395.
