高分辨MRI大脑中动脉管壁改变与脑白质高信号相关因素分析
2018-06-21刘天怡杨诗琪赵庆龙李国忠陈洪苹
刘天怡,杨诗琪,赵庆龙,李国忠,钟 镝,陈洪苹
大脑白质高信号(White matter hyperintensities,WMH)是指在头部MRI T2WI和FLAIR图像上散在或融合分布于侧脑室旁或皮质下的异常高信号改变,这种异常的信号改变与许多脑血管病危险因素,如老龄、高血压病、糖尿病、高脂血症、吸烟等密切相关[1~4]。WMH通常被认为是细小的穿支动脉粥样硬化所致的脑小血管病的重要影像学标志物之一,然而近年研究显示,脑白质病变与大动脉粥样硬化,如颈动脉内膜中层厚度、颈动脉斑块数量及不稳定等因素也有一定关系,并且颅内大动脉粥样硬化狭窄比颅外动脉粥样硬化狭窄更可能导致WMH的发生[5~8]。本研究总结分析83例急性脑梗死患者的临床资料和3.0T头部常规MRI及大脑中动脉高分辨磁共振(High resolution magnetic resonance imaging,HRMRI)管壁成像影像特点,探讨大脑中动脉粥样硬化管壁影像特征与WMH改变的相关性,及脑血管相关危险因素与大脑中动脉粥样硬化管壁变化的关系及临床意义。
1 材料和方法
1.1 研究对象 连续收集哈尔滨医科大学附属第一医院神经内科2015年10月~2017年3月间86例经磁共振扩散加权像(DWI)诊断为急性脑梗死患者。
1.2 入组条件 (1)年龄>18岁。(2)急性发病在7 d之内DWI确诊为脑梗死。(3)需行头部DWI、MRI、MRA、双侧大脑中动脉三维等体素快速自旋回波采集序列(3D-VISTA)及颈内动脉超声扫描、心脏彩超、24 h动态心电图(Holter)检查。(4)签署知情同意书。排除标准:(1)非血管源性脑梗死。(2)磁共振成像检查禁忌症患者或图像质量不佳者。(3)拒绝参与登记调查者。
1.3 方法 记录所有入组患者详细病史资料,如:年龄、性别、身高、体重、吸烟、饮酒、 冠心病、脑卒中、糖尿病、高血压、入院NIHSS评分及改良Rankin评分(mRS)、颈部及锁骨下血管彩超。采集患者清晨空腹血,检测空腹血糖(FPG)、TC、TG、HDL-C、LDL-C、同型半胱氨酸。全部患者均使用Philips Achieva 3.0T磁共振扫描仪,16通道标准头部正交线圈。并且均在发病7 d内进行了头部常规MRI、DWI、3D-TOF MRA扫描,以及双侧大脑中动脉T1W 3D-VISTA扫描。FLAIR成像参数:TR 8000 ms,TE 125 ms,TI 2500 ms,FOV 230 mm,层厚 5 mm。DWI参数如下:TR 2586 ms,TE 47 ms,FOV 230 mm×230 mm×119 mm,层厚4 mm,矩阵 112×90。3D-TOF MRA参数:TR 25 ms,TE 3.5 ms,FOV 194 mm×194 mm×84 mm,层厚 1.2 mm,矩阵 276×275。T1W 3D-VISTA参数:TR 800 ms,TE 18 ms,FOV 200 mm×180 mm×40 mm,层厚0.6 mm,ETL 25,矩阵 332×300。
1.4 图像分析 图像采集完成后传输到Achieva副台后处理工作站进行处理,T1W 3D-VISTA图像进行MPR多维重建及曲面重建,层厚0.6 mm。每位患者的图像均由两名从事MRI诊断工作10 y以上的影像诊断医师进行盲法评片,两人对患者的临床信息均不知情。
1.4.1 WMH评分 根据MRI FLAIR成像结果对每位患者WMH进行评分,按照修订后的 Fazekas标准及欧洲老年人白质病变和残疾研究指标对其严重程度评分[9]:0分:无高信号。1分(轻度):独立高信号区域直径<10 mm或融合高信号区域直径<20 mm;2分(中度):独立高信号区域直径10~20 mm或融合高信号区域直径>20 mm;3分(重度):包括单个和融合的高信号区域直径≥20 mm。我们根据评分将患者分为两组:存在显著WMH的(2、3分)、不存在显著WMH的(0、1分)。
1.4.2 动脉粥样硬化程度评分 根据T1W 3D-VISTA图像对大脑中动脉粥样硬化管壁改变的严重程度进行评分,共分四分。0分:无法识别管壁;1分:识别的动脉壁无局灶性管壁增厚;2分:局灶性或弥漫性动脉管壁增厚;3分:局灶性或弥漫性管壁狭窄。我们将这个评分系统分为在高分辨MRI中存在严重的动脉粥样硬化管壁改变(2分、3分),不存在(0分、1分)两组。

2 结 果
本研究在纳入的86例患者中,最终符合标准的患者共83例(排除3例图像质量不佳者)。其中男性66例,女性17例,平均年龄(58.17±11.07)岁。
2.1 脑白质高信号与颅内外大动脉粥样硬化管壁改变评分 本研究中在FLAIR序列上存在显著WMH(2分、3分)为37例,不存在显著WMH(0分、1分)为46例。高分辨MRI中存在严重的大脑中动脉粥样硬化管壁改变(2分、3分)为38例,不存在(0分、1分)为45例。颈部及锁骨下动脉彩超示颈内动脉颅外段管壁正常、增厚及斑块者为61例,明显狭窄或闭塞为22例。采用spearman相关性分析,脑白质高信号程度和颈内动脉颅外段、大脑中动脉粥样硬化管壁改变密切相关(P<0.05;见表1)。

表1 脑白质高信号程度和颈内动脉颅外段大脑中动脉粥样硬化管壁改变相关性分析
2.2 大脑中动脉粥样硬化管壁改变与脑血管危险因素的关系HRMRI上大脑中动脉粥样硬化管壁改变的评分与年龄密切相关(P=0.004)。有明显动脉管壁改变的患者平均年龄高于无明显改变者(61.95∶54.98,P=0.004)。并且,有明显动脉管壁改变的患者高血压病(76.3%∶51.1%,P=0.018)和糖尿病(55.3%∶33.3%,P=0.045)的比例大,定量变量采用的两独立样本t检验,分类变量采用卡方检验(见表2),差异有统计学意义。在多因素回归分析中,年龄(OR1.065;P=0.011;见表3)与HRMRI上大脑中动脉粥样硬化管壁改变严重程度密切相关。
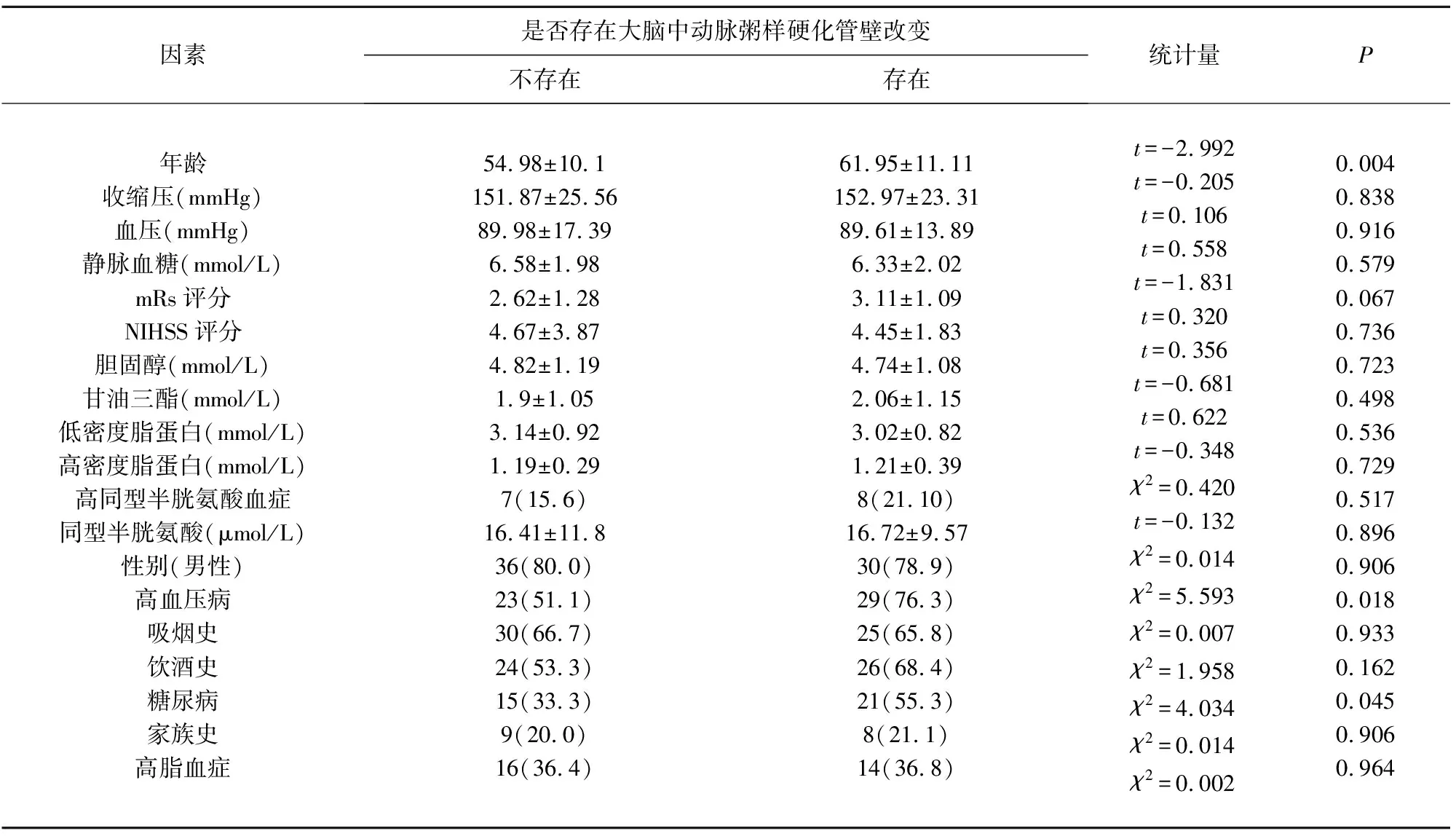
表2 大脑中动脉粥样硬化管壁改变危险因素分析
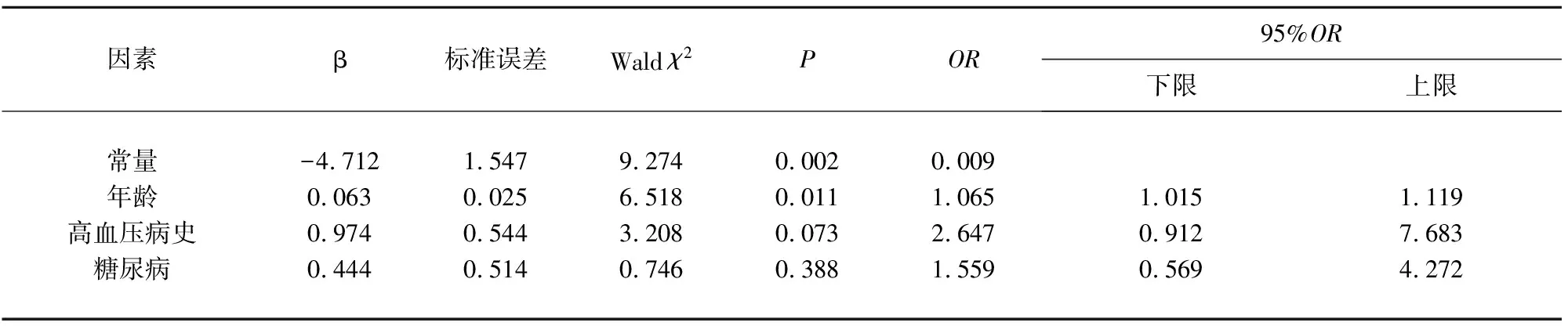
表3 大脑中动脉粥样硬化管壁改变的Logistic多因素回归分析
2.3 WMH与脑血管危险因素、大脑中动脉粥样硬化管壁改变 WMH评分与年龄、mRs评分、高血压病、糖尿病及大脑中动脉粥样硬化管壁改变密切相关(P<0.05,见表4)。在Logistic多因素回归分析中,高血压病(OR15.060,P<0.05)、HRMRI上大脑中动脉粥样硬化管壁改变(OR24.968,P<0.05,见表5)与WMH密切相关。
3 讨 论
尸检结果显示,90%动脉粥样硬化脑梗死患者伴有颅内动脉的粥样硬化斑块,并有43.2%的患者因动脉粥样硬化所致管腔狭窄[10]。近期的研究显示,高分辨MRI可以检测狭窄的大脑中动脉粥样硬化斑块[11]。也可以识别无明显血管狭窄的患者中异常的管壁增厚。使用这种成像平面我们可以在同一扫描时间内获得完整的双侧大脑中动脉M1段的图像。通常,健康的管壁是难以识别的,因为其无法与周围组织及脑脊液进行对比。因此,我们认为在高分辨MRI中无法识别的动脉管壁即是正常的。动脉粥样硬化所导致的管壁增厚是由于平滑肌细胞增生,增强细胞外基质、钙离子沉积等。大脑中动脉管壁高信号也许与内皮细胞损伤和滋养血管管增生继发的通透性增加有关。大量证据表明,颅内动脉尤其是近端血管的滋养血管可随年龄增长不断生成。滋养血管同样可在动脉粥样硬化及血管炎的条件下病理性增生[12]。Xu等的研究也发现T1高信号提示斑块内出血的可能[13]。因此,我们推测本研究中所示的大脑中动脉粥样硬化管壁改变提示管壁局限性增厚或斑块形成。
基于目前的研究现状,对于大脑中动脉粥样硬化管壁改变的危险因素尚无统一定论。目前普遍认为,年龄、高血压病为急性脑梗死患者颅内动脉粥样硬化的主要危险因素[14~16]。本研究对高分辨MRI下大脑中动脉粥样硬化管壁改变Logistic 回归分析显示,年龄是独立的危险因素。这可能与高龄患者接触其余致动脉粥样硬化危险因素风险增高有关。而单因素分析显示高血压病、糖尿病与其密切相关。糖尿病对于大血管病变的原因可能是由于血糖升高可促进氧化反应,进一步产生氧自由基,从而导致血管壁损害[17,18]。而长期高血压可导致血管壁增厚、管腔重塑,降低血管顺应性,并且血管内皮细胞释放过多的血管活性物质,使得血管收缩张力增高,最终导致动脉粥样硬化斑块形成。
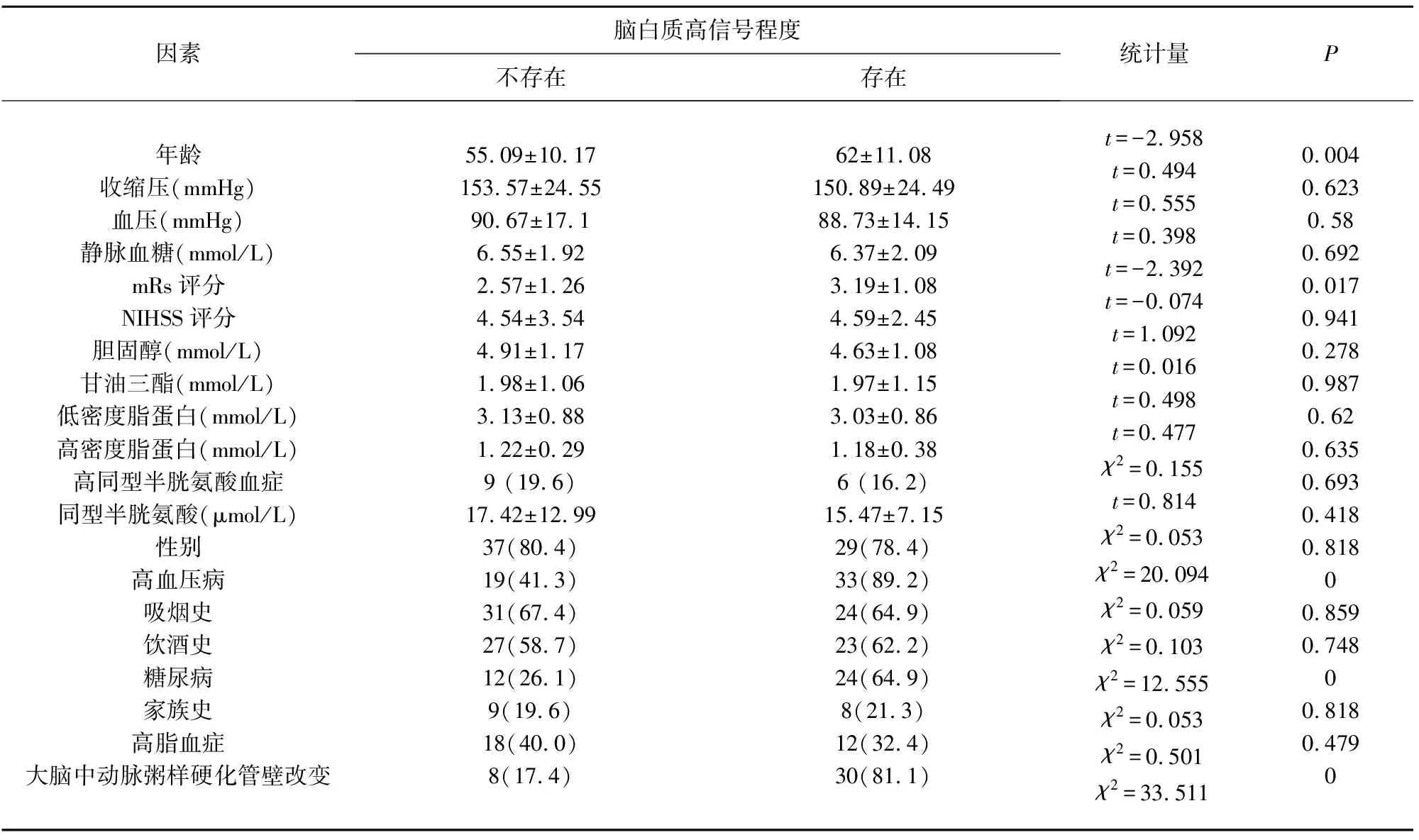
表4 脑白质高信号相关危险因素分析

表5 脑白质高信号程度的Logistic多因素回归分析
本研究中,高血压病、糖尿病及高分辨MRI下大脑中动脉粥样硬化管壁改变对于明显的WMH存在相关性。尸检标本研究显示,WMH在病理学中与髓鞘和轴突的变性改变、胶质增生和与小血管内的动脉粥样硬化、透明质酸变性及纤维蛋白样坏死密切相关的腔隙性梗死有显著相关性[19]。WMH的发病机制仍存在争议并且没有得到完全的解释。其中一个可能存在的WMH发展机制是血管内皮功能障碍及损伤导致包括高血压病在内的多种结构性因素。内皮损伤后出现玻璃样变性和纤维化,导致小血管管腔狭窄、缺血、最终导致WMH。而长期的高血糖状态可导致血脑屏障通透性的改变,使脑部发生代谢紊乱,并造成微血管管壁内皮细胞的损伤。同时糖尿病也会引起炎性细胞因子的过度释放,使Tau蛋白过度磷酸化以及产生β-淀粉样蛋白沉积,使神经细胞发生损害。大脑中动脉位于脑小血管的“上游”,大脑中动脉粥样硬化改变将导致局部的异常血流脉冲传至远端并造成脑小血管出现损伤改变,而大动脉管腔狭窄也可能引起远端及穿支血管及脑实质的慢性低灌注损伤。许多文章中都研究了WMH的危险因素,而对其研究结果并不一致,只有老龄和高血压病是公认的唯一重要的危险因素。我们的结果同样显示老龄和高血压病与WMH密切相关。并且,在多因素分析大脑中动脉管壁改变提示动脉粥样硬化是最重要的危险因素。
在以往的研究中,大于50%的颅外颈动脉狭窄与脑白质病变呈反比或没有相关性。并且在目前的研究中WMH的评分在颅外动脉狭窄的患者与没有狭窄的患者中并无明显差异[20]。而本研究中仅通过超声多普勒,无法精确判断颅外大动脉的狭窄率,目前的结果显示,IC狭窄对于WMH是促进因素。IC狭窄的患者中可见更多的WMH。
本研究还有一些局限性:本文为横断面研究,尚不能判断大脑中动脉管壁改变与WMH的因果关系,我们已将入组患者进行3 m、6 m及1 y随访观察,以便进行后续研究。另一方面,本文对于大脑中动脉粥样硬化管壁改变的视觉分级,未测定斑块的体积及稳定性,并且没有病理学结果支持。
总之,本研究结果显示WMH评分与年龄、mRs评分、高血压病、糖尿病、颅外段颈动脉狭窄及高分辨下颅内大动脉粥样硬化管壁改变密切相关。普遍认为,WMH与认知功能减退、异常步态、抑郁等不同临床症状密切相关,可能增加脑卒中、痴呆等疾病发生风险,并且常见于高龄患者中[21~24]。而目前WMH并没有特效的治疗方法,所以如何预防WMH更具临床意义,本研究证实大脑中动脉粥样硬化管壁改变与WMH有相关性,大脑中动脉粥样硬化管壁改变是WMH的危险因素之一。因此早期发现大脑中动脉粥样硬化管壁改变并采取适当的干预措施,如减少大脑中动脉粥样硬化管壁改变相关危险因素的发生,可以间接的减少WMH的发生。我们希望通过今后的临床及基础研究探寻颅内大动脉粥样硬化与WMH的因果关系,寻求WMH确切的发生机制。
[参考文献]
[1]Suh DC,Lee SH,Kim KR,et al. Pattern of atherosclerotic carotid stenosis in Korean patients with stroke:different involvement of intracranial versus extracranial vessels[J]. American journal of neuroradiology,2003,24(2):239-244.
[2]Bodle JD,Feldmann E,Swartz RH,et al. Highresolution magnetic resonance imaging:an emerging tool for evaluating intracranial arterial disease[J]. Stroke,2013,44(1):287-292.
[3]Awad IA,Spetzler RF,Hodak JA,et al. Incidental subcortical lesions identified on magnetic resonance imaging in the elderly. I. Correlation with age and cerebrovascular risk factors[J]. Stroke,1986,17(6):1084-1089.
[4]Grueter BE,Schulz UG. Age-related cerebral white matter disease (leukoaraiosis):a review[J]. Postgrad Med,2012,88(1036):79-87.
[5]Bots ML,van Swieten JC,Breteler MM,et al. Cerebral white matter lesions and atherosclerosis in the Rotterdam Study[J]. Lancet,1993,341,1232-1237.
[6]De Leeuw FE,De Groot JC,Bots ML,et al. Carotid atherosclerosis and cerebral white matter lesions in a population based magnetic resonance imaging study[J]. Neurol,2000,247,291-296.
[7]Chung GH,Kwak HS,Hwang SB,et al. High resolution MR imaging in patients with symptomatic middle cerebral artery stenosis[J]. European Journal of Radiology,2012,8(12):4069-4074.
[8]Lee SJ,Kim JS,Chung SW,et al. White matter hyperintensities (WMH) are associated with intracranial atherosclerosis rather than extracranial atherosclerosis[J]. Arch Gerontol Geriatr,2011,53:e129-132.
[9]Fazekas F,Chawluk JB,Alavi A,et al. MR signal abnormalities at 1.5 T in Alzheimer’s dementia and normal aging[J]. AJR Am J Roentgenol,1987,149:351-356.
[10]Mazighi M,Labreuche J,Gongora-Rivera F,et al. Autopsy prevalence of intracranial atherosclerosis in patients with fatal stroke[J]. Stroke,2008,39(4):1142-1147.
[11] Huang B,Yang WQ,Liu XT,et al. Basilar artery atherosclerotic plaques distribution in symptomatic patients:a 3.0 T high-resolution MRI study[J]. Eur J Radiol,2013,82:e199-203.
[12] Portanova A,Hakakian N,Mikulis DJ,et al. Intracranial vasa vasorum:insights and implications for imaging[J]. Radiology,2013,267:667-679.
[13]Xu WH,Li ML,Gao S,et al. Middle cerebral artery intraplaque hemorrhage:prevalence and clinical relevance[J]. Ann Neurol,2012,71:195-198.
[14] Wityk RJ,Lehman D,Klag M,et al. Race and sex differences in the distribution of cerebral atherosclerosis[J]. Stroke,1996,27:1974-1980.
[15] Passero S,Rossi G,Nardini M,et al. Italian multicenter study of reversible cerebral ischemic attacks. Part 5.Risk factors and cerebral atherosclerosis[J]. Atherosclerosis.,1987,63:211-224.
[16] Kim YD,Choi HY,Jung YH,et al. Classic risk factors for atherosclerosis are not major determinants for location of extracranial or intracranial cerebral atherosclerosis[J]. Neuroepidemiology,2009,32:201-207.
[17]Mendes I,Baptista P,Soares F,et al. Diabetes mellitus and intracranial stenosis[J]. Rev Neurol,1999,28:1030-1033.
[18]Selvin E,Marinopoulos S,Berkenblit G,et al. Meta-anlysis:glycosylatek hemoglobin and cardiovascular disease in diabetes mellitus[J]. Ann lntern Med,2004,141:421-431.
[19]O’Sullivan M. Leukoaraiosis[J]. Pract Neurol,2008,8:26-38.
[20]wiszniewska M,Devuyst G,Bogousslavsky J,et al. What is the significance of leukoaraiosis in patients with acute ischemic stroke [J]. Arch Neurol,2000,57,925-926.
[21]Jean FB,Carole D,Bernard M,et al. Cerebral white matter lesions are associated with the risk of stroke but not with other vascular events. The 3-City Dijon Study[J]. Stroke,2009,40:2327-2331.
[22]Teodorczuk A,Firbank MJ,Pantori L,et al. Relationship between baseline white-matter changes and development of late-life depressive symptoms:3-year results from the LADIS study [J]. Psychol Med,2010,40:603-610.
[23]Kalaria RN,Erkinjuntti T. Small vessel disease and subcortical vascular dementia Small vessel disease and subcortical vascular dementia[J]. Clin Neurol,2006,2:1-11.
[24]Xu WH,Li ML,Gao S,et al. Middle cerebral artery intraplaque hemorrhage:prevalence and clinical relevance[J]. Ann Neurol,2012,71:195-198.
