Bcl-2、Bad在大鼠癫痫持续状态中的表达及rHuEpo干预的分子机制
2018-06-21于江华史志勤史诺菲苏旭东贾丽景朱梦楚冯晓红尹阔场王维平
于江华,史志勤,史诺菲,苏旭东,周 毅,王 珊 贾丽景,赵 博,朱梦楚,冯晓红,尹阔场,王维平
癫痫在任何年龄、地区和种族的人群中均有发病。癫痫发病有各种表现形式,但均可出现癫痫持续状态(status epilepticus,SE)。而细胞凋亡是SE后神经元丢失的重要形式[1]。有些研究证实癫痫发作可以导致海马神经元的损伤,同时这种损伤又成为反复癫痫发作时环路重建的重要因素之一[2]。PI3K/Akt(磷脂酰肌醇3激酶/蛋白激酶B)通路可能是癫痫发病的重要信号转导通路,Bcl-2(B淋巴细胞瘤2)、Bad(Bcl-xl/Bcl-2相关死亡启动因子)分别属于抗凋亡、促凋亡蛋白,他们在线粒体凋亡途径中起着重要作用。新近的研究发现促红细胞生成素(EPO)的功能再也不是传统认知上单纯的造血因子,而是具有多种功效的重要因子。神经系统损伤的众多动物模型的结果显示,Epo可能通过抗细胞凋亡、促存活等各种机制不同程度地减轻脑损伤,改善神经系统功能[3~7],但是Epo对癫痫持续状态动物模型的抗凋亡作用机制尚不清楚。本研究利用戊四氮(Pentylenetetrazol,PTZ)诱导大鼠癫痫发作,建立癫痫持续状态模型,观察rHuEpo(recombinant human erythropoietin,rHuEpo)对戊四氮诱导的大鼠SE发作后神经元的凋亡以及对线粒体凋亡途径相关调控因子Bcl-2、Bad表达的影响,同时观察是否PI3K/Akt途径是Epo发挥抗凋亡、促存活作用的重要通路。
1 材料和方法
1.1 实验动物 成年健康雄性SD大鼠(由河北省实验动物中心提供)。起始体重范围要求:(220±20)g,分笼喂养。
1.2 主要实验试剂及器材 选用美国Sigma公司生产的二甲基亚砜(dimethyl sulfoxide,DMSO)、LY294002以及PTZ;华药生产的重组人促红细胞生成素(Recombinant human Epo,rHuEpo);美国santacruz公司生产的兔抗p- Akt (Thr-308)多克隆抗体、兔抗Bcl-2、Bad多克隆抗体;美国Promega公司生产的RT-PCR反转录及扩增试剂;生工生物工程(上海)股份有限公司制造的引物;德国Eppendorf公司生产的PCR仪;英国Syngene公司生产的凝胶扫描分析系统。
1.3 方法
1.3.1 SE模型制备及实验分组 用197只大鼠依据公认的给药途径和剂量制备模型:开始时用腹腔注射方式给予PTZ20 mg/kg,之后每次注射10 mg/kg,每次间隔时间10 min,出现全身性惊厥大发作和/或发生SE时停止给药,并对大鼠给药后的表现进行评价。出现Racine六级评价标准中规定的Ⅳ、Ⅴ级表现时,归为全身性惊厥大发作,发作时间达到或者超过30 min视为癫痫持续状态。为保证实验规模,去除中途死亡和未成功造模的大鼠并随机补充。最终成功造模125只,随机分为5组:正常对照组(NS)、模型组(PTZ+NS)、rHuEpo干预组(PTZ+rHuEpo)、LY294002干预组(PTZ+rHuEpo+LY294002)、LY294002对照组(PTZ+rHuEpo+DMSO),各组随机平均分配25只大鼠。
1.3.2 给药 模型组:首先以PTZ引发SE,持续30 min后予以0.9%氯化钠溶液2 ml腹腔注射;rHuEpo干预组:首先以PTZ引发SE,持续30 min后予以rHuEpo 5000 U/kg腹腔注射;LY294002干预组:(以DMSO为溶媒,调整LY294002浓度为10 μg/5 μl),首先以PTZ引发SE,持续10 min后以5 μl LY294002行脑室注射,SE持续30 min后以rHuEpo 5000 U/kg行腹腔注射;LY294002对照组:首先以PTZ引发SE,持续10 min后以5 μl DMSO行脑室注射,SE持续30 min后以rHuEpo 5000 U/kg行腹腔注射;正常对照组:以同等体积的0.9%氯化钠溶液行腹腔注射。
1.3.3 大鼠侧脑室立体定位及注射给药 以《The Rat Brain in Stereotaxic Coordinates》内数据为标准,对注射部位予以定位(前囟后移0.8 mm,矢状缝侧移1.5 mm,硬脑膜下3.8 mm)。首先以PTZ引发SE,持续10 min后,LY294002干预组注射5 μl LY294002,LY294002对照组注射5 μl DMSO,注射后不拔针,5 min后再缓慢拔针,同时观察大鼠行为学状态。
1.3.4 大鼠行为学观察及脑电图(electroencephalogram,EEG)描记 实验大鼠行为学观察:给药后不间断观察2 h,对其有无癫痫发作、癫痫发作的表现形式、持续时间等做详细记录。脑电图描记:各组随机抽选5只予以EEG记录。麻醉后固定在定位仪上,充分暴露颅骨。左右两侧皮质及海马区域共用4个电极连接8个导联,大鼠清醒后开始记录。
1.3.5 海马组织学观察 SE发作24 h后对其实施过量麻醉、插管、灌注、开颅取脑,垂直横断,进行浸泡、脱水、包埋、切片等一系列的工作,做免疫组化染色与TUNEL染色。
1.3.5.1 TUNEL染色 选取TUNEL试剂盒,脱蜡、水化、孵育、显色、复染等步骤至封片。各份标本均依上述方法处理3张切片,在海马区任意取10个彼此没有重叠的视野,计算其中有染色且可见细胞核的细胞数目,每份标本的30个计数结果取平均值作为该标本最终结果,组内各样本再取平均值取得本组结果。
1.3.5.2 免疫组织化学染色 应用Streptavidin-Perosidase(SP)法。进行脱蜡、水化、洗涤、阻断等步骤,添加1∶200的兔抗P-Thr308-Akt多克隆抗体,1∶200的兔抗Bcl-2多克隆抗体和1∶150的兔抗Bad多克隆抗体,加入二抗。以PBS取代抗体构成对照组,观察目标为海马组织中Bcl-2和Bad的阳性细胞的数目。对标本的记取和计算方法与TUNEL染色相同。
1.3.6 RT-PCR检测 随机选取每组中的10只实验大鼠,迅速取出海马组织,抽提海马组织总的RNA,测定其浓度大小和纯度水平。每份样品取2 μg反转录其互补DNA,以互补DNA中1μg作为PCR底物进行扩增。用5μl逆转录PCR的产物做琼脂糖凝胶电泳,定量其条带灰度并分析取得半定量结果,重复5次计算平均值后进行统计学分析。产物的相对含量用Bad/β-actin和Bcl-2/β-actin表示。
1.3.7 Western blot检测 随机选择每组中的10只实验大鼠,迅速取出海马组织,对总蛋白进行浓度测定(BCA法)。添加1∶300的多克隆兔抗Akt、p-Akt抗体、1∶200的兔抗Bcl-2多克隆抗体和1∶150的兔抗Bad多克隆抗体,TPBS漂洗后加入1∶3000的羊抗兔IgG荧光抗体,孵育、漂洗,对目标条带与β-actin条带进行扫描并测定其单位密度,计算二者比值进行统计学处理。重复5次计算平均值,进行最终统计学分析。
2 结 果
2.1 大鼠行为学改变 实验中接受PTZ注射的共有197只大鼠,引发出现惊厥的最低剂量和数量分别为:30 mg/kg(75只)、40 mg/kg(77只)、50 mg/kg(45只)。PTZ注射剂量随着时间梯度递增,惊厥的主要体现形式分别为节律性缩头、肌阵挛、逐渐出现的四肢抽搐、口唇周围发紫,继而出现全身性强直-阵挛惊厥,SE持续时间>30 min。制模过程中约为35%大鼠死亡,另有3只未能成功建模,均予以剔除并随机补充。对照组未出现行为学改变。
2.2 脑电图变化 模型组脑电图可见大量高波幅的尖波、棘波、尖慢/棘慢复合波等痫样放电,呈现阵发性放电特点;对rHuEpo干预组、LY294002干预组和LY294002对照组的脑电图进行观察发现大鼠痫性放电受到显著抑制;与LY294002干预组相比,rHuEpo干预组、LY294002对照组的癫痫样放电明显减少。
2.3 TUNEL染色结果 见表1。细胞核棕黄色着色者为TUNEL阳性细胞。具体表现为:在正常对照组中散在出现少许凋亡细胞,在其余各组中凋亡细胞均有所增加且程度不同。正常对照组凋亡细胞数目显著少于其他4组(P<0.05);模型组凋亡细胞数目有显著的提高,rHuEpo干预组、LY294002干预组和LY294002对照组凋亡细胞数目显著少于模型组 (P<0.05);rHuEpo干预组、LY294002对照组凋亡细胞数目与LY294002干预组相比也明显减低 (P<0.05),LY294002对照组凋亡细胞数目虽多于rHuEpo干预组,但未表现出统计学差异(P>0.05)。
2.4 免疫组化染色结果 海马区p-Akt、Bcl-2、Bad蛋白的表达见表1~表3、图1、图2。神经元胞浆呈棕黄色着色视为染色阳性。正常对照组胞浆偶有棕黄色散在颗粒分布其中;相较于正常对照组,p-Akt、Bcl-2、Bad阳性细胞分布在其余4组均表现为显著增加的特点,具有统计学差异(P<0.05);LY294002干预组、LY294002对照组、rHuEpo干预组p-Akt、Bcl-2的阳性细胞数目明显多于模型组,而Bad的阳性细胞数目显著少于模型组,具有统计学差异(P<0.05);与LY294002干预组相比,rHuEpo干预组、LY294002对照组p-Akt、Bcl-2的阳性细胞数更多,Bad的阳性细胞数更少,体现出统计学差异(P<0.05);与LY294002对照组相比,rHuEpo干预组p-Akt、Bcl-2的阳性细胞数更多,Bad的阳性细胞数更少,但未体现出统计学差异(P>0.05)。
2.5 RT-PCR测定Bcl-2 mRNA、Bad mRNA的表达 见表2、表3、图3、图4。对照组Bcl-2 mRNA、Bad mRNA均有微弱表达;与正常对照组相比,模型组、rHuEpo干预组、LY294002对照组、LY294002干预组Bcl-2 mRNA、Bad mRNA的表达均有显著升高(P<0.05);模型组Bad mRNA的表达水平与rHuEpo干预组、LY294002干预组、LY294002对照组比较明显升高,Bcl-2 mRNA的表达水平则明显降低(P<0.05);与LY294002干预组相比,rHuEpo干预组、LY294002对照组Bad mRNA的表达明显减少,Bcl-2 mRNA的表达水平明显升高(P<0.05);与LY294002对照组相比,rHuEpo干预组Bad mRNA的表达有所减少,Bcl-2 mRNA的表达水平有所升高,但未体现出统计学差异(P>0.05)。
2.6 Western blot测定Akt、p-Akt、Bcl-2和Bad蛋白的表达 见表1~表3、图5、图6。大鼠海马组织Akt及p-Akt、Bcl-2、Bad蛋白表达显示:与模型组、rHuEpo干预组、LY294002干预组、LY294002对照组比较,对照组p-Akt、Bcl-2、Bad蛋白的表达明显减少(P<0.05);与rHuEpo干预组、 LY294002干预组、 LY294002对照组相比,PTZ组p-Akt、Bcl-2蛋白的表达出现明显下调的特征,Bad蛋白的表达出现明显上调的特征(P<0.05);与LY294002干预组比较,rHuEpo干预组、LY294002对照组p-Akt、Bcl-2蛋白的表达水平明显升高,Bad蛋白的表达水平明显降低,体现出统计学差异(P<0.05);虽然LY294002对照组与rHuEpo干预组相比,p-Akt、Bcl-2蛋白的表达减少,Bad蛋白的表达增多,但未体现出统计学差异(P>0.05)。rHuEpo、LY294002、DMSO的干预对Akt的表达水平未产生明显影响,其表达水平在各组间未体现出统计学差异(P>0.05)。

表1 各组大鼠海马区凋亡细胞、p-Akt阳性细胞计数、p-Akt蛋白表达
对照组与模型组、rHuEpo干预组、LY294002干预组、LY294002对照组比较*P<0.05;模型组与rHuEpo干预组、LY294002干预组、LY294002对照组比较ΔP<0.05;LY294002干预组与rHuEpo干预组、LY294002对照组比较▲P<0.05;rHuEpo干预组与LY294002对照组比较没有显著差异

表2 各组大鼠海马区Bcl-2阳性细胞、Bcl-2 mRNA、Bcl-2蛋白表达计数
对照组与模型组、rHuEpo干预组、LY294002干预组、LY294002对照组比较*P<0.05;模型组与rHuEpo干预组、LY294002干预组、LY294002对照组比较ΔP<0.05;LY294002干预组与rHuEpo干预组、LY294002对照组比较▲P<0.05;rHuEpo干预组与LY294002对照组比较没有显著差异

表3 各组大鼠海马区Bad 阳性细胞、Bad mRNA、Bad蛋白表达计数
对照组与模型组、rHuEpo干预组、LY294002干预组、LY294002对照组比较*P<0.05;模型组与rHuEpo干预组、LY294002干预组、LY294002对照组比较ΔP<0.05;LY294002干预组与rHuEpo干预组、LY294002对照组比较▲P<0.05;rHuEpo干预组与LY294002对照组比较没有显著差异

A:对照组;B:模型组;C:rHuEpo干预组;D:LY294002干预组;E:LY294002对照组图1 各组大鼠海马区BCL-2阳性细胞表达情况(SP×400)

A:对照组;B:模型组;C:rHuEpo干预组;D:LY294002干预组;E:LY294002对照组图2 各组大鼠海马区Bad阳性细胞表达情况(sp×400)
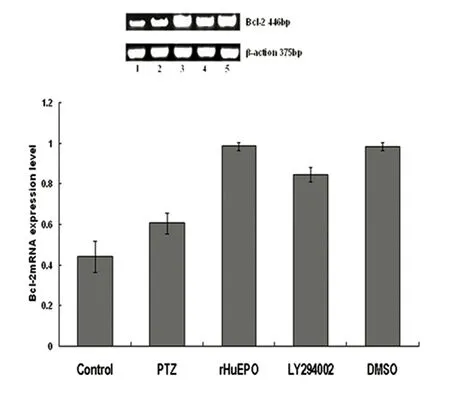
control:对照组;PTZ:模型组;rHuEpo:rHuEpo干预组;LY294002:LY294002干预组;DMSO:LY294002对照组
图3 每组大鼠Bcl-2 mRNA的表达情况
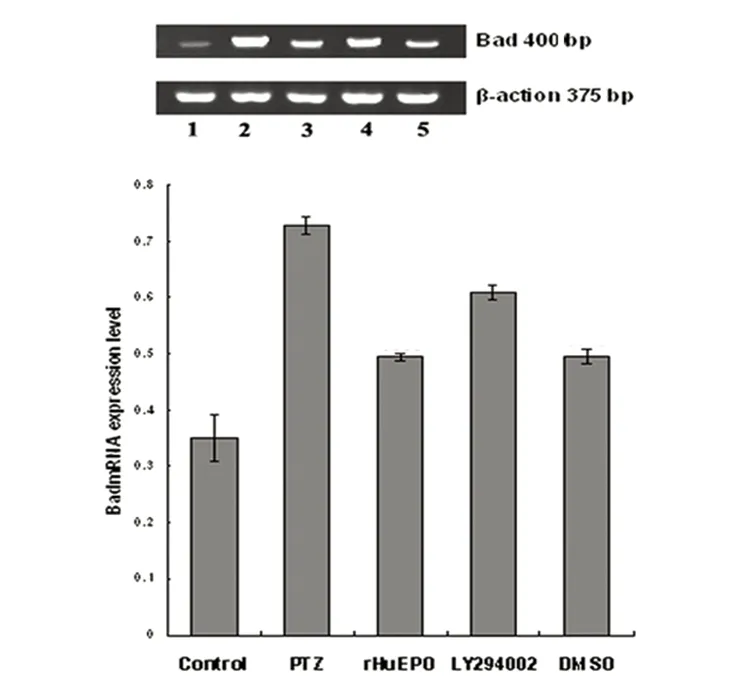
control:对照组;PTZ:模型组;rHuEpo:rHuEpo干预组;LY294002:LY294002干预组;DMSO:LY294002对照组
图4 每组大鼠Bad mRNA的表达情况

control:对照组;PTZ:模型组;rHuEpo:rHuEpo干预组;LY294002:LY294002干预组;DMSO:LY294002对照组
图5 每组大鼠Bcl-2蛋白的表达情况
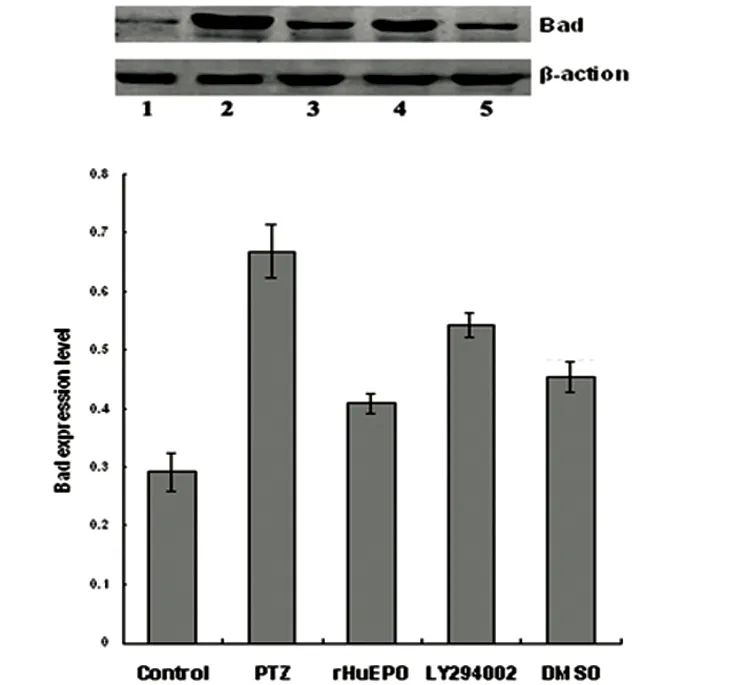
control:对照组;PTZ:模型组;rHuEpo:rHuEpo干预组;LY294002:LY294002干预组;DMSO:LY294002对照组
图6 每组大鼠Bad蛋白的表达情况
3 讨 论
癫痫持续状态是神经科的急症,死亡率约为10%~12%[8]。PTZ本身并无其他的神经毒性作用,所以PTZ作为致痫剂是一种较为科学的选择。本实验应用脑电图和Racine分级依据来做为检测造模是否成功的标准。已有研究显示SE发作后凋亡是非常重要的损伤形式[9],但其发生机制还不清楚。本研究在应用PTZ作为致痫剂的SE模型中采用TUNEL染色的办法来观察凋亡细胞的变化情况,结果显示:模型组海马区域的神经元出现坏死和凋亡的特征,凋亡细胞数量较正常对照组增多。线粒体依赖途径在凋亡中有着举足轻重的作用。Bcl-2家族蛋白的主要位点和作用位点均在线粒体膜上,Bcl-2家族被称为“凋亡的看门人”,是决定细胞命运走向的关键,Bcl-2、Bad都是Bcl-2家族中非常重要的关键因子。本实验采用免疫组织化学、逆转录-PCR、Westernblot等实验方法观察Bcl-2、Bad的变化情况,实验结果显示:模型组与正常对照组比较,Bcl-2和Bad免疫阳性细胞、Bcl-2 mRNA、Bad mRNA及Bcl-2、Bad蛋白表达均显著上调,表明PTZ激活了Bad、Bcl-2在海马神经元中的表达且表达水平明显增高。Henshall[10]和Meller[11]的实验研究也发现,神经元凋亡时Bcl-2、Bad蛋白可能被激活并参与其中,与我们的实验结果较为一致。脑组织中许多类型的细胞都含有Epo受体并且也可以产生内源性Epo[12]。本实验将rHuEpo作为神经保护剂在SE后30 mim行腹腔注射,实验结果显示rHuEpo的干预可明显减少癫痫样放电的发生,上调海马神经元内Bcl-2蛋白及mRNA的表达,下调促凋亡蛋白Bad及mRNA表达,提示rHuEpo可以调控这些线粒体凋亡途径相关因子的表达水平,减少海马神经元的坏死、凋亡,发挥神经保护作用。基于以上研究,进一步了解rHuEpo是如何对Bcl-2和Bad进行调控发挥抗凋亡作用的机制,成为了我们新的研究靶点。
PI3K/Akt信号传导通路是一条经典的调节细胞的生长、增殖、分化、生存的信号转导通路。Li[13],Uzum等[14]研究发现PI3K / Akt信号通路参与了改善记忆、抗癫痫的神经保护作用。Epo引起Akt的活化是其发挥抗细胞凋亡作用的关键。Akt是PI3K的直接下游底物,可以通过对p-Akt表达的观察,间接了解PI3K/Akt通路的激活状况。在我们的研究中通过免疫组化及Western blot等实验方法对SE大鼠p-Akt的表达进行观察,进而了解到PI3K/Akt通路的激活状况。本研究发现rHuEpo的干预可以使海马神经元内p-Akt的水平显著提高,显示 rHuEpo所发挥的神经保护作用与激活PI3K/Akt通路密切相关。PI3K/Akt通路实现其促进细胞存活的作用也是通过对其下游的凋亡相关蛋白进行调节并借以发挥一系列重要的生物学效应。有研究发现PI3K/Akt/Bad、PI3K/Akt / Bcl-2信号传导通路在细胞凋亡中发挥一定的保护作用[15~17],应用PI3K 抑制剂LY294002可以阻止由于增加磷酸化Akt水平而发挥的保护作用[18,19]。在本次实验中我们也进行了更加深入的研究,从反证的角度进一步观察在PTZ致痫SE大鼠模型中rHuEpo是否经PI3K/Akt通路,对线粒体凋亡途径相关调控因子Bcl-2和Bad实施调控,进而发挥神经保护作用。我们应用PI3K抑制剂LY294002进行阻断,本实验结果提示给予LY294002实施阻断,rHuEpo的保护作用被明显减弱,LY294002干预组与rHuEpo组相比较,痫样放电频率、海马神经元凋亡细胞数目都有明显增加,在免疫组织化学和Western blot的试验结果中显示p-Akt和Bcl-2阳性细胞的数量以及Bcl-2 mRNA和蛋白的表达也明显降低,同时Bad阳性细胞的数量以及Bad mRNA和蛋白的表达上调,更有力的证实了rHuEpo可以提高Akt的活性,激活PI3K/Akt信号传导途径,进而对线粒体凋亡途径中的Bcl-2和Bad进行调节,借以发挥抗凋亡的神经保护作用。
本研究仍存在一定的局限之处:未进行多时间点的大样本量的观察,信号通路之间交叉串联,错综复杂,PI3K/Akt通路并不是Epo的唯一信号通路,它与其他通路之间是如何进行“cross talk”,实现神经保护作用的问题,我们正在进行着更为深入的研究。综上所述,Epo发挥促神经元存活的作用机制是通过PI3K/Akt通路对线粒体凋亡途径的相关因子Bcl-2和Bad进行调控,来实现抗凋亡的重要作用。Epo及氨甲酰化Epo的研究也正在进行,以盼为寻找有效可行的治疗癫痫的神经保护剂提供重要的实验室依据。
[参考文献]
[1]Wang C,Xie N,Wang Y,et al. Role of the Mitochondrial Calcium Uniporter in Rat Hippocampal Neuronal Death After Pilocarpine-Induced Status Epilepticus[J]. Neurochem Res,2015,40(8):1739-1746.
[2]Buckmaster PS,Wen X,Toyoda I,et al. Hippocampal neuropathology of domoic acid-induced epilepsy in California sea lions (Zalophuscalifornianus) [J]. J Comp Neurol,2014,522(7):1691-1706.
[3]Wassink G,Davidson JO,Dhillon SK,et al. Partial white and grey matter protection with prolonged infusion of recombinant human erythropoietin after asphyxia in preterm fetal sheep[J]. J Cereb Blood Flow Metab,2017,37(3):1080-1094.
[4]Wang M,Yan W,Liu Y,et al. Erythropoietin ameliorates diabetes-associated cognitive dysfunction in vitro and in vivo[J]. Sci Rep,2017,7(1):2801.
[5]Vinberg M,Miskowiak K,Hoejman P,et al. The Effect of Recombinant Erythropoietin on Plasma Brain Derived Neurotrophic Factor Levels in Patients with Affective Disorders:A Randomised Controlled Study[J]. PLoS One,2015,10(5):e0127629.
[6]Bahcekapili N,Akgun-Dar K,Albeniz I,et al. Erythropoietin pretreatment suppresses seizures and prevents the increase in inflammatory mediators during pentylenetetrazole-induced generalized seizures[J]. Int J Neurosci,2014,124(10):762-770.
[7]Ugurluer G,Cebi A,Mert H,et al. Neuroprotective effects of erythropoietin against oxidant injury following brain irradiation:an experimental study[J]. Arch Med Sci,2016,12(6):1348-1353.
[8]Liu J,Si Z,Li S,et al. The Calcineurin Inhibitor FK506 Prevents Cognitive Impairment by Inhibiting Reactive Astrogliosis in Pilocarpine-Induced Status Epilepticus Rats[J]. Front Cell Neurosci,2017,11:428.
[9]Mikati MA,Abi-Habib RJ,El Sabban ME,et al. Hippocampal programmed cell death after status epilepticus:evidence for NMDA-receptor and ceramide-mediated mechanisms[J]. Epilepsia,2003,44:282-291.
[10]Henshall DC,ArakiT,Schindler CK,et al. Activation of Bcl-2-associated death protein and counter-response of Akt within cell populations during seizure-induced neuronal death [J]. J Neurosci,2002,22(19):8458-8465.
[11]Melhr R,Sehindler CK,Chu XP,et al. Seizure-like activity leads to the release of BAD from 14-3-3 protein and cell death in hippocampal neurons invitro[J]. Cell Death Differ,2003,10(5):539-547.
[12]GencS,Koroglu TF,Genc K,et al. Erythropoietin as a novel neuroprotectant [J]. RestorNeurol Neurosci,2004,22(2):105-119.
[13]Li H,Kang T,Qi B,et al. Neuroprotective effects of ginseng protein on PI3K/Akt signaling pathway in the hippocampus of D-galactose/AlCl3 inducing rats model of Alzheimer’s disease[J]. J Ethnopharmacol,2016,179:162-169.
[14]Uzum G,SarperDiler A,Bahcekapili N,et al. Erythropoietin prevents the increase in blood-brain barrier permeability during pentylentetrazol induced seizures[J]. Life Sci,2006,78(22):2571-2576.
[15]Fu Z,Yang J,Wei Y,et al. Effects of piceatannol and pterostilbene against β-amyloid-induced apoptosis on the PI3K/Akt/Bad signaling pathway in PC12 cells[J]. Food & Function,2016,7(2):1014-1023.
[16]Wang CH,Wang ZH,Zhang XJ,et al. Protection by silibinin against experimental ischemic stroke:up-regulated pAkt,pmTOR,HIF-1α and Bcl-2,down-regulated Bax,NF-κB expression[J]. Neurosci Lett,2012,529(1):45-50.
[17]Miao J,Wang L,Zhang X,et al. Protective Effect of Aliskiren in Experimental Ischemic Stroke:Up-Regulated p-PI3K,p-AKT,Bcl-2 Expression,Attenuated Bax Expression[J]. Neurochem Res,2016,41(9):2300-2310.
[18]Kong J,Ren G,Jia N,et al. Effects of nicorandil in neuroprotective activation of PI3K/AKT pathways in a cellular model of Alzheimer’s disease[J]. Eur Neurol,2013,70(3/4):233-241.
[19]Xiao Z,Peng J,Yang L,et al. Interleukin-1β plays a role in the pathogenesis of mesial temporal lobe epilepsy through the PI3K/Akt/mTOR signaling pathway in hippocampal neurons[J]. J Neu-roimmunol,2015,282:110-117.
