通腑泻肺方对ALI/ARDS大鼠AQP1/a-ENaC表达的影响
2018-06-20苏景深刘恩顺赵鑫民陈善夫
廉 富,苏景深,刘恩顺,郑 莉,赵鑫民,陈善夫
急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)是一种炎症反应,多种炎症介质和细胞因子参与发病,失控的炎症反应损伤肺泡毛细血管内皮细胞和肺泡上皮细胞,导致肺水清除能力下降,肺含水量增加,形成肺水肿,气体交换障碍,从而导致严重低氧血症[1]。水通道蛋白(AQPs)是一组在哺乳动物体内表达的水选择通道的分子家族,可以增强浆膜面水通透力的功能,因而可以提供快速液体转运的通路[2]。肺上皮细胞钠通道(ENaC)由α、β和γ 3个亚型组成,广泛分布于肺Ⅰ型[3]和Ⅱ型[4]上皮细胞,是肺泡腔水肿液清除(AFC)的关键作用环节。本研究探讨了内毒素(LPS)诱导的急性肺损伤大鼠模型中AQP1和a-ENaC蛋白的表达调节及通腑泻肺中药干预的作用。
1 材料
1.1 动物 健康SD大鼠27只,雄性,体质量(200±20)g,购自北京维通利华实验动物技术有限公司(许可证号:SCXX(京)2012-0001),购入后置天津工程所实验中心常规饲养。
1.2 药物及试剂 通腑泻肺方(葶苈子、桑白皮、大黄、枳实、厚朴)中药颗粒剂,购自天津中医药大学第二附属医院药房。大肠杆菌内毒素脂多糖购自Sigma公司。AQP1抗体购自Abcam公司,批号:Ab11025;a-ENaC抗体购自Proteintech公司,10924-2-AP。免疫组化试剂盒购自北京中杉金桥生物公司。
2 方法
2.1 ALI/ARDS模型的建立及分组给药 动物购入后适应性饲养1周,将大鼠按体质量随机分为空白组、模型组、中药组,每组9只。模型组与中药组于左侧尾静脉注射内毒素8 mg/kg,复制ALI/ARDS模型。正常对照组大鼠静脉注射生理盐水。对照组与模型组在造模完成后即用生理盐水灌服,每次0.01 mL/g。治疗组在造模完成后给予通腑泻肺中药灌胃,每次0.01 mL/g,每日1次,共7 d。
2.2 镜下观察 给药1周后,取右肺下叶,应用10%甲醛溶液进行固定,常规石蜡切片,进行苏木精-伊红(HE)染色检测。光镜下观察,比较分析各组大鼠肺组织病理学改变。
2.3 免疫组化染色方法检测检测肺组织AQP1和a-ENaC的表达 将组织切片行脱蜡、水化处理后,高压修复抗原,用3%过氧化氢溶液消除内源性过氧化酶,血清封闭后各组切片分别加入兔源性AQP-1、a-ENaC多克隆抗体(均为1∶100稀释),4℃过夜后加入兔二抗,经二氨基联苯胺(DAB)显色,光镜下观察。AQP-1、a-ENaC的阳性反应产物均呈棕黄色。光学显微镜下随机观察5个视野、拍照,代表该动物肺组织AQP-1、a-ENaC的蛋白表达强度。应用Image-Pro Plus6.0软件分析阳性细胞数,同时将空白对照组阳性细胞率设置为100%,计算其他组别的阳性细胞率,并对结果进行统计分析。
2.4 统计学方法 采用SPSS 19.0统计软件包进行统计分析,数据以均数±标准差(x±s)表示。多组比较用单因素方差分析,组间两两比较采用Newman-Keuls检验,P<0.05为差异具有统计学意义。
3 结果
3.1 肺组织病理学表现 空白组大鼠肺组织光镜下可见大部分肺泡结构正常、充盈良好,无肺泡萎陷;少部分肺泡间隔增宽、充血、少量淋巴细胞浸润,未见肺泡萎陷;灶性肺间质、细支气管周少量淋巴细胞浸润。模型组大鼠肺组织光镜下可见广泛肺泡萎陷,肺泡间隔增宽、充血、较多淋巴、中性粒细胞、巨噬细胞浸润,局部呈实性。部分肺泡腔可见少量红细胞、淋巴、中性粒及巨噬细胞渗出;部分细支气管及终末细支气管周可见大量淋巴细胞浸润、淋巴组织增生。中药组大鼠肺组织镜下大部分肺泡结构正常、充盈良好,无肺泡萎陷;部分肺泡间隔增宽、充血、纤维组织增生,较多淋巴细胞为主的炎细胞浸润,可见肺泡萎陷;偶见细支气管周灶性淋巴细胞浸润,见图1。
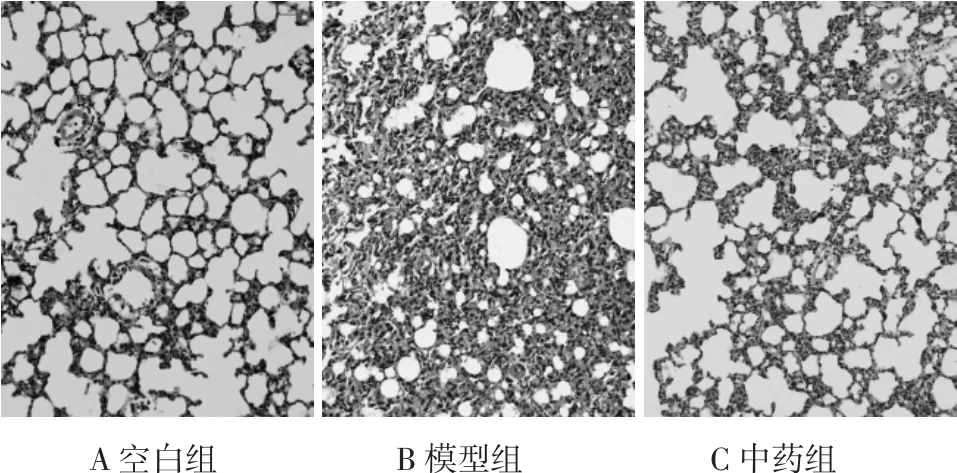
图1 大鼠肺组织形态学改变(SP,×100)Fig.1 Histology changes of lung in rats(SP,×100)
3.2 AQP1和a-ENaC在肺组织的分布及表达情况 空白组大鼠肺组织中AQP1和a-ENaC均呈高水平表达,AQP1主要分布在肺组织微血管的内皮细胞膜,以及少部分分布在肺上皮细胞膜,见图2。a-ENaC主要分布在肺泡细胞膜,见图3。与空白组比较,模型组可见 AQP1 表达显著下降(P<0.01);中药组经过治疗干预后,AQP1表达增强,差异具有统计学意义(P<0.05)。与空白组比较,模型组可见a-ENaC 表达显著下降(P<0.01);中药组经过治疗干预后,a-ENaC 表达增强,差异具有统计学意义(P<0.01)。见表1。

图2 AQP1在肺组织的分布与表达(SP,×400)Fig.2 Distribution and expression of AQP1 in lung tissue(SP,×400)
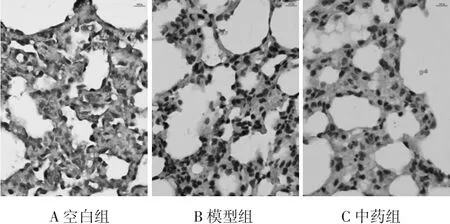
图3 a-ENaC在肺组织的分布及表达(SP,×400)Fig.3 Distribution and expression of a-ENaC in lung tissue(SP,×400)
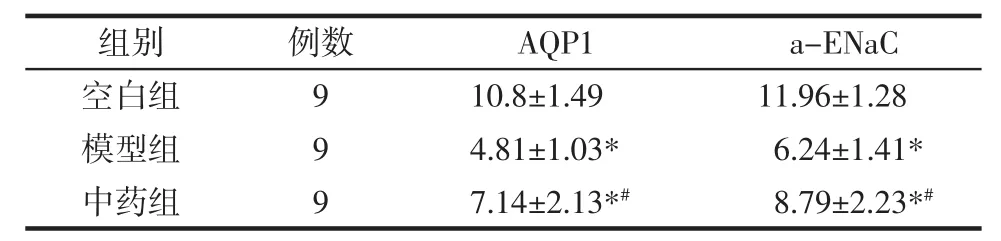
表1 大鼠肺组织AQP-1、a-ENaC免疫组织化学表达的平均光密度值(x±s)Tab.1 The mean optical density of AQP-1 and a-ENaC in lung tissue of rats(x±s)
4 讨论
ALI/ARDS状态下肺微血管的通透性增高,肺泡上皮受损,导致大量血管内液渗透到肺间质及肺泡内,引起肺泡内及肺间质大量肺水形成的高通透性水肿[5]。研究发现的AQPs包括AQP 0~12共13种亚型。其中,AQP-1主要分布于微血管内皮细胞、支气管周围血管床、气管黏膜、淋巴管、胸膜和Ⅱ型肺泡上皮细胞[6]。敲除AQP1基因的小鼠肺泡毛细血管通透性较野生型发生显著改变,肺泡毛细血管膜屏障通透性下降10倍左右[7]。ENaC通过主动吸收肺泡腔内的钠离子实现的肺泡液体吸收主要途径,是肺水肿清除的决定因素[8]。ENaC主动转运将肺泡腔内的钠离子转运入肺泡Ⅱ型细胞内,随后位于基底膜的钠/钾ATP酶再将钠离子转运至肺间质,其中主动转运为肺水肿液清除提供了源动力,将肺水肿液体继发性主动转运至间质,并通过静脉和淋巴回流,从而减轻肺水肿。整个转运过程中90%的跨膜转运阻力存在于ENaC中,因此ENaC是肺泡腔内钠水重吸收的限速步骤[9]。a-ENaC基因敲除小鼠因肺水肿液清除能力低下而在出生后死于ARDS[10]。
通腑泻肺方药源自中医学“肺与大肠相表里”理论,肺与大肠通过经脉相连,两者在生理功能上相互协调,而在发生病理变化时又相互影响。通腑用小承气汤,方中大黄具有破积聚、荡涤胃肠等功效。厚朴行气散满,枳实破气消痞,诸药合用,可以轻下热结,除满消痞。泻肺用葶苈子,性大寒,味辛、苦,归肺、膀胱经,功能泻肺平喘,行水消肿;桑白皮,甘寒入肺,功能泻肺平喘,利水消肿。上述两者合用为通腑泻肺方,既可泻肺平喘,又能通腑泻热,肺肠同治。前期研究发现通腑泻肺方可以明显减轻ALI/ARDS大鼠炎症因子水平的表达,减轻肺部的炎症反应[11-12]。
实验结果发现,通腑泻肺中药组肺组织病理损伤减轻,免疫组化方法检测发现其可上调肺组织AQP1和a-ENaC表达。提示通腑泻肺中药减轻ALI/ARDS大鼠肺水肿的机制可能在于其提高AQP1和a-ENaC表达,促进肺水肿的吸收,为临床治疗提供了新思路。
[1]Huang B,Wang DX,Deng W.Protective effects of dexamethasoneon early acute lung injury induced by oleic acid in rats[J].Int J Clin ExpMed,2014,7(12):4698-4709.
[2] Borgnia M,Nielsen S,Engel A,et al.Cellular and molecularbiology of the Aquaporin water channel[J].Annu RevBiochem,1999,68:425-458.
[3] Borok Z,Liebler JM,Lubman RL,et al.Na transportproteins are expressed by rat alveolar epithelial type I cells[J].Am J Physiol Lung Cell Mol Physio,2002,282(4):L599-L608.
[4] Talbot CL,Bosworth DG,Briley EL,et al. Quantitationand localization of ENa C subunit expression in fetal,new-born,and adultmouselung[J].AmJRespirCellMolBi-ol,1999,20(3):398-406.
[5] Johnson ER,Matthay MA.Acute lung injury:epi-demiology,pathogenesis,and treatment[J].J Aerosol MedPulm Drug Deliv,2010,23(4):243.
[6] Ablimit A,Hasan B,Lu W,et al.Changes in waterchannel aquaporin 1 and aquaporin 5 in the smallairways and the alveoli in a rat asthma model[J].Micron,2013,45:68-73.
[7] Bai C,Fukuda N,Song Y,et al.Lung fluid transport in aquapor-in-1 and aquaporin-4 knockout mice[J].J Clin Invest,1999,103(4):555-561.
[8] Matalon S,O’Brodovich H.Sodium channels in alveolarepithelial cells: molecular characterization, biophysicalproperties,and physiological significance[J].Annu RevPhysiol,1999,61:627-661.
[9] Chen HI,Yeh DY,Liou HL,et al.Insulin attenuates endotoxininduced acute lung injury in conscious rats[J].Crit Care Med.2006,34(3):758-764.
[10]Hummler E,Barker P,Gatzy J,et al.Early death due todefective neonatal lung liquid clearance in alpha-ENa C-de-ficient mice[J].Nat Genet,1996,12(3):325-328.
[11]杨英伟,刘恩顺.急性肺损伤/急性呼吸窘迫综合征中医病因病机及辨证分型的研究进展[J].辽宁中医杂志,2013,56(9):1937-1939.
[12]刘恩顺,孙增涛,苏景深,等.急性肺损伤/急性呼吸窘迫综合征肺肠相关证候特征及其演变的临床调查[J].中华中医药杂志,2013,28(10):3125-3127.
