基于谷胱甘肽结合作用定量研究微囊藻毒素的解毒代谢机制
2018-06-19陈芳梅陈隽谢平李伟于源华张晓韩雪荣于欣冉
陈芳梅,陈隽,谢平,李伟,*,于源华,张晓,韩雪荣,于欣冉
1. 长春理工大学生命科学技术学院,长春130022 2. 中国科学院水生生物研究所,武汉430072
微囊藻毒素(microcystin, MC)是由蓝藻水华产生的环肽类毒素,广泛分布于世界各地的富营养化淡水水体中[1-2]。MC主要作为肝毒素,可以通过抑制蛋白磷酸酶1和2A(PP1和PP 2A)上的丝氨酸、苏氨酸造成严重的肝脏损伤。目前,已报道的MC的异构体有100多种。在中国MCRR广泛分布于淡水湖泊及水产品中,如太湖、巢湖等均有MCRR的检出[3-5]。MC可以直接污染饮用水源,对水生生物、陆生动物甚至人类健康造成严重的威胁。面对MC造成的毒性压力,亟需进一步深入探讨机体内存在的MC解毒代谢机制。
外源性物质(药物或毒物)在机体内的生物转化主要是通过Ⅰ相代谢反应、Ⅱ相代谢反应及在此基础上进一步的处理、降解和排泄。大量研究表明,在Ⅱ相代谢反应中,内源性物质谷胱甘肽(GSH)在MC的解毒代谢过程中发挥着重要作用。Hermansky等[6]报道GSH预处理能够降低MC对小鼠的毒性损伤。Pflugmacher等[7]通过基质辅助激光解吸电离时间飞行质谱(LC-MALID-TOF)发现在水生动物体内MCLR经谷胱甘肽-S-转移酶催化与GSH结合,形成中间代谢物MCLR-GSH,继而进一步代谢为水溶性更强的MCLR-Cys。Takenaka等[8]也通过体外实验证实了MC可以通过大鼠肝细胞液和微粒体内的GST酶催化形成MC的谷胱甘肽结合物。同时,利用免疫染色的方法Ito等[9]调查了MCLR及其谷胱甘肽结合物在小鼠体内的分布。以上这些研究定性探讨了MC在机体内的Ⅱ相代谢反应过程及相应的代谢产物。
运用多级质谱技术(LC-MS/MS),正离子模式下对MC及代谢物(MC-GSH、MC-Cys)一级质谱全扫描,确定化合物母离子后进行二级质谱扫描获得该化合物的特征碎片离子,实现动物样品中MC、MC-GSH及MC-Cys的同时定量分析[10]。,鲢鱼、鳙鱼等水生动物体内3种物质MC、MC-GSH及MC-Cys定量分析,MC-GSH的浓度在检测限附近,其浓度远低于下游代谢物MC-Cys[11-12]。中间代谢物MC-GSH在组织内累积分布的缺失,掩盖了代谢物MC-GSH向下游代谢转化的动力学特征,使得MC的谷胱甘肽解毒机制的深入研究更加困难。因此,本研究试图截断谷胱甘肽解毒途径,直接、定向地探讨MC-GSH向下游代谢转化的动力学特征。通过人工合成MCRR的代谢物MCRR-GSH,将该代谢物直接染毒鲫鱼和大鼠,利用液相色谱串联质谱技术定量分析MCRR-GSH在各组织内的累积分布与代谢转化,深入探讨动物体内MC的解毒代谢过程与机制。此外,本研究将从谷胱甘肽解毒的视角为解释微囊藻毒素对不同动物存在毒性差异提供理论依据,在实践上对饮用水和水产品安全标准的制定及指导生物体的现场解毒提供参考。
1 材料与方法(Materials and methods)
1.1 微囊藻毒素及代谢物
微囊藻毒素-RR(MCRR)标准品购自Alexis公司,藻粉来源于云南滇池表面水华蓝藻,经干燥、粉碎后,置于-20 ℃冰箱中保存。经甲醇提取、ODS柱富集分离及半制备液相色谱仪分离纯化,制备的MCRR的纯度大于95%[7]。
L-GSH、L-Cys购自Acros Organics公司,MCRR-GSH和MCRR-Cys的合成方法参考Wu等[10](2010) 和Li等[13](2014),合成步骤如下:MCRR与L-GSH/Cys在5% K2CO3水溶液中室温下反应2 h,反应完全后稀盐酸中和至中性,然后经C18小柱富集分离、半制备液相色谱分离纯化,制备的MCRR-GSH及MCRR-Cys结合产物纯度均大于95%。
1.2 实验动物
SD大鼠(7~8周,雄性,体重190~210 g)及大鼠常规饲料购自且大鼠饲养于吉林大学动物实验中心,环境条件如下:温度为20~22 ℃,相对湿度为40%~60%,亮暗比为12 h:12 h,。健康的鲫鱼(体重250~310 g)购自长春当地的养殖场,在整个驯养和试验期间,环境条件如下:水温为(20±1) ℃,pH值为6.6~7.8,溶解氧为(8.2±0.8) mg·L-1,亮暗比为12 h:12 h。
1.3 仪器设备与试剂
液相色谱串联质谱(LC-MS,美国Thermo),Waters MCX固相萃取柱(3 cm3·(60 mg)-1, USA),RE-52A型旋转蒸发仪(上海亚荣生化仪器厂),Christ RVC 2 —18离心浓缩仪(德国Martin Christ公司)。甲醇、乙腈及甲酸均为色谱纯,超纯水由Millipore纯水机制备,其他试剂均为分析纯。
1.4 实验动物分组与腹腔注射
SD大鼠驯养7 d后,随机分为实验组和对照组,每组15条,每个时间点设置3个平行样。实验组大鼠腹腔注射MCRR-GSH结合物,剂量1 mg·kg-1体重,对照组腹腔注射同等体积的0.9%生理盐水。戊巴比妥钠作麻醉处理,分别于1、6、24、48、72 h收集肝脏和肾脏组织。
鲫鱼驯养7 d后,随机分为实验组和对照组,每组15条,每个时间点设置3个平行样。实验组鲫鱼腹腔注射MCRR-GSH结合物,剂量1 mg·kg-1体重,对照组腹腔注射同等体积的0.9%生理盐水。鲫鱼快速解剖并于1、6、24、48、72 h收集肝脏、肾脏和胆囊组织。实验中所有组织样品迅速保藏于-80 ℃超低温冰箱以备用。
1.5 动物组织样品的制备与检测
应用冷冻干燥机(Martin Christ,Osterode,Germany)对动物组织样品进行冻干处理。冻干后的组织样品中MCRR-GSH和MCRR-Cys提取与分析参考Wu等[10]和Li等[13]建立的方法。实验步骤如下:冻干样品磨细后,称取样品粉末200 mg,用 5 mL含 0.01 mol EDTA-Na2的5% 乙酸抽提(冰浴超声萃取)3 次,并在12 000 r·min-1下高速离心10 min,重复提取2次,合并以上3次上清液;将萃取的上清液上MCX小柱,该小柱预先用3 mL的纯甲醇活化和3 mL的超纯水平衡,分别用3 mL 2%的甲酸水溶液和90%的甲醇淋洗,最后用 10 mL含15%氨水的甲醇洗脱;洗脱液蒸干,用甲醇再溶转至1.5 mL离心管浓缩蒸干,加入100 μL超纯水定容,离心取上清液用于液相色谱串联质谱法测定。
Surveyor HPLC系统配液相泵、自动进样器、光电二极管检测器、离子阱质谱。流动相分别为含0.05%甲酸水(A)—0.05%甲酸乙腈(B),梯度洗脱程序:0 min (95%A,5%B),1 min(65%A,35%B),17 min(55%A,45%B),17.5 min (30%A,70%B),18 min(5%A,95%B),20 min(5%A,95%B),20.01 min(5%A, 95%B),25 min (5%A,95%B)。流速为0.2 mL·min-1,HPLC进样系统内柱温和样品盘温度分别是40 ℃、10 ℃。液相洗脱液在线转入MS系统,正离子-电喷雾离子化模式,喷针电压4.5 kV,透镜电压45.5 V (MCRR-GSH和MCRR-Cys),毛细管温度均为250 ℃。
1.6 组织病理显微结构的光镜观察
将大鼠肝脏和肾脏组织置于福尔马林缓冲液中固定24 h,依次进行脱水、透明、渗透、石蜡包埋和切片。切片(厚度为4 ~ 5 μm)经苏木精-伊红(H&E)染色,Leica光学显微镜下观察。
1.7 数据处理
实验中所有的结果表示为平均值±标准差(mean ± SD),用SPSS 17.0统计软件进行实验数据的方差分析和组间差异显著性分析。
2 结果(Results)
2.1 MCRR-GSH及其代谢物MCRR-Cys的LC-MS/MS分析
MCRR-GSH及其下游代谢物MCRR-Cys的化学结构表征,以大鼠染毒1 h的肝脏样品的LC-MS/MS检测分析为例,见图1。正离子-电喷雾离子化模式下(ESI),MCRR-GSH在色谱柱上的保留时间是9.71 min,以m/z 673.70的二价分子离子峰[M+2H]2+作为母离子进行二级质谱扫描,相应的特征性子离子分别是:m/z 519.86和m/z 609.08。MCRR-Cys在色谱柱上的保留时间是9.89 min,以m/z 580.00的二价分子离子峰[M+2H]2+作为母离子进行二级质谱扫描,相应的特征性子离子分别是:m/z 519.89和m/z 1008.46。对照组实验动物均未检测到MCRR-GSH及MCRR-Cys。
2.2 MCRR-GSH在鲫鱼肝脏、肾脏及胆汁内的代谢与分布
在鲫鱼肝脏、肾脏及胆汁内MCRR-GSH浓度基本在检测限以上(图2)。在胆汁内,MCRR-GSH的浓度随时间呈现逐渐下降的趋势,并且在暴露1 h时检测到最大值,浓度为(0.226±0.004) μg·g-1DW。同样的,肾脏内MCRR-GSH随时间表现出相同的变化趋势,1 h累积浓度最大值是 (0.161±0.001) μg·g-1DW。然而,肝脏内MCRR-GSH浓度分布随时间变化不大。统计学分析显示:肾脏和胆汁内MCRR-GSH浓度显著高于肝脏(P< 0.05),而肾脏和胆汁内MCRR-GSH浓度无显著差异(P> 0.05)。

图1 大鼠肝脏内MCRR-GSH和MCRR-Cys的LC/MS/MS分析Fig. 1 LC/MS/MS analysis of MCRR-GSH and MCRR-Cys in the liver of rat at 1 h post-injection of MCRR-GSH

图2 MCRR-GSH及其代谢物在鲫鱼肝脏、肾脏和胆汁内的浓度-时间分布曲线Fig. 2 The concentration-time profiles of MCRR-GSH and MCRR-Cys in liver, kidney and bile of crucian carp after i.p. injection of MCRR-GSH
在鲫鱼体内检测到MCRR-GSH的下游代谢物MCRR-Cys。在72 h的暴露实验中,肝脏和胆汁内MCRR-Cys的浓度呈现显著的正相关(r=0.713),MCRR-Cys的浓度随时间逐步上升,72 h时浓度均出现最大值。然而肾脏中MCRR-Cys的浓度一直较高,浓度范围是(0.138±0.014)至(0.247±0.059) μg·g-1DW。肾脏内MCRR-Cys的浓度显著高于肝脏和胆汁内MCRR-Cys的浓度(P< 0.05)。
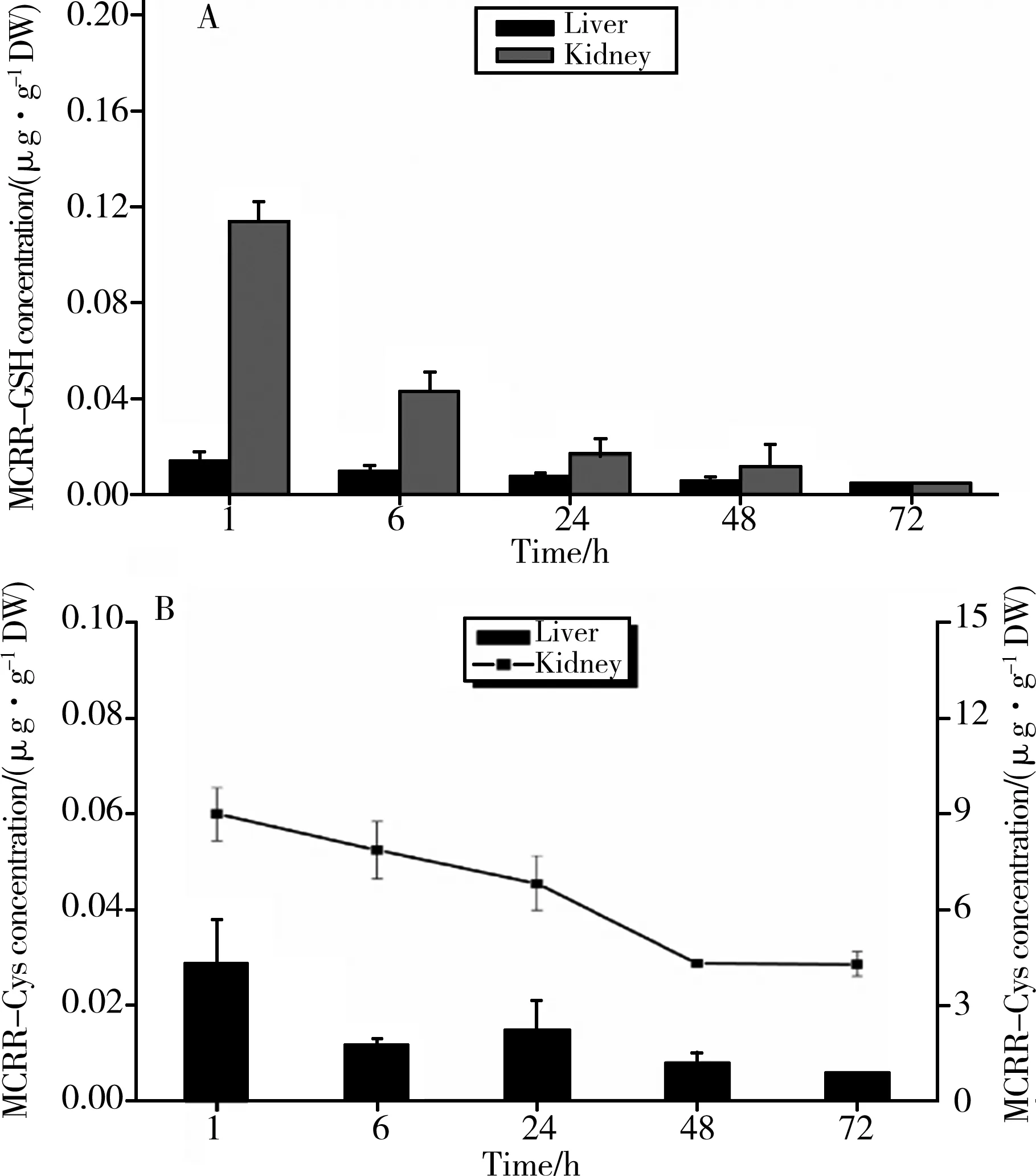
图3 MCRR-GSH及其代谢物在大鼠肝脏和肾脏内的浓度-时间分布曲线Fig. 3 The concentration-time profiles of MCRR-GSH and MCRR-Cys in liver and kidney of rat after i.p. injection of MCRR-GSH
2.3 MCRR-GSH在大鼠肝脏和肾脏内的代谢与分布
大鼠内脏无胆囊器官,本实验对大鼠的肝脏和肾脏组织内的MCRR-GSH和MCRR-Cys这2种物质的浓度进行检测分析,结果如图2所示。
整个72 h的暴露实验中,肝脏内MCRR-GSH的浓度随时间呈缓慢下降的趋势,相邻时间点间的浓度差基本上相同。而在肾脏中,MCRR-GSH的浓度随时间表现出较为剧烈的下降趋势,尤其是在1 h(0.116±0.005 μg·g-1DW)和6 h(0.046±0.005 μg·g-1DW)之间,浓度下降倍数为1.5倍。统计学分析显示肾脏内MCRR-GSH的浓度显著高于肝脏(P< 0.05)。
MCRR-Cys在大鼠组织内积累较高的浓度,如图3B所示。肝脏内MCRR-Cys浓度随时间波动较大,暴露1 h时检测到最大浓度值,然而有下降的趋势。而暴露24 h,MCRR-Cys浓度稍微上升。在肾脏中,MCRR-Cys的浓度变化从(8.899±0.817) μg·g-1DW下降至(3.336±0.263) μg·g-1DW。统计学分析显示肾脏内MCRR-Cys浓度显著高于肝脏(P< 0.05)。
2.4 鲫鱼和大鼠体内MCRR-GSH 代谢对比分析
在肝脏内,鲫鱼体内MCRR-GSH的浓度与大鼠无明显差异;但鲫鱼肾脏内MCRR-GSH的浓度明显高于大鼠肾脏内MCRR-GSH的浓度。实验初期,鲫鱼肝脏内MCRR-Cys的浓度与大鼠相比无明显区别,染毒24 h后,鲫鱼肝脏内MCRR-Cys的浓度显著低于大鼠(P< 0.05);而鲫鱼肾脏内MCRR-Cys的浓度在整个实验中显著低于大鼠(P< 0.05)。

图4 MCRR-GSH腹腔注射24 h的大鼠肝脏和肾脏病理组织切片注:对照组肝脏(A)和肾脏(C),实验组肝脏(B)和肾脏(D)。Fig. 4 Light microscopy (400×) of representative sections of liver and kidney of rat at 24 h post-injection with MCRR-GSHNote: Liver (A) and kidney (C) from control group; liver (B) and kidney (D) from the MCRR-GSH-treated group.
2.5 肝脏和肾脏组织病理学变化
已有研究表明,微囊藻毒素及其代谢物对大鼠的LD50值明显低于鲫鱼。1 mg·kg-1MCRR-GSH的剂量下,与鲫鱼相比,MCRR-GSH对大鼠的毒性作用较大。因此,选择对MCRR-GSH较为敏感的大鼠进行组织病理学观察,肝脏和肾脏的组织病理学结果见图4。与对照组相比,肝脏内未观察到明显的组织变化,如细胞空泡化、细胞核固缩或凋亡等;肾脏内也未观察到明显的组织损伤变化。
3 讨论(Discussion)
本实验中1 mg·kg-1MCRR-GSH的剂量作用下,鲫鱼和大鼠行为正常,并且肝脏和肾脏的组织病理学未观察到明显变化。MCRR-GSH的毒性效应几乎没有影响到谷胱甘肽解毒途径的进行。
已有研究表明,动物体内的谷胱甘肽在MC的解毒过程中发挥着重要作用。在肝脏内谷胱甘肽-S-转移酶(GST)的作用下GSH与MC发生迈克尔加成反应生成MC-GSH结合物[7,14]。本实验中,MCRR-GSH经腹腔注射至鲫鱼或大鼠后,在各组织内均定量地检测到该物质,表明MCRR-GSH结合物可以借助动物体内的转运载体(如oatp/OATP超家族)转运至各个组织,尤其是肾脏组织[15-16]。虽然MCRR-GSH的降解物MCRR-Cys在各组织内均有分布,但是肾脏中MCRR-Cys的浓度显著高于肝脏等器官,原因分析如下:1)肾脏内快速地积累了大量的MCRR-GSH结合物;2)MCRR-GSH转化为MCRR-Cys所需的γ-谷氨酰胺转移酶和甘氨酸半胱氨酸二肽酶在肾脏中活性最高[17-18]。
实验初期,鲫鱼和大鼠肾脏内的MCRR-Cys浓度均明显高于肝脏,这一结果定量地证明MCRR-GSH在肾脏内进行代谢转化的速度非常快。肾脏内的代谢物一方面可通过尿液排泄到体外,另一方面通过血液循环转运至其他组织或排泄物中[19]。在鲫鱼实验中,肾脏中MCRR-Cys浓度出现上升下降波动趋势,表明肾脏内MCRR-Cys结合物处于不断产生和输出的动态变化中;而肝脏和胆汁内的MCRR-Cys浓度却呈现出上升的趋势,表明肾脏内产生的MCRR-Cys通过血液循环输送至肝脏和胆囊,肝胆循环很有可能是MC的体外排泄的路径之一。以上研究结果表明,基于谷胱甘肽结合作用MC的解毒代谢过程涉及肝脏和肾脏器官之间的循环合作。
谷胱甘肽对微囊藻毒素的解毒代谢过程推测如下:肝脏内解毒物质GSH经GST酶催化与MC生成中间代谢物MC-GSH,经然后在肾脏内快速转化为下游代谢物MC-Cys,最后随尿液和粪便等排泄物排泄至体外。
本实验中,鲫鱼肾脏内MCRR-GSH的浓度明显高于大鼠,而MCRR-Cys的浓度显著低于大鼠。这一结果表明,经oatp/OATP超家族转运,鲫鱼肾脏内积累大量的中间代谢物MCRR-GSH,然后在γ-谷氨酰胺转移酶和甘氨酸半胱氨酸二肽酶的催化下代谢为MCRR-Cys并迅速输出体外。本实验定量证明了谷胱甘肽解毒途径的重要性,并且鲫鱼体内谷胱甘肽解毒效率明显大于大鼠;同时,从解毒的视角为解释微囊藻毒素对哺乳动物的毒性大于鱼类提供了理论依据。目前,根据已报道的化合物(卤代烷烃、烯烃等)的谷胱甘肽解毒代谢途径[20-22],推测MC-Cys很可能进一步乙酰化生成微囊藻毒素-N-乙酰半胱氨酸结合物,该代谢物的水溶性更强,更易于排泄。因此,对于鲫鱼体内快速排出的MC-Cys能否进一步乙酰化,微囊藻毒素在动物体内最终以何种代谢物的形式排泄至体外等科学问题需要更深入的研究。
通讯作者简介:李伟(1986-),女,博士,讲师,主要研究方向为水生态毒理学。
参考文献(References):
[1] 周伦, 鱼达, 余海, 等. 饮用水源中的微囊藻毒素与大肠癌发病的关系[J]. 中华预防医学杂志, 2000, 34(4): 224-226
Zhou L, Yu D, Yu H, et al. Drinking water types, microcystins and colorectal cancer [J]. Chinese Journal of Preventive Medicine, 2000, 34(4): 224-226 (in Chinese)
[2] 乐亚玲, 刘利平. 微囊藻毒素毒理学的研究进展[J]. 环境与健康杂志, 2011, 28: 553-556
Yue Y L, Liu L P. Progress on toxicological studies on microcystins [J]. Journal of Environment and Health, 2011, 28: 553-556 (in Chinese)
[3] 谢平. 水生动物体内的微囊藻毒素及其对人类健康的潜在威胁[M]. 北京: 科学出版社, 2006: 52
Xie P. Microcystins in Aquatic Animals with Potential Risk to Human Health [M]. Beijing: Science Press, 2006: 52 (in Chinese)
[4] Chen J, Xie P, Li L, et al. First identification of the hepatotoxic microcystins in the serum of a chronically exposed human population together with indication of hepatocellular damage [J]. Toxicology Sciences, 2009, 108: 81-89
[5] Zhang D, Xie P, Chen J, et al. Determination of microcystin-LR and its metabolites in snail (Bellamyaaeruginosa), shrimp (Macrobrachiumnipponensis) and silver carp (Hypophthalmichthysmolitrix) from Lake Taihu, China [J]. Chemosphere, 2009, 76: 974-981
[6] Hermansky S J, Stohs S J, Eldeen Z M, et al. Evaluation of potential chemoprotectants against microcystin-LR hepatotoxicity in mice [J]. Journal of Applied Toxicology, 1991, 11(1): 65-73
[7] Pflugmacher S, Wiegand C, Beattie A. Uptake, effects, and metabolism of cyanobacterial toxins in the emergent reed plantPhragmitesaustralis(Cav.) Trin. ex Steud [J]. Environmental Toxicology and Chemistry, 2001, 20: 846-852
[8] Takenaka S. Covalent glutathione conjugation to cyanobacterial hepatotoxin microcystin LR by F344 rat cytosolic and microsomal glutathione S-transferases [J]. Environmental Toxicology and Pharmacology, 2001, 9: 135-139
[9] Ito E, Takai A, Kondo F, et al.Comparison of protein phosphatase inhibitory activity and apparent toxicity of microcystins and related compounds [J]. Toxicon Official Journal of the International Society on Toxinology, 2002, 40: 1017-1025
[10] Wu L, Xie P, Chen J, et al. Development and validation of a liquid chromatography-tandem mass spectrometry assay for the simultaneous quantitation of microcystin-RR and its metabolites in fish liver [J]. Journal of Chromatography A, 2010, 1217: 1455-1460
[11] Zhang D, Yang Q, Xie P, et al. The role of cysteine conjugation in the detoxification of microcystin-LR in liver of bighead carp (Aristichthysnobilis): A field and laboratory study [J]. Ecotoxicology, 2012, 21: 244-252
[12] He J, Chen J, Xie P, et al. Quantitatively evaluating detoxification of the hepatotoxic microcystins through the glutathione and cysteine pathway in the cyanobacteria-eating bighead carp [J]. Aquatic Toxicology, 2012, 116: 61-68
[13] Li W, Xie P, Chen J, et al. Quantitative liquid chromatography-tandem mass spectrometry method for determination of microcystin-RR and its glutathione and cysteine conjugates in fish plasma and bile [J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2014, 963: 113-118
[14] Li W, Chen J, Xie P, et al. Rapid conversion and reversible conjugation of glutathione detoxification of microcystins in bighead carp (Aristichthysnobilis) [J]. Aquatic Toxicology, 2014, 147: 18-25
[15] Fischer W J, Altheimer S, Cattori V, et al. Organic anion transporting polypeptides expressed in liver and brain mediate uptake of microcystin [J]. Toxicology and Applied Pharmacology, 2005, 203: 257-263
[16] Hagenbuch B, Meier P. The superfamily of organic anion transporting polypeptides [J]. Biochimica et Biophysica Acta (BBA) - Biomembranes, 2003, 1609: 1-18
[17] Kera Y, Liu Z, Matsumoto T, et al. Rat and human membrane dipeptidase: Tissue distribution and developmental changes [J]. Comparative Biochemistry and Physiology B: Biochemistry and Molecular Biology, 1999, 123: 53-58
[18] van Bladeren B. Glutathione conjugation as a bioactivation reaction [J]. Chemical-Biological Interactions, 2000, 129: 61-76
[19] Elfarra A A, Anders M W. Renal processing of glutathione conjugates. Role in nephrotoxicity [J]. Biochemical Pharmacology, 1984, 33: 3729-3732
[20] Tal A, Romano M L, Stephenson G R, et al. Glutathione conjugation: A detoxification pathway for fenoxapro-p-ethyl in barley, crabgrass, oat and wheat [J]. Biochemical Pharmacology, 1993, 46: 190-199
[22] Chen M, Lou Y, Wu Y D, et al. Characterization ofinvivoandinvitrometabolites of furanodiene in rats by high performance liquid chromatography-electrospray ionization mass spectrometry and nuclear magnetic resonance spectra [J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 86: 161-168
