熊去氧胆酸联合扶正化瘀胶囊治疗HBeAg阳性高病毒载量乙肝肝硬化患者的疗效及对肝纤维化和炎性因子的影响
2018-06-19李玉贤张汾燕
李玉贤,张汾燕,崔 振
(1. 北京市海淀医院,北京 100080;2. 北京老年医院,北京 100095;3. 北京邮电大学校医院,北京 100876)
慢性乙型肝炎是消化内科常见的传染性疾病,若患者的HBV DNA≥107拷贝/mL并长期存在可导致病毒持续破坏肝细胞,诱发肝硬化。在肝硬化发病的初期,由于肝脏的代偿功能较强,患者可无典型的临床症状及体征,随着病情进展,疾病的后期可出现肝功能损害、门静脉高压、脾功能亢进、肝性脑病、上消化道出血、腹水等多种并发症[1],严重者还可导致癌变[2],危及患者生命。目前尚无彻底治愈乙肝肝硬化的治疗方法,但早期发现肝硬化,及时控制病情发展对于改善患者预后具有重要临床意义。本研究观察了熊去氧胆酸联合扶正化瘀胶囊治疗HBeAg阳性高病毒载量乙肝肝硬化的疗效及对患者肝纤维化及炎性因子的影响,现报道如下。
1 临床资料
1.1一般资料 选择2014年1月—2015年1月在北京市海淀医院就诊的HBeAg阳性高病毒载量乙型肝硬化患者60例,均根据中华医学会肝病学分会及中华医学会感染病分会制定的《慢性乙型肝炎防治指南》(2010年版)[3]中关于乙肝肝硬化的诊断标准确诊,HBeAg检测阳性,且HBV DNA检测结果均≥107拷贝/mL。排除甲、丙、丁、戊肝等其他肝炎病毒及药物、酒精、自身免疫性肝病、代谢性肝病等因素诱发的肝硬化患者,严重心脑血管疾病患者,结缔组织病、药物性肝炎及精神病患者。随机将60例患者分为观察组30例和对照组30例,2组一般资料比较差异均无统计学意义(P均>0.05),具有可比性,见表1。
1.2治疗方法 对照组患者给予恩替卡韦片(南京正大天晴制药有限公司,国药准字H20120038)0.5 mg/次顿服,熊去氧胆酸片(武汉人福药业有限责任公司,国药准字H20123209)50 mg/次口服,1次/d。观察组在对照组治疗基础上加服扶正化瘀胶囊(上海黄海制药有限责任公司,国药准字Z20020073),3粒/次,3次/d。2组均连续治疗6个月为1个疗程。1个疗程结束后评价疗效。

表1 2组一般资料比较
1.3观察指标 ①采用日立7600全自动生化分析仪检测2组治疗前后ALT、AST、ALB及TBil水平。②采用实时荧光定量PCR法检测2组治疗前后HBV DNA复制水平,比较2组HBV DNA转阴率及HBV DNA下降情况。③采用酶联免疫吸附法检测2组血清乙型肝炎病毒标记物水平,比较2组治疗后ALT复常率及HBeAg转阴率。④采用酶联免疫吸附法检测2组治疗前后肝纤维化指标LN、PCⅢ、HA、Ⅳ-C及炎性因子IL-6、TNF-α、ET水平。
1.4统计学方法 采用SPSS 18.0统计软件进行数据分析。计数资料用率表示,采用2检验;计量资料以表示,采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.12组治疗前后肝功指标比较 治疗后,2组ALT、AST、ALB、TBil水平均显著降低(P均<0.05),且观察组均显著低于对照组(P均<0.05)。见表2。
2.22组治疗后HBV DNA检测情况比较 治疗后,观察组HBV DNA转阴率和HBV DNA下降幅度均显著高于对照组(P均<0.05)。见表3。
2.32组治疗后ATL复常率、HBeAg转阴率情况比较 治疗后,观察组ATL复常率及HBeAg转阴率均显著高于对照组(P均<0.05)。见表4。
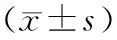
表2 2组治疗前后肝功指标比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
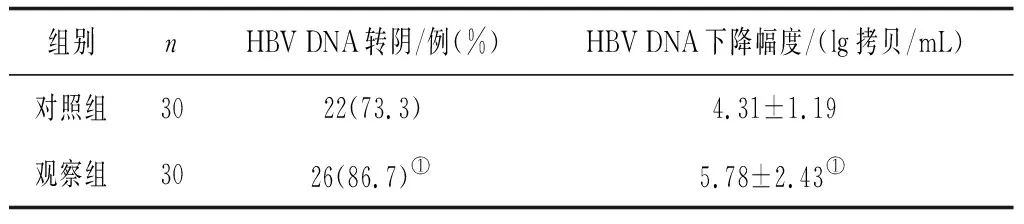
表3 2组治疗后HBV DNA检测情况比较
注:①与对照组比较,P<0.05。

表4 2组治疗后ALT复常率、HBeAg转阴率比较 例(%)
注:①与对照组比较,P<0.05。
2.42组患者治疗前后肝纤维化指标比较 治疗后,2组LN、PCⅢ、HA、Ⅳ-C水平均显著降低(P均<0.05),且观察组均显著低于对照组(P均<0.05)。见表5。
2.52组治疗前后炎性因子水平比较 治疗后,2组IL-6、TNF-α、ET水平均显著降于治疗前(P均<0.05),且观察组均显著低于对照组(P均<0.05)。见表6。
3 讨 论
由于慢性乙肝患者体内乙肝病毒的持续存在,可长期损害肝细胞,导致肝脏组织产生炎症反应,激活并分泌IL-6、TNF-α、ET等多种炎性细胞因子[4-5],参与机体的慢性炎症反应过程,促进了肝星状细胞的增殖、分化,导致LN、PCⅢ、HA、Ⅳ-C等大量细胞外基质的生成增多,降解减少,从而促进纤维化的形成,使肝硬化进程加速[6-7]。目前,临床上多采用拉米夫定、恩替卡韦、阿德福韦酯、干扰素等药物来对早期乙肝肝硬化患者进行抗病毒治疗,虽在一定程度上抑制了乙肝病毒的复制,减轻了持续的炎性损伤,但无法改变已形成的肝纤维化病理改变,只能延缓肝纤维化的进程[8-9]。因此,乙肝肝硬化治疗除了积极的抗病毒治疗,延缓病毒对肝细胞的炎性损伤、保护肝细胞外,还应积极地寻找逆转或阻止肝纤维化进程的最佳疗法。

表5 2组治疗前后肝纤维化指标水平比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
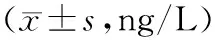
表6 2组治疗前后炎性因子水平比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
熊去氧胆酸具有良好的亲水性,可促进胆汁酸池中亲水胆汁酸的转化,加速内源性胆汁酸排泄,从而减轻胆汁淤积症状[10]。同时,其还可通过调控肝细胞的细胞周期代谢、凋亡来减轻肝细胞膜的受损,并具有调节免疫功能的作用[11]。扶正化瘀胶囊是由现代工艺制成的中成药制剂,主要由丹参、发酵虫草菌粉、桃仁、松花粉、绞股蓝、五味子(制)6味中药组成。其中丹参、桃仁活血祛瘀,冬虫夏草补肺滋肾,益气养虚;松花粉益气养肝、滋阴润燥;绞股蓝益气健脾,化痰止咳,清热解毒;五味子滋阴收敛、益阴养肝;全方诸药合用具有活血化瘀、益肾滋阴、养肝解毒的功效。研究表明,扶正化瘀胶囊可显著延缓肝脏纤维化进程,并可抑制炎性因子的持续浸润,保护肝细胞膜免受损伤,加速胶原的重吸收,促进肝功能的恢复,同时还可加速肝内胶原的降解,减轻已形成的肝纤维化[12-15]。
本研究结果显示,治疗后,2组ALT、AST、ALB、TBil、LN、PCⅢ、HA、Ⅳ-C、IL-6、TNF-α、ET水平均显著降低,且观察组治疗后各指标水平均显著低于对照组;观察组患者HBV-DNA转阴率和HBV-DNA下降幅度均显著高于对照组,ATL复常率及HBeAg转阴率均显著高于对照组。说明在抗病毒治疗基础上,扶正化瘀胶囊联合熊去氧胆酸治疗HBeAg阳性高病毒载量乙肝肝硬化患者可有效改善患者肝功能,提高抗病毒疗效,显著改善肝细胞内的炎症反应过程,缓解乙肝病毒对肝细胞的损伤,减少细胞外基质的形成,延缓并减轻肝纤维化进展,值得临床应用探讨。
[参考文献]
[1] 应灵军,陈华忠,张建伟,等. 代偿期乙型肝炎肝硬化患者长期抗病毒治疗后临床特点和肝脏组织学改变[J]. 中华临床感染病杂志,2016,23(1):13-18
[2] 朱锦宏,王春苗,吴茂峰,等. miR-143在乙型肝炎相关肝病患者血清中的表达及意义[J]. 广东医学,2016,37(8):1164-1168
[3] 贾继东,李兰娟. 慢性乙型肝炎防治指南(20l0年版)[J]. 临床肝胆病杂志,2011,27(1):113-128
[4] 刘宁,徐杰,刘金花,等. 慢性乙型肝炎、乙肝肝硬化、乙肝肝癌患者Th1/Th2型细胞因子水平变化研究[J]. 胃肠病学和肝病学杂志,2014,23(2):158-161
[5] 李彩东,杨勇卫,田鹏飞,等. 乙型肝炎肝硬化患者外周血IFN-γ、IL-32和IL-6的临床相关性[J]. 肝脏,2015,20(9):678-680
[6] 焦运,杨安宁,孙岳,等. 乙肝肝硬化患者血清MMP-2、HA、LN和Ⅳ-C的水平及意义[J]. 宁夏医科大学学报,2015,37(11):1286-1288;封2
[7] 林佃相,刘颖翰,石栓柱,等. 恩替卡韦联合复方鳖甲软肝片对代偿期乙肝肝硬化患者肝纤维化程度的影响[J]. 河北医药,2016,38(11):1639-1641
[8] 李磊,刘伟,陈玉涵,等. 不同核苷(酸)类似物抗病毒治疗方案治疗失代偿期乙肝肝硬化的临床研究[J]. 北京医学,2014,36(12):1017-1021
[9] 彭奇,陈华容. 初始联合拉米夫定与阿德福韦酯在乙肝肝硬化治疗中的进展[J]. 胃肠病学和肝病学杂志,2014,23(1):113-116
[10] 周凡,高冰心,王晓东,等. 熊去氧胆酸和S-腺苷蛋氨酸改善妊娠肝内胆汁淤积症结局的系统评价[J]. 中华肝脏病杂志,2014,22(4):299-304
[11] 韩炎炎,戴晓波. 云芝肝泰胶囊辅助熊去氧胆酸片治疗原发性胆汁性肝硬化及对患者免疫学指标的影响[J]. 中国老年学杂志,2015,35(23):6812-6814
[12] 刘春燕,张龙琪. 扶正化瘀胶囊联合阿德福韦酯治疗慢性乙型肝炎的临床疗效和机制研究[J]. 中国全科医学,2015,12(10):1219-1221
[13] 金剑,傅超,张欣怡,等. 阿德福韦酯联合扶正化瘀胶囊治疗慢性乙型肝炎有效性与安全性的Meta分析[J]. 现代中西医结合杂志,2014,23(6):580-582;587
[14] 王传敏,柯昌征,张银华,等. 扶正化瘀胶囊联合阿德福韦酯治疗慢性乙型肝炎的疗效及对免疫功能和肝功能的影响[J]. 现代中西医结合杂志,2015,24(15):1618-1620
[15] 赵长青,徐列明. 扶正化瘀胶囊/片治疗肝纤维化和肝硬化的临床研究进展[J]. 世界中医药,2014,17(5):561-567
