强化肠内营养干预对化疗过程中消化道肿瘤患者营养指标及T淋巴细胞亚群的影响
2018-06-19封育瑾毛春英金辉高静饶骁骏方雪彬
封育瑾,毛春英,金辉,高静,饶骁骏,方雪彬
消化系统肿瘤主要包括食管癌、胃癌及结直肠癌,流行病学报道显示,我国消化道肿瘤发病和死亡人数均呈逐年增高趋势,已成为威胁生命安全主要恶性肿瘤类型之一[1]。消化道肿瘤患者早期多无特异性症状,确诊时往往已进入中晚期,难以实现手术根治切除;化疗是消化道肿瘤临床综合治疗重要组成部分之一,可在一定程度上控制病情进展,但随之而来严重毒副作用易导致生活质量下降[2]。已有研究证实,通过给予科学合理营养支持能够显著降低毒副作用发生风险,提高消化道肿瘤患者化疗耐受度及远期预后[3]。本文以浙江省衢州市人民医院2015年2月至2017年2月收治的消化道肿瘤化疗患者100例作为研究对象,分别给予单纯常规膳食干预和联合强化肠内营养干预,探讨强化肠内营养干预对化疗过程中消化道肿瘤患者营养指标及T淋巴细胞亚群的影响,现将结果报道如下。
1 资料与方法
1.1一般资料 收集本院收治的消化道肿瘤化疗患者100例,按照随机数字表法分为对照组和干预组,每组各 50例。对照组中男33例,女17例;年龄45~ 73 岁,平均(57.38±4.94)岁;TNM 分期:III期29例,IVa期14例,IVb期7例;肿瘤类型:食管癌13例,胃癌20例,结直肠癌17例。干预组中男31例,女19例;年龄43~75岁,平均(57.29±4.95)岁;TNM分期:III期 32 例,IVa期 12 例,IVb期6例;肿瘤类型:食管癌11例,胃癌19例,结直肠癌20例。两组患者一般资料差异无统计学意义(> 0.05)。
纳入标准标准:(1)经病理检查确诊消化道恶性肿瘤;(2)符合TNM分期III~IV期标准[4];(3)年龄 18 ~ 75 岁;(4)方案经医院伦理委员会批准,且患者及家属签署知情同意书。排除免疫系统疾病、代谢性疾病、其他系统恶性肿瘤、心脑肝肾功能障碍、血液系统疾病、精神系统疾病及临床资料不全的患者。
1.2方法 对照组患者给予单纯常规膳食干预,即由营养科根据病情和营养状态制定热量摄入目标,保证患者总热量摄入达125.58~146.51kJ·kg-1·d-1;干预组患者则在此基础上与强化肠内营养干预联用,即加用口服整蛋白型营养液(立适康、西安立邦临床营养有限公司生产)成分有:麦芽糊精、酪蛋白、乳清蛋白、大豆分离高蛋白、中链三酰甘油、膳食纤维、谷氨酰胺、复合维生素和矿物质。每次规格250m l(4.186kJ/m l),3次/d。两组干预时间均为4周。
1.3观察指标 (1)营养指标检测仪器采用瑞士Roche公司生产COBASC311型全自动生化分析仪,主要包括转铁蛋白、血清白蛋白及血清前白蛋白;(2)T淋巴细胞亚群检测采用美国BD公司生产FACS Aria II型分选式流式细胞仪,主要包括 CD3+、CD4+及 CD4+/CD8+;(3)采用WHO抗癌药物毒性分度标准进行血液学毒副作用判定,记录I~IV度例数,计算百分比[4]。
1.4统计方法 采用SPSS20.0统计软件进行统计学分析。计量资料采用均数±标准差表示,采用 检验;计数资料采用2检验。<0.05为差异有统计学意义。
2 结果
2.1两组干预前后转铁蛋白、血清白蛋白及血清前白蛋白水平比较 两组干预前转铁蛋白、血清白蛋白及血清前白蛋白水平组间比较差异均无统计学意义(>0.05);干预组患者干预后转铁蛋白、血清白蛋白及血清前白蛋白水平均显著高于对照组(均<0.05)。见表1。
2.2两组干预前后CD4+、CD8+及CD4+/CD8+水平比较 两组干预前 CD3+、CD4+及CD4+/CD8+水平差异均无统计学意义(均>0.05),干预组患者干预后CD3+、CD4+及 CD4+/CD8+水平均显著优于对照组(均<0.05)。见表2。
2.3两组血液学毒副作用发生率比较对照组I~II度血液学毒副作用发生率为38.00%、III~IV度血液学毒副作用发生率为 30.00%;干预组分别为34.00%和6.00%。两组I~II度血液学毒副作用发生率比较差异无统计学意义(2=1.48,>0.05);干预组患者III~IV度血液学毒副作用发生率显著低于对照组(2=7.26,均< 0.05)。
3 讨论
消化道肿瘤患者因病变位置原因较其他系统恶性肿瘤对于进食及消化吸收能力影响更为明显,而病变及临床治疗则进一步加重机体消耗,营养不良或免疫功能异常问题多发,相当一部分患者难以耐受[5]。多项临床研究证实,肠内营养支持用于消化道肿瘤患者能够有效改善机体营养状态,调节细胞免疫功能[6]。本次研究所用肠内营养乳剂(TPF-T)内含谷氨酰胺、精氨酸及 -3多不饱和脂肪酸在内多种免疫调节剂,可有效补充花生四烯酸,下调前列腺素E2、I2等免疫抑制物质合成[7-8];而加用精氨酸则具有调节机体氮平衡、炎性细胞因子活性及NO水平等作用[9-10]。
消化道肿瘤患者化疗过程中营养不良发生率可达15%~30%,主要表现为血清蛋白质水平下降[11]。本文结果显示两组干预前后转铁蛋白、血清白蛋白及血清前白蛋白水平组间比较差异均无统计学意义(均>0.05);干预组患者干预后转铁蛋白、血清白蛋白及血清前白蛋白水平均显著高于对照组(均<0.05),这表明化疗消化道肿瘤患者行强化肠内营养干预在上调血清蛋白质水平和促进营养状态恢复方面具有优势。

表1 两组干预前后转铁蛋白、血清白蛋白及血清前白蛋白水平比较 g/L
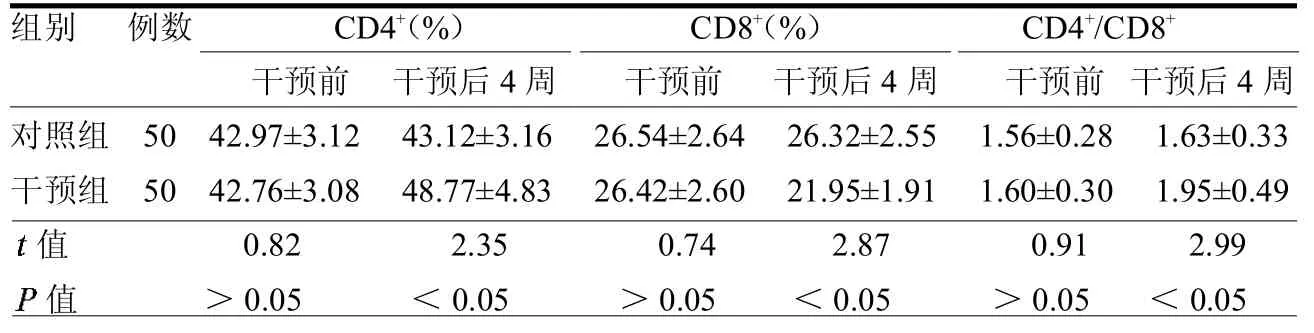
表2 两组干预前后CD4+、CD8+及CD4+/CD8+水平比较
消化道肿瘤患者因机体处于异常应激状态,分解代谢加重,必需氨基酸合成水平降低,进而对免疫细胞功能产生不利影响[12]。已有研究显示,消化道肿瘤患者免疫功能下降主要表现为Th淋巴细胞水平减少,Ts淋巴细胞亚群水平上升[13]。本文结果证实强化肠内营养干预可有效提高消化道肿瘤患者细胞免疫功能,增强化疗耐受性。
血液学毒性是消化道肿瘤患者主要化疗主要毒副作用之一;而肠内营养支持已被大量临床报道证实可显著减轻骨髓抑制反应,延长化疗时间[14]。本文结果说明强化肠内营养干预应用在避免消化道恶性肿瘤患者化疗血液学严重毒副作用,提高治疗安全性方面具有优势。
