抑郁症对大鼠骨折愈合的影响的实验研究
2018-06-17付至江刘宗超张华文刘世贵黄陈翼高海明
付至江 高 云 张 伟 刘宗超, 张华文 刘世贵 黄陈翼 高 银 高海明
1.西南医科大学附属中医医院骨科,泸州,646000,中国
2.西南医科大学人体解剖学教研室,泸州,646000,中国
3.西南医科大学附属医院核医学科、核医学与分子影像四川省重点实验室,泸州,646000,中国
4.西南医科大学司法鉴定中心,泸州,646000,中国
5.西南医科大学附属中医医院影像科,泸州,646000,中国
随着生活节奏的逐步加快,精神压力的逐渐增加,抑郁症(depression)的发病率逐年升高,有研究证实普通人群的患病率高达20%。抑郁症是一种危害健康且容易复发的心理障碍,给患者的心理和生理健康带来严重的伤害[1-2]。研究表明抑郁症会对人的消化、免疫及神经系统等机能产生影响,甚至会造成严重的损伤[3]。就骨代谢方面,抑郁症患者的骨形成代谢指标与骨吸收代谢指标较正常人均有显著改变,容易导致骨质疏松[4],但抑郁症是否会影响骨折愈合,通过何种机制影响骨折愈合,尚无文献报道。
抑郁症患者由于精神压力导致全身各分泌系统异常,进而影响骨折愈合所需的细胞及介质,而必然会影响骨折愈合。本课题前期研究结果表明抑郁症患者骨折愈合时间明显较无抑郁症同类别患者延缓。因此,科学的假设抑郁症患者在骨折愈合过程中存在一些机制导致骨折愈合与正常愈合差异。本课题建立抑郁症和正常大鼠胫骨中上1/3骨折模型,通过观察大鼠血清钙、磷、碱性磷酸酶(Ca、P、ALP)浓度,胫骨DR骨痂量,HE染色,胫骨三点弯曲实验,Micro-CT骨痂体积等指标,探讨抑郁症影响大鼠骨折愈合的现象,进一步探索抑郁症延缓骨折愈合的机制,为临床抑郁症患者的骨折治疗提供新的思路及方法。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
8月龄SD大鼠300只,♀,清洁级,体质量(242.6±11.2) g,实验动物使用许可证号:SYXK(川)2013-065,由西南医科大学动物实验中心提供。
1.1.2 实验试剂
Ca、P、ALP测定试剂盒,购自迈瑞医疗;注射用青霉素钠,批号:B170413,购自鲁抗制药股份有限公司;水合氯醛,购自上海凛恩科技发展有限公司。
1.1.3 实验仪器
AG-1S型电子万能力学实验机,日本岛津制作所;BS生化分析仪,迈瑞医疗;数字化X射线影像(digital X-ray image,DR),西门子;Micro PET-CT,西门子。
1.2 实验方法
1.2.1 实验分组
将大鼠首先进行蔗糖水偏好实验(sucrose preference test)和旷场实验(open field test),得到行为学评分,从中筛选出得分均一的大鼠220只,将大鼠随机分为手术对照组(A组)100只,假手术组(B组)20只和抑郁症组(C组)100只。C组采用孤笼结合饲养,每天给予1种刺激,总周期28 d。A、B组保持在正常饲养条件下,每笼4只,不遭受任何刺激。
1.2.2 抑郁症动物模型构建
大鼠100只,分为5组,每组20只,抑郁症动物给予不可预知的慢性应激性刺激。第一组:强迫游泳30 min·d-1,可调节电击器电击足底,共30次;第二组:4℃冰水游泳5 min,电吹风45℃热刺激5 min;第三组:血管钳夹尾1 min,锯尾根,禁水禁食12 h;第四组:昼夜颠倒,白天用黑色遮光布盖住鼠笼,夜里用200 W白炽灯照射,一灯六笼,每天摇晃鼠笼5次,每次5 min;第五组:潮湿垫料,每天倾斜鼠笼12 h。每组大鼠每天随机以上五组刺激,针对同一组大鼠的相同刺激间隔时间≥48 h。刺激后每周行抑郁症评价测试,包括蔗糖水偏好实验、旷场实验。
1.2.3 蔗糖水偏好实验
实验前对大鼠进行适应蔗糖水训练,每笼同时放置2个水瓶,第1个24 h,2瓶均盛1%蔗糖水。第二个24 h,一个瓶盛l%蔗糖水,另一个瓶盛纯水。随后对大鼠禁食、水24 h,每只大鼠给予已称量好的2瓶水,一瓶1%蔗糖水,一瓶纯水。1 h后,取2瓶水称量。每周1次。

1.2.4 旷场实验
将动物置入80 cm×80 cm×40 cm周壁、箱底为黑色的箱内,且其底面由25块相等的16 cm×16 cm正方形组成,以白线划分。将动物放入正中央格后开始测定,每次测定5 min,测试过程采用摄像机记录,每只大鼠只进行一次行为测定。根据动物穿越底面方格块数作为水平活动(distance traveled)得分,以直立(双足离地)次数作为垂直活动(standing uptight)得分,水平和垂直活动得分总和为总评分。测定完毕,粪便清理干净后,用75%酒精擦拭干净箱底,再进行下一只测定,采用单盲法,每周测定1次。
1.2.5 骨折动物模型建立
手术对照组(A组)和抑郁症组(C组)动物均在10%水合氯醛按3 mL·kg-1腹腔麻醉下,于一侧胫骨中段建立骨折模型,以直径1 mm克氏针髓内固定,假手术组(B组)仅给予相同的手术,但不建立骨折模型。术后肌注青霉素4万U·d-1,连续7 d,分笼饲养。抑郁症组动物每天给与可预知的慢性应激性刺激,每周进行蔗糖水偏好实验测试,检测大鼠抑郁情况是否存在。
1.2.6 血清Ca、P、ALP含量检测
各组于慢性应激刺激后28 d后8 h行手术,术后7 d、14 d、21 d行大鼠尾静脉抽血,将血清标本用Ca、P、ALP迈瑞测试盒测定大鼠血清中Ca、P、ALP含量。具体操作步骤如下:选择610 nm、520 nm的酶标仪、试管、微量移液器、漩涡混运器气浴箱等设备。按照试剂盒说明书将10 μL大鼠血清置于测定孔中,测试吸光度(absorbance,A)值,然后按测试盒说明书给出的公式计算出血清中Ca、P、ALP含量。
1.2.7 影像学检测
术后d 14、d 28、d 56,A组和C组每只大鼠的双后肢在同样的外展位摄正位和侧位X线片,测量采用DR阅片的影像归档和通信系统(picture archiving and communication systems,PACS),摄片和测量由两位医生按照双盲原则进行测定。骨痂体积测量采用Perkins法,即V=2πr1(r2-r1) L,其中,r1为骨半径,r2为骨痂半径,L为骨痂长度。
1.2.8 病理组织学检测
于术后d 14、d 28、d 56分别处死A组和C组大鼠各5只,取出胫骨标本各5根,立即剖取骨折部骨外膜骨痂和骨折端连接骨痂(非骨折组取相同部位),修剪成1 cm×1 cm大小标本,置于10%中性福尔马林液中固定,石蜡包埋,进行HE染色。光学显微镜下观察其病理学改变。
1.2.9 生物力学检测
分别于术后d 35和d 56处死A组和C组各10只,取出胫骨标本各10根,将胫骨标本置放于跨距15 mm的万能材料实验机的两个支点上进行三点弯曲实验。加载速5 mm·min-1,加载载荷为500 N,由仪器自动记录每次加载后产生的位移,计算机自动处理各组大鼠胫骨的测量值。
1.2.10 Micro CT
术后d 28、d 56随机处死A组和C组各10只大鼠,取胫骨骨折段行micro CT检测。骨标本水平放于样品架中,设定电压80 kV和电流500 μA。选择骨折线上下各5 mm区域进行扫描。分析指标包括骨小梁厚度、骨体积分数、骨表面积体积比、骨小梁数量和骨小梁间距,其中骨小梁厚度、骨体积分数、骨小梁数量为正向成骨指标,骨小梁间距和骨表面积体积比为负向指标。
1.3 统计学分析
实验数据用SPSS 20.0统计学软件处理,以均数±标准差(±s)表示,组间差异显著性的比较采用单因素方差分析或t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 蔗糖水偏好指数
慢性应激性刺激前及刺激后d 7、d 14,A、B、C组大鼠蔗糖偏好指数差异无显著性;刺激 21 d,C组大鼠蔗糖偏好指数下降(P<0.05);刺激28 d,C组大鼠蔗糖偏好指数显著下降(P<0.01)(Tab.1)(A、B组合为非抑郁组);术后各周C组大鼠蔗糖偏好指数显著下降(P<0.01)(Tab.2)。
2.2 旷场实验评估结果
慢性应激刺激前及刺激后d 7、d 14,C组大鼠水平运动和自立运动总分与正常组相比无明显差异;刺激后d 21、d 28,C组运动总分较正常组显著下降,差异有统计学意义(P<0.01)(Tab.3)。
2.3 血清Ca、P、ALP含量
慢性应激刺激后28 d后8 h行手术,术后7 d、14 d、21 d,C组血清ALP含量明显低于A组和B组(P<0.01);C组Ca含量与A组和B组无明显差异;C组P含量低于A组和B组(P<0.05)(Tab.4)。
2.4 DR骨痂量计算结果
术后14 d A组和C组均可见清晰骨折线,很少量低密度骨痂生长,骨痂量无明显差异; 术后28 d C组骨折线尚清晰,骨痂阴影密度、骨痂量低于A组(P<0.05);术后56 d A组骨痂生长速度较快,骨折断端有骨性连接,骨折线不清晰,C组可见模糊的骨折线,但有明显骨痂形成并桥接骨折断端,骨痂量C组低于A组(P<0.05)(Tab.5,Fig.1)。
Tab.1 Preoperative sucrose water preference test(%,±s,n=10)

Tab.1 Preoperative sucrose water preference test(%,±s,n=10)
Note:Compared with group A+B and C.Control(group A); Sham Control(group B); Depression(group C) groups,*P<0.05,**P<0.01.
Group0 d7 d14 d21 d28 d A+B 79.7±8.182.3±7.679.4±10.276.5±12.476.3±14.5 C 81.6±11.378.4±9.475.3±11.360.1±12.7*39.4±8.7**
Tab.2 Sucrose water preference test after operation(%,±s,n=10)

Tab.2 Sucrose water preference test after operation(%,±s,n=10)
Note:Compared with group A and B.Control(group A); Sham Control(group B); Depression(group C) groups,**P<0.01.
Group7 d14 d21 d28 d35 d A 83.4±10.679.2±9.181.3±7.178.5±6.279.3±5.5 B 79.3±9.576.6±11.277.3±13.676.4±8.578.7±10.2 C 46.4±10.7**43.6±8.9**38.7±6.9**40.2±10.7**43.9±9.1**Group42 d49 d56 d A 78.4±9.476.3±11.679.9±8.8 B 75.3±8.980.3±10.676.5±12.8 C 39.9±11.2**47.6±5.2**50.6±6.7**
Tab.3 Total score of open field experimental exercise(score ±s,n=10)

Tab.3 Total score of open field experimental exercise(score ±s,n=10)
Note:Compared with group A and B,Control(group A); Sham Control(group B); Depression(group C) groups,**P<0.01.
Group0 d7 d14 d21 d28 d A+B 125.4±16.6120.6±23.4118.9±16.3121.7±17.9119.7±18.5 C 123.7±19.5117.3±19.2112.5±18.765.4±14.4**58.3±9.2**
Tab.4 Ca,P and ALP(±s,n=10)
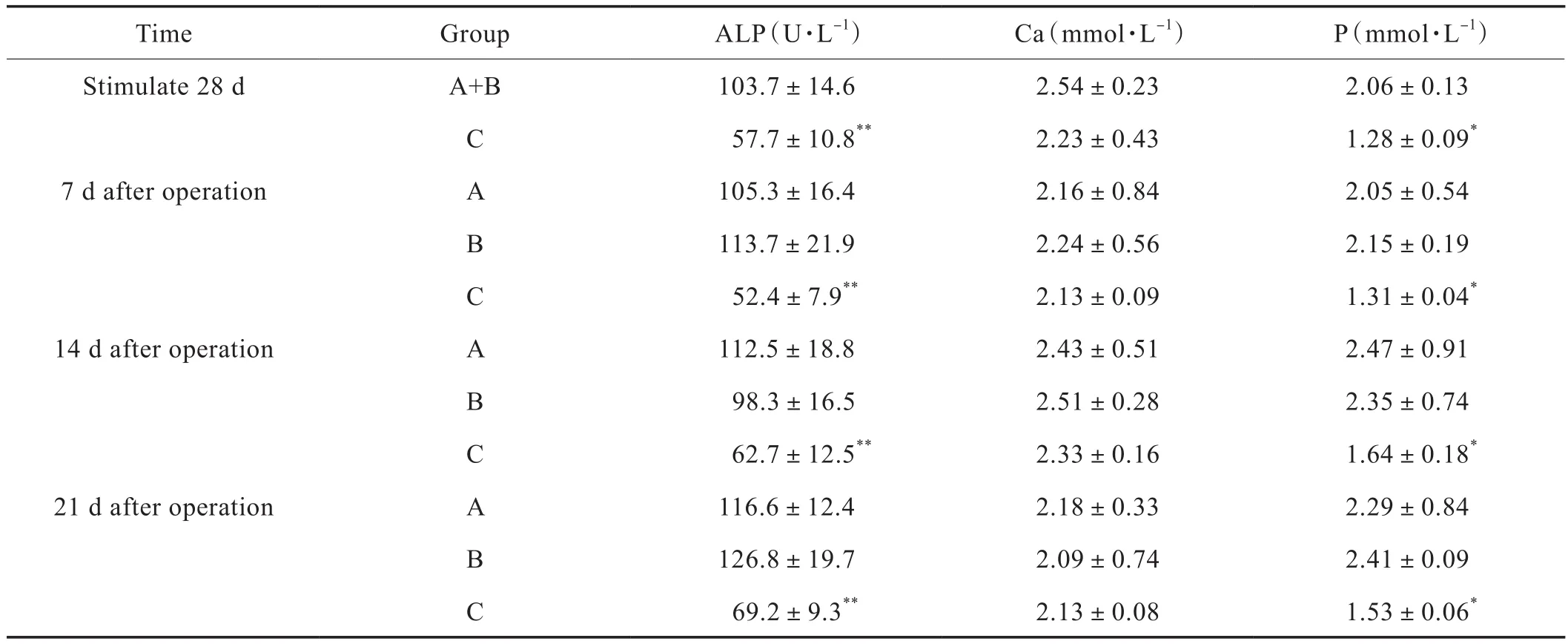
Tab.4 Ca,P and ALP(±s,n=10)
Note:Compared with group A and B,Control(group A); Sham Control(group B); Depression(group C) groups,*P<0.05,**P<0.01.
TimeGroupALP(U·L-1)Ca(mmol·L-1)P(mmol·L-1)Stimulate 28 dA+B 103.7±14.62.54±0.232.06±0.13 C 57.7±10.8**2.23±0.431.28±0.09*7 d after operationA105.3±16.42.16±0.842.05±0.54 B 113.7±21.92.24±0.562.15±0.19 C 52.4±7.9**2.13±0.091.31±0.04*14 d after operationA112.5±18.82.43±0.512.47±0.91 B 98.3±16.52.51±0.282.35±0.74 C 62.7±12.5**2.33±0.161.64±0.18*21 d after operationA116.6±12.42.18±0.332.29±0.84 B 126.8±19.72.09±0.742.41±0.09 C 69.2±9.3**2.13±0.081.53±0.06*
Tab.5 Calculated results of DR callus volume(mm3,±s,n=10)

Tab.5 Calculated results of DR callus volume(mm3,±s,n=10)
Note:Compared with Group A,Control(group A); Sham Control(group B); Depression(group C) groups,*P<0.05.
Group14 d28 d56 d A5.74±0.1528.74±9.1898.56±12.96 C5.26±0.0719.38±5.63*53.27±18.48*
2.5 病理组织学结果
手术后14 d C组有少量纤维结缔组织增生(白色箭头所示),大量新生毛细血管形成、局部充血(红色箭头所示),A组纤维结缔组织比C组增多,毛细血管减少,各组可见少量坏死骨片(浅蓝色箭头所示);手术后28 d C组纤维结缔组织增多,少量成骨细胞聚集(深蓝色箭头所示),A组可见大面积纤维组织,少量新生骨小梁(黄色箭头所示)、软骨内成骨(绿色箭头所示);手术后56 d C组可见新生骨小梁,软骨内成骨,大量成骨细胞聚集,A组可见成熟骨小梁同时在纤维成骨和软骨内成骨(Fig.2~3)。
2.6 三点弯曲实验结果
对2组大鼠胫骨的三点弯曲实验,得到大鼠胫骨愈合过程中弯曲力学性能实验结果。结果表明,A组在弯曲刚度、弯曲强度、弯曲挠度、弯曲载荷、弯矩及比挠度均优于C组,差异有统计学意义(P<0.05)(Tab.6)。
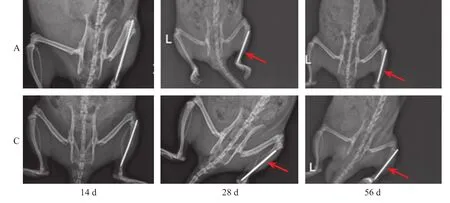
Fig.1 DR imaging data of group C and group A at 14,28 and 56 d after operation(red arrow showing callus)
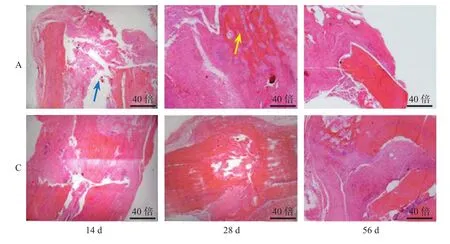
Fig.2 Pathological changes of group A and group C at 40-fold microscope 14,28 and 56 d after operation

Fig.3 The pathological changes of group A and group C at 200 times of microscope 14, 28 and 56 d after operation
Tab.6 Mechanical indices of tibial three-point bending(±s,n=10)
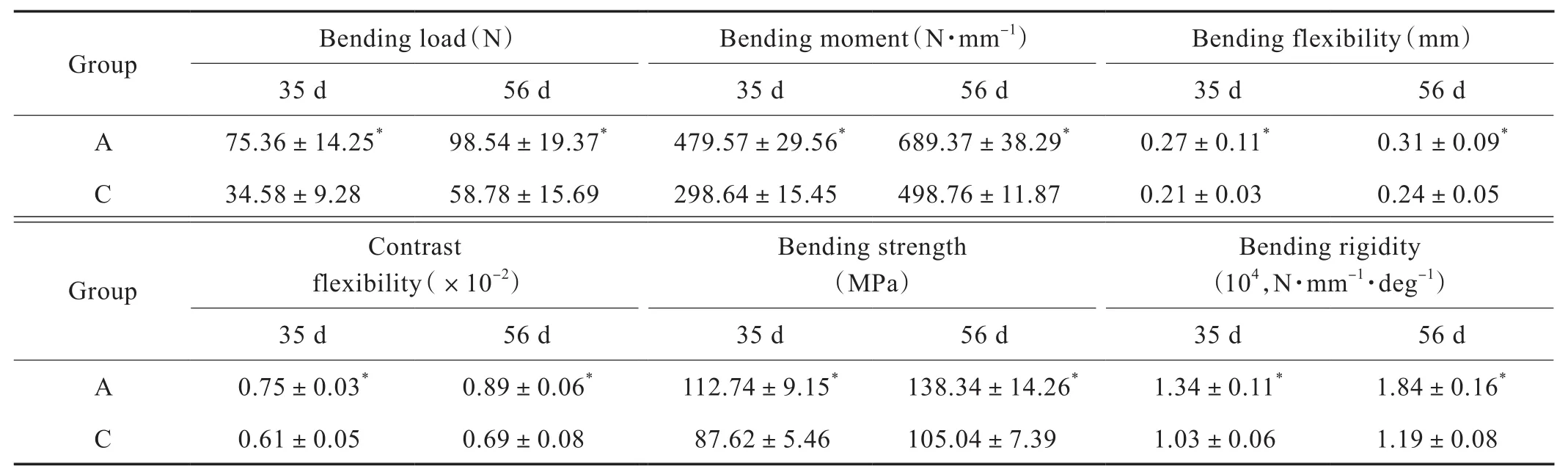
Tab.6 Mechanical indices of tibial three-point bending(±s,n=10)
Note:The indexes of group A were compared with those of group C.Control(group A); Depression(group C) groups,*P<0.05.
GroupBending load(N)Bending moment(N·mm-1)Bending flexibility(mm)35 d56 d35 d56 d35 d56 d A 75.36±14.25*98.54±19.37*479.57±29.56*689.37±38.29*0.27±0.11*0.31±0.09*C34.58±9.2858.78±15.69298.64±15.45498.76±11.870.21±0.030.24±0.05 Group Contrast flexibility(×10-2)Bending strength(MPa)Bending rigidity(104,N·mm-1·deg-1)35 d56 d35 d56 d35 d56 d 0.75±0.03*0.89±0.06*112.74±9.15*138.34±14.26*1.34±0.11*1.84±0.16*C 0.61±0.050.69±0.0887.62±5.46105.04±7.391.03±0.061.19±0.08 A
2.7 Micro-CT成骨指标结果
d 28,C组大鼠骨折线清晰,可见少量骨痂形成,A组可见少量新生骨小梁,无桥梁骨痴形成,未见骨折愈合;d 56,C组骨痂形成较多,可见新生骨小梁;A组有不同程度的成骨现象,与d 28相比,骨痂量有明显的增多,可见桥梁骨痂形成;d 28、d 56,C组骨体积分数、骨小梁厚度、骨小梁数量均低于A组(P<0.05);C组骨小梁间隙和骨小梁面积体积大于对照组(P<0.05)(Tab.7,Fig.4)。
3 讨论
抑郁症是一种危害公众健康的世界性疾病,在西方国家,抑郁症是仅次于高血压的第二大常见疾病[5]。据世界卫生组织(World Health Organization,WHO)预测,2020年抑郁症将成为仅次于缺血性心脏病第二大疾病,在全球范围内,这两种疾病都会导致残疾生命调整年(disability-adjusted life years,DALYs)的损失,而且会给发达中国家带来沉重的社会负担[6-7]。抑郁症不仅仅是大脑的代谢异常,由于其中枢和外周生理和生化环境的改变而引起全身实质器官的功能代谢障碍,骨代谢的改变是其中的一种,越来越多的文献证明抑郁症会严重影响骨代谢[8-10]。本课题前期通过临床观察得出抑郁症患者骨折愈合时间延迟以及不愈合率增加,进一步通过制备大鼠的抑郁骨折模型观察骨折愈合的指标,揭示抑郁症对骨折愈合的潜在影响。
以往的研究证实抑郁症患者骨折后愈合较正常人差,骨折的持续状态会给病人的日常生活带来不便,往往会导致抑郁的加重,而骨折后的抑郁加重又会延缓骨折的愈合,造成恶性循环[11-14]。
抑郁症的影响骨代谢因素大体可分为:生物学因素(炎症因子、HPA轴失调等);行为学因素(吸烟、酗酒、缺乏运动、厌食等);医源性因素(抗抑郁药的应用、住院等);合并疾病(代谢性疾病、炎症性疾病、甲状腺功能障碍、库欣病和性腺功能减退等),这些因素都会导致患者骨密度的改变,影响骨折愈合。但是Samuel等通过对这些生活方式的调整后,抑郁症患者的骨龄仍然低于对照组,这说明抑郁症跟骨密度之间存在一种必然的关系[15]。那么我们提出的科学的假设抑郁症通过影响骨代谢进而影响骨折愈合。本实验选用同一批大鼠,相同的环境饲养,统一规格的饲料喂食,尽量排除饮食环境等的影响。其血清Ca、P、ALP含量测定显示术后7 d、14 d、21 d抑郁症组较手术对照ALP、P浓度明显下降(P<0.01,P<0.05),进一步证实我们的假设抑郁症通过影响骨代谢影响骨折愈合。本实验中Ca浓度术后21 d内无明显差异(P>0.05),但术后28 d micro-CT成骨指标显示抑郁症组大鼠有骨质疏松趋势,可能由于骨内沉积Ca早期释放入血导致含量无明显变化。
Tab.7 Comparison of Micro-CT Osteogenesis Indicators(±s,n=10)

Tab.7 Comparison of Micro-CT Osteogenesis Indicators(±s,n=10)
Note:Comparisons of time points between group C and group A Control(group A); Depression(group C) groups,*P<0.05.
GroupBone volume fraction(%)Trabecular thickness(L·μm-1)Trabecular number(L·mm-1)28 d56 d28 d56 d28 d56 d A9.54±1.2517.48±2.6458.34±2.3669.37±3.572.74±0.153.34±0.26 C6.33±0.86*10.34±1.95*49.64±1.45*56.76±1.87*1.62±0.46*2.04±0.39*GroupBone area volume ratio(L·mm-1)Trabecular separation(μm)28 d56 d28 d56 d A 44.34±1.9539.32±2.35427.64±26.35349.62±19.95 C 50.15±2.75*47.39±3.05*485.39±30.21*417.74±24.65*

Fig.4 Micro CT showed osteogenesis 28 and 56 d after operation
抑郁症可导致机体的生物学改变进而影响内源性皮质醇,睾丸素和炎症因子的释放,募集和凋亡,降低骨的形成,促进骨的再吸收。多数等证明抑郁症的下丘脑-垂体-肾上腺皮质系统调节改变导致骨代谢异常,血浆皮质醇的增加会加速骨吸收,生物活性的睾丸素也可以促进骨吸收[16-21]。其他研究证明抑郁症患者的某些骨标志物的水平较正常人有明显改变,例如骨吸收的主要标志物IL-6的表达水平在抑郁症患者明显升高[22-25]。本研究实验结果提示:抑郁症组的DR骨痂、HE染色、三点弯曲实验、骨体积分数、骨小梁厚度、骨小梁数量均低于对照组,而骨小梁间隙和骨小梁面积体积大于对照组,均提示抑郁症组的大鼠初始骨痂在形成和生长过程中明显滞后,此现象与上述研究不谋而合,进一步证明抑郁症可影响大鼠骨折愈合。后期的研究我们将进一步从血管生成素、骨形成蛋白等指标及相关通路揭示产生这些现象的进一步机制。
4 本实验不足之处
第一,本实验以大鼠为实验对象,大鼠与人尚存在比较大的差异性,后期可改进至大型灵长类动物和临床试验。
第二,本实验对于大鼠抑郁程度无法进行量化,仅通过其行为表现来判断是否抑郁,抑郁的程度无法确定,故骨折愈合的程度是否与抑郁成正相关无法确定。
第三,抑郁后每只大鼠的饮食量会有不同的降低,导致钙,磷等摄入减少,本实验未对每只大鼠的饮食量进行记录,分析,可能对实验造成一定误差,但也有文献报道,厌食对抑郁症的骨代谢影响较小[26]。
第四,本实验只有抑郁症手术组,而没有抑郁症对照组,关于手术是否会加重抑郁症尚不清楚。
总之,本实验数据证实了抑郁症影响大鼠骨折愈合的变化趋势,为该病的机制研究提供了实验依据,但是抑郁症通过哪些机制影响骨折愈合,是单一还是复合,尚需要更深入的研究和探讨。
