NaN3处理对杉木种子发芽及幼苗生长的影响1)
2018-06-15胡瑞阳孙宇涵吴博段红静林华忠方禄明余小龙李云
胡瑞阳 孙宇涵 吴博 段红静 林华忠 方禄明 余小龙 李云
(北京林业大学,北京,100083) (福建省将乐国有林场) (北京林业大学)
杉木(Cunninghamialanceolata(Lamb.) Hook)是我国重要的人工用材林造林树种,栽培历史悠久,分布区域广,一直是我国林木遗传改良工作的主要研究对象[1-2]。化学诱变育种借助具有诱变作用的化学物质诱发植物的基因突变,可显著提高诱变材料的突变频率,是改变林木不良性状以及选育新种质的有效育种手段[3]。化学诱变具有随机性,因此,杉木诱变处理后可创造丰富的变异,获得大量种质遗传材料,为杉木新种质的筛选奠定基础[4]。
叠氮化钠(NaN3)是一种能够高效制造点突变的化学诱变剂,其作用机理是在酸性条件下NaN3产生呈中性的分子HN3,HN3易透过细胞膜进入细胞内,进而以碱基替换方式影响DNA的正常合成,从而导致点突变的产生[5-6]。目前,NaN3已广泛应用于农作物和花卉,影响植物材料的生长发育,诱发植株表型发生明显变异。如NaN3处理显著降低小麦、大豆种子的发芽率和植株成活率,并诱导小麦叶色、穗型、育性、茎干高矮等表型发生多种类型的变异[7-8],增加大豆诱变苗株高、主茎节数、分枝数等的变异范围[9];NaN3处理还影响玉米、番茄、玉扇愈伤组织的增殖及再生[10-12],抑制文心兰类原球茎及再生苗生长[13],诱导玉扇愈伤组织再生芽叶色、株型和叶序变异[12]。
NaN3应用于林木诱变的研究较少,但已被证实可以抑制青檀幼苗的成活[14],诱导巨尾桉产生能够抵御寒胁迫的突变[15]。杉木NaN3化学诱变的研究表明,NaN3诱变处理可以诱导杉木幼苗叶片白化[16]。前期在以杉木种子为供试材料时发现NaN3影响种子成苗及幼苗生长[4,17],但NaN3浓度及诱变处理时间对杉木种子萌发以及萌发后幼苗生长造成什么样的影响,需要进一步试验分析。因此,本研究选择杉木第3代种子园采集的良种为供试材料,经NaN3诱变处理,研究不同NaN3浓度及处理时间对发芽率、发芽时间以及诱变苗早期生长的影响,旨在为开展杉木NaN3诱变育种研究提供技术支持。
1 材料与方法
1.1 试验材料
以3代杉木种子园所产良种为本研究的供试材料。2011年11月份于福建省将乐县国有林场3代种子园采集杉木成熟球果,收集晾晒散出的种子于4 ℃低温冷藏备用。经测定,供试杉木干种子的平均质量为5.93 mg·粒-1。
1.2 试验方法
2012年2月份取低温冷藏的种子,室温25 ℃避光条件下,首先将杉木干种子浸泡在蒸馏水中4 d,每1 d换水1次,浸泡完成后的种子用蒸馏水清洗3次,然后再进行NaN3诱变处理。诱变试验设置6个NaN3浓度梯度(0、2、4、6、8、10 mmol·L-1)、3个处理时间(4、8、12 h),各浓度的NaN3溶液用pH=3.0、0.1 mol·L-1的磷酸缓冲液配制。诱变处理时,将蒸馏水浸泡后的杉木种子完全浸入到各浓度的NaN3溶液中,室温25 ℃避光条件下分别振荡(120 r·min-1)处理4、8、12 h,蒸馏水清洗5次去除种子表面残留NaN3溶液后进行诱变种子发芽及诱变苗培育试验。各NaN3溶液浓度与处理时间组合的参试种子数量为2 100粒,并设置3次重复,其中100粒用于诱变种子发芽,2 000粒用于诱变苗培育。
诱变种子发芽:杉木种子经NaN3诱变处理后,播种到以水苔为培养基质的培养皿中进行发芽试验。杉木种子发芽试验参照胡瑞阳等[18]的试验方法,在人工气候室内进行,70%相对湿度,25 ℃ 16 h光照与20 ℃ 8 h黑暗交替,光照强度为200~250 μmol·m-2·s-1。每天统计发芽种子的数量,待发芽完成后计算起始发芽时间、发芽持续时间、发芽时间和发芽率。
诱变苗培育:杉木种子经NaN3诱变处理后,直接按照完全随机区组试验设计条播于福建省将乐县国有林场育苗圃实验区进行诱变苗培育。9个月后,从诱变苗群体中随机选取150株诱变苗测量苗高、地径和侧枝数,并统计各指标的最大值和最小值,计算变异幅度。除10 mmol·L-1-12 h处理组合的少量诱变苗全部死亡外,其余浓度时间组合均得到了大量正常生长的诱变苗,完全能够满足诱变苗调查数量要求。
1.3 数据统计
起始发芽时间=发芽试验开始到种子开始发芽所需时间;
发芽持续时间=种子开始发芽到发芽完成所需时间;
发芽时间=起始发芽时间+发芽持续时间;
发芽率=(发芽种子数/供试种子数)×100%;
变异幅度=最大值-最小值。
1.4 数据分析
利用Excel 2010和DPS V7.05软件进行数据分析。其中,种子发芽、诱变苗早起长势等数据均通过标准化后进行方差分析,在置信水平95%上用Duncan法(p<0.05)进行多重比较。
2 结果与分析
2.1 NaN3处理对杉木种子发芽的影响
从表1、表2可以看出,NaN3诱变剂浓度及处理时间均会显著影响杉木种子的发芽。对照中蒸馏水浸泡4~12 h的杉木种子在水苔为培养基质的培养皿中第2天便可开始发芽,起始发芽时间为0 d。2~10 mmol·L-1的NaN3溶液浸泡处理会延长杉木种子起始发芽时间,且时间随着浓度的增加而显著延长,当NaN3浓度达到最大的10 mmol·L-1时,平均起始发芽时间最长,为9.56 d(表1)。杉木种子的起始发芽时间同样会随着诱变处理时间的增加而延长,诱变处理4 h时平均起始发芽时间为2.17 d,处理时间增加到12 h则平均起始发芽时间显著延长到6.56 d(表2)。对照中蒸馏水浸泡的杉木种子平均12.56 d便可发芽完成,2~10 mmol·L-1的NaN3诱变处理均显著增加了发芽持续时间,但不同于起始发芽时间,随着NaN3浓度的增加,发芽持续时间呈现先增加后降低的趋势(表1)。诱变处理时间对发芽持续时间的影响与NaN3浓度类似,8 h处理时的发芽持续时间最长达到了20.17 d(表2)。从发芽试验开始到发芽完成,杉木种子发芽所需发芽时间为12.56 d,NaN3溶液处理显著增加了发芽时间,且随着浓度增加发芽时间逐渐延长,浓度达到最大的10 mmol·L-1时,杉木种子发芽完成所需时间延长了1倍(表1)。4~12 h的NaN3处理同样延长了杉木种子发芽时间,但8 h处理所需发芽时间最长,为23.78 d(表2)。与发芽时间相反,NaN3诱变处理显著降低了杉木种子发芽率。NaN3溶液浓度在2~10 mmol·L-1范围内,浓度越高发芽率越低,尤其是NaN3浓度从8到10 mmol·L-1时,发芽率从25.89%降低到12.11%,相比对照40.89%的发芽率降低了一半(表1),因此,结合半致死剂量原则,NaN3诱变处理杉木种子4~12 h时,最适宜的浓度为8~10 mmol·L-1。
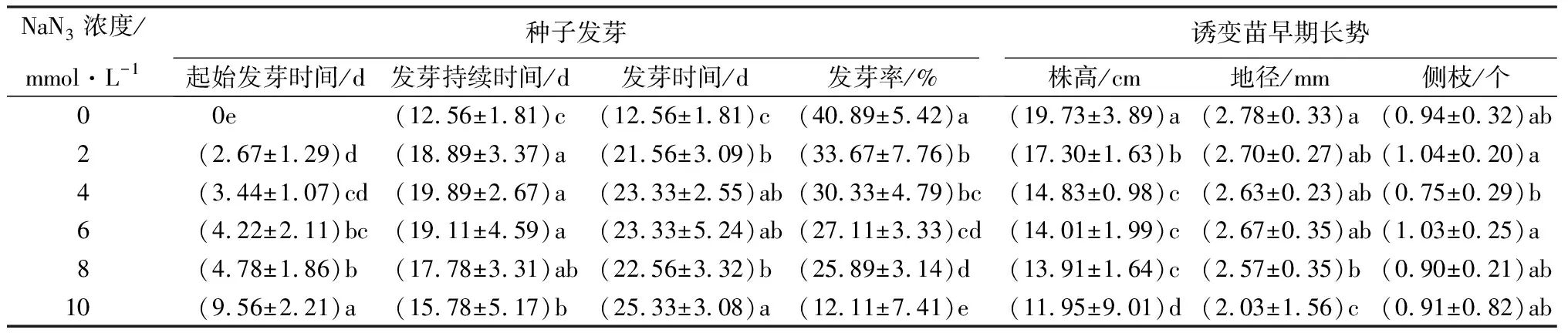
表1 不同NaN3浓度对杉木种子发芽及诱变苗早期长势的影响
注:表中数据为平均值±标准差;同列不同字母表示在0.05水平差异显著。
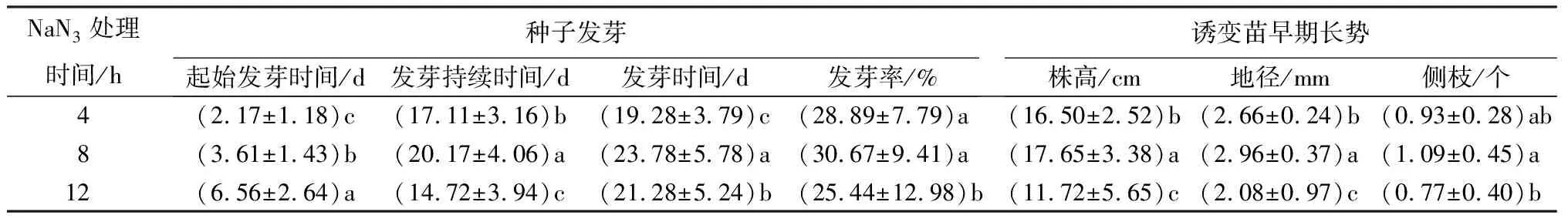
表2 不同处理时间对杉木种子发芽及诱变苗早期长势的影响
注:表中数据为平均值±标准差;同列不同字母表示在0.05水平差异显著。
不同的NaN3诱变剂浓度与处理时间组合同样显著影响杉木种子的发芽(表3)。对照试验中,4~12 h处理的杉木种子起始发芽时间全部为0 d,发芽持续时间、发芽时间与发芽率有差异,但不显著。NaN3诱变处理后杉木种子,随着NaN3浓度增加以及处理时间的延长,起始发芽时间显著延长;表现在NaN3浓度越大诱变处理时间越长,所需的起始发芽时间越长,NaN3浓度为10 mmol·L-1、处理时间为12 h时,杉木种子起始发芽所需时间平均达到了15 d。同一诱变处理时间,发芽持续时间随着NaN3浓度增加呈现先升高后降低趋势;同一NaN3浓度,4~12 h处理的杉木种子所需发芽持续时间均是在8 h达到最大值。杉木种子经4~12 h诱变处理,所需的发芽时间均随着NaN3浓度的增加而呈现先升高后降低再升高的趋势,并且均是在NaN3浓度为10 mmol·L-1时达到最大值。同一诱变处理时间,种子发芽率与NaN3浓度呈负相关,表现在NaN3浓度越大、处理时间越长,发芽率越低;同一NaN3浓度诱变处理中,随着处理时间的延长,对照的种子发芽率则逐渐增加,当浓度为2~8 mmol·L-1时种子发芽率呈现先升高后降低趋势,并在8 h达到最大值,当浓度达到10 mmol·L-1时种子发芽率则显著降低。如表1和表2所示,依据半致死剂量原则NaN3诱变处理杉木种子4~12 h时,最适宜的浓度为8~10 mmol·L-1。表3研究结果表明,NaN3浓度达到最大的10 mmol·L-1、处理时间为12 h时,发芽率仅为3%,接近致死状态,处理时间降为4 h时发芽率为19.67%,是其对照发芽率(37.33%)的52.69%,已经非常接近半致死率;当NaN3浓度为8 mmol·L-1时,经4~12 h的诱变处理后杉木种子发芽率分别为25.00%、28.00%和24.67%,分别是其对照发芽率的66.97%、68.85%和55.22%,可知,处理时间为12 h时最接近半致死率;因此,综合表1、表2和表3,依据半致死剂量原则,本研究确定NaN3诱变处理杉木种子的适宜条件为10 mmol·L-1处理4 h或8 mmol·L-1处理12 h。
2.2 NaN3处理对杉木诱变苗早期长势的影响
从表1和表2可看出,未经诱变处理的杉木种子培育9个月后,获得对照苗的平均株高为19.73 cm、地径2.78 mm、侧枝0.94个。2~10 mmol·L-1的NaN3诱变处理显著抑制了诱变苗生长,表现在NaN3浓度越大,株高越矮、地径越细;8 mmol·L-1的NaN3诱变处理获得的诱变苗平均株高和地径分别为13.91 cm和2.57 mm,相比对照分别降低了30%和8%;当NaN3浓度达到最大时,平均株高和地径分别降低到11.95 cm和2.03 mm,相比对照分别降低了40%和27%。4 mmol·L-1的NaN3诱变处理会显著降低了诱变苗群体的侧枝数量;NaN3其他浓度处理中,2、6 mmol·L-1的诱变处理增加了侧枝数,8、10 mmol·L-1的诱变处理减少了侧枝数,但相比对照差异不显著。3个诱变处理时间均显著影响了诱变苗群体的株高、地径和侧枝数,并且这3个表型指标均是在8 h诱变处理时达到最大值。
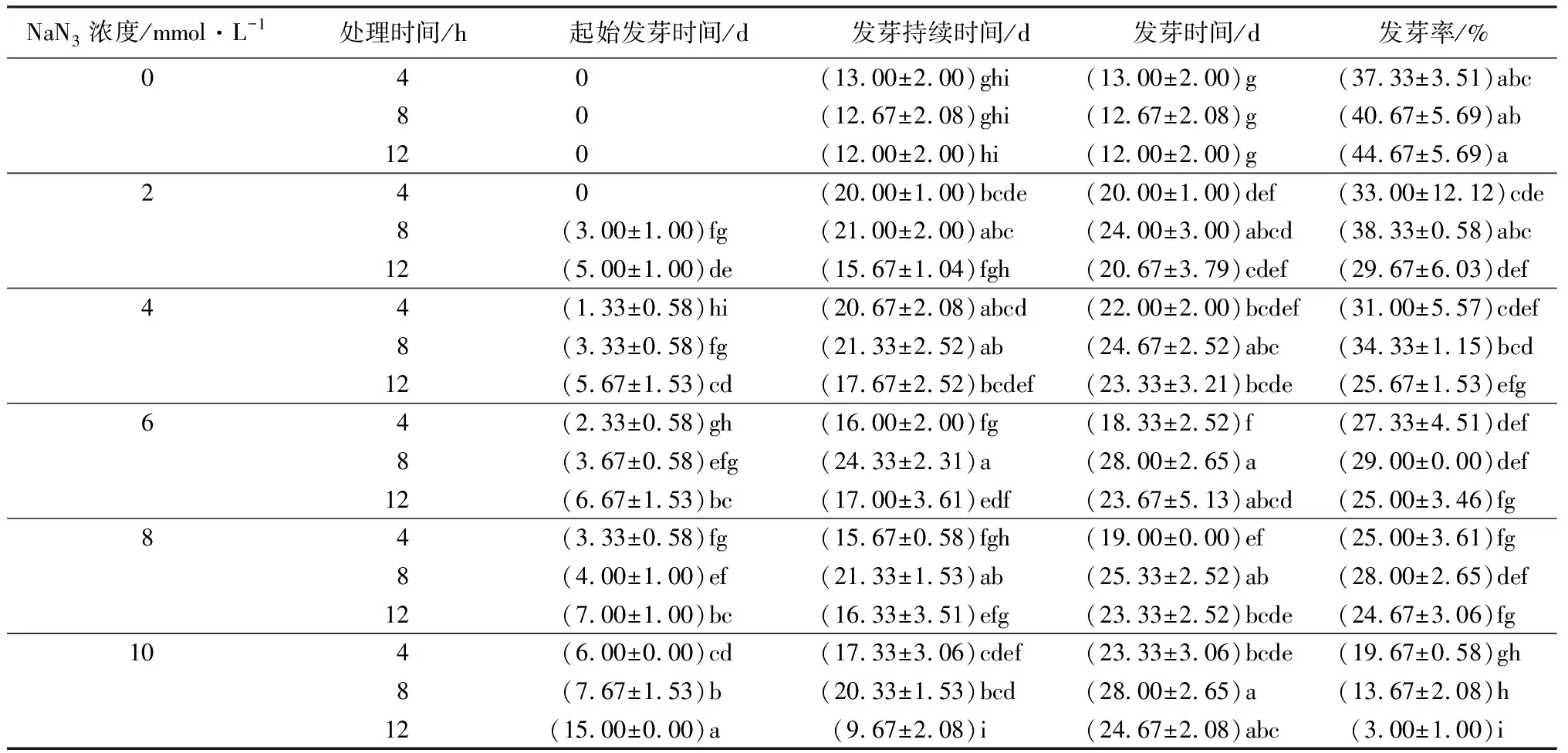
表3 NaN3浓度与处理时间组合对杉木种子发芽的影响
注:表中数据为平均值±标准差;同列不同字母表示在0.05水平差异显著。
不同NaN3诱变剂浓度与处理时间组合同样显著影响杉木诱变苗群体的株高、地径和侧枝数(表4)。4 h诱变处理中,2 mmol·L-1低浓度NaN3溶液处理将诱变苗株高降低到18.87 cm,相比对照的19.47 cm差异不显著,但诱变处理明显增加了株高的变异幅度;4~8 mmol·L-1较高浓度处理则显著降低诱变苗的株高;当浓度达到10 mmol·L-1时,相比较低浓度(4~8 mmol·L-1)株高有显著增加但平均高度仍显著低于对照。诱变处理时间延长到8~12 h时,诱变苗株高的变化规律与4 h相似,即NaN3溶液浓度为2~8 mmol·L-1时,浓度越高对株高的抑制作用越明显;8 h诱变处理中,NaN3浓度为10 mmol·L-1时获得的诱变苗株高为18.38 cm显著高于2~8 mmol·L-1,但仍低于对照的24.29 cm;杉木种子经10 mmol·L-1的NaN3处理12 h后,在人工气候室内进行的发芽试验中虽然有3.00%的种子发芽率(表3),但播种于育苗圃后9个月的生长期内并未发现长出圃地的诱变苗存在,故此诱变处理组合没有株高、地径和侧枝的测量数据。相比对照,虽然4 h的诱变处理对诱变苗地径差异不明显,但较低浓度(2~6 mmol·L-1)的NaN3处理明显增加了诱变苗地径的变异幅度。8 h处理中,随着NaN3溶液浓度的增加,诱变苗地径均值逐渐增大,并且当浓度达到最大的10 mmol·L-1时地径均值达到了3.39 mm,已经超过对照的3.18 mm。12 h诱变处理对地径影响差异不显著,但2~8 mmol·L-1的NaN3处理明显扩大了诱变苗地径的变异幅度。4 mmol·L-1的NaN3溶液处理杉木种子4~8 h显著减少诱变苗的侧枝数,平均为0.57~0.67个;10 mmol·L-1的NaN3溶液处理8 h显著增加了诱变苗的侧枝数,平均达到了1.65个,并且侧枝数的变异幅度也达到了最大值7。
3 结论与讨论
NaN3诱变处理会影响植物材料的生长发育,并诱导植株表型发生明显变异[19]。5~20 mmol·L-1的NaN3处理小麦种子2 h会显著抑制种子萌发活动,降低发芽势和发芽率[7]。本研究同样发现,NaN3诱变处理显著抑制杉木种子萌发,表现在延长发芽所需时间,且这种延迟效果与NaN3浓度和处理时间呈正相关。NaN3对种子的诱变效应不只表现在种子发芽阶段,还会持续到种子萌发后的幼苗生长发育阶段。如0.04%的NaN3溶液浸泡大豆种子12 h所得M1代植株出现矮化和晚熟现象,且株高、分枝数、粒质量等表型指标的变异范围明显增加[9]。本研究中,NaN3处理不仅降低了种子发芽率、延长了杉木种子的发芽时间,而且抑制了诱变苗的生长,造成株高矮化和茎粗变细,诱变苗群体之间变异幅度差异增大。类似航天诱变、伽马射线对植物材料生长发育的影响[20-21],NaN3诱变处理能够诱导苜蓿愈伤组织以及蝴蝶兰类原球茎发生生理损伤,如导致脯氨酸、丙二醛、可溶性糖、过氧化氢酶等生理生化指标发生显著变化[22-23],NaN3还能够降低玉米愈伤组织的代谢水平[24],造成大麦萌发胚的DNA损伤[25]。NaN3诱导植物材料内部生理、代谢以及DNA水平上的变化很有可能是造成杉木种子发芽延迟、诱变苗生长发育受阻、变异幅度增加的部分原因。
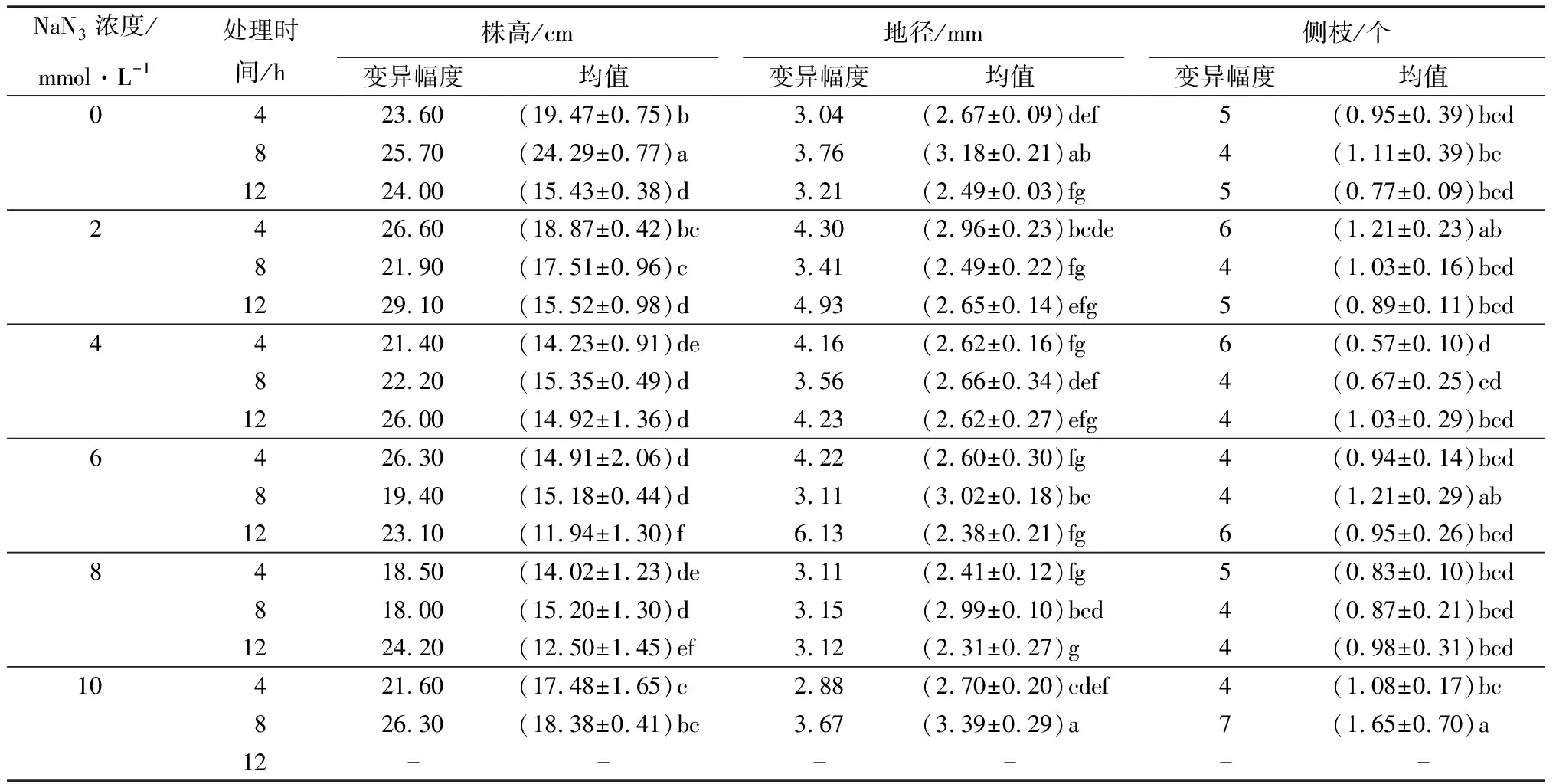
表4 不同NaN3浓度与处理时间组合对杉木诱变苗株高、地径和侧枝的影响
注:表中数据为平均值±标准差;同列不同字母表示在0.05水平差异显著;“-”表示无测量数据。
选择适宜的诱变剂浓度及处理时间是植物化学诱变成功的关键因素之一[26-28]。诱变处理时,一般以材料的半致死率作为适宜诱变剂量及处理时间的筛选标准,这既可以保证材料有较高的突变率,又不致过分损伤而导致试验材料死亡[29]。本研究发现,NaN3溶液浓度越高对杉木种子造成的伤害越严重,表现在发芽时间显著延长、发芽率显著降低,浓度8~10 mmol·L-1时接近半致死。NaN3诱变处理小麦种子发现,5 mmol·L-1处理伤害过轻,15 mmol·L-1处理伤害过重,结合实验室及田间数据分析,确定适宜剂量为10 mmol·L-1[7],其试验结果与本研究类似。除了NaN3溶液浓度,诱变处理时间同样会显著影响诱变效果。如在NaN3诱变处理纽荷尔脐橙枝条腋芽中,浓度同样为10 mmol·L-1,当处理时间由3 h延长到24 h时,纽荷尔脐橙枝条的存活率由64%显著降低到接近半致死率的51.7%[30]。本研究中,10 mmol·L-1的NaN3溶液处理时间由4 h延长到12 h时同样发现,杉木种子发芽率由19.67%显著降低到3.00%。在‘巴西蕉’不定芽诱变处理中,综合NaN3浓度及处理时间对不定芽增殖、致死率的诱变效应,确定诱变适宜的条件为2.31 mmol·L-1的NaN3溶液处理3 h和3.08 mmol·L-1的NaN3溶液处理2 h[31]。由此可见,NaN3浓度及处理时间对植物材料的诱变效应是累积的,即较高浓度的诱变剂进行短时间处理或较低浓度长时间处理都可以使诱变后的植物材料达到半致死效果。本研究中,10 mmol·L-1的NaN3处理12 h可能对杉木种子造成了严重伤害,种子发芽率降低到3.00%,NaN3浓度及处理时间对杉木种子的累积诱变效应已接近完全致死。当把浓度降低到8 mmol·L-1或者处理时间减少到4 h时,诱变剂NaN3对杉木种子的伤害随之减轻,表现在发芽率从接近致死状态显著升高到接近半致死,因此,本研究确定NaN3诱变处理杉木种子的适宜条件为10 mmol·L-1处理4 h或8 mmol·L-1处理12 h。利用该方法进行杉木种子诱变,可使得种子发芽达到半致死,且诱导幼苗群体株高矮化、茎粗变细、侧枝数量改变。这些表型指标发生明显变化的诱变苗群体,为选育优质、抗逆的杉木新种质提供材料。
参 考 文 献
[1] MINGHE L, RITCHIE G A. Eight hundred years of clonal forestry in China: I. traditional afforestation with Chinese fir (Cunninghamialanceolata(Lamb.) Hook.)[J]. New Forests,1999,18(2):131-142.
[2] 张梦雅,王新杰,徐雪蕾,等.不同间伐强度下杉木人工林多功能评价[J].东北林业大学学报,2017,45(3):29-33.
[3] 林开文,孙正海.人工诱变在我国林木遗传改良中的应用[J].安徽农学通报,2009,15(7):66-67.
[4] 吴博.四种诱变剂对杉木的诱变效应研究[D].北京:北京林业大学,2016.
[5] 董颖苹,连勇,何庆才,等.植物化学诱变技术在育种中的运用及其进展Ⅰ:化学诱变技术及诱变效率[J].种子,2005,24(7):54-58.
[6] OLSEN O, WANG X, VON WETTSTEIN D. Sodium azide mutagenesis: preferential generation of A.T-->G.C transitions in the barleyAnt18 gene[J]. Proceedings of the National Academy of Sciences of the United States of America,1993,90(17):8043-8047.
[7] 李明飞,谢彦周,刘录祥,等.叠氮化钠诱变普通小麦陕农33突变体库的构建和初步评估[J].麦类作物学报,2015,35(1):22-29.
[8] 张希太,谢淑芹,张彦波,等.利用NaN3诱变“中育5号”选育变异种质系及SSR分析[J].西南农业学报,2011,24(4):1239-1242.
[9] 姜振峰,刘志华,李文滨,等.叠氮化钠对大豆M1的生物学诱变效应[J].核农学报,2006,20(3):208-210.
[10] 付凤玲,李晚忱,荣廷昭,等.用γ射线和叠氮化钠诱变的玉米愈伤组织筛选耐旱和雄性不育材料[J].核农学报,2005,19(5):356-359.
[11] 罗雷,梁燕,崔霞,等.化学诱变剂诱导番茄耐低温突变体的初步研究[J].中国农学通报,2012,28(22):138-143.
[12] 吴正景,张菊平,时灿辉,等.叠氮化钠诱变玉扇愈伤组织的研究[J].植物生理学通讯,2010,46(12):1247-1250.
[13] 崔广荣,张子学,张从宇,等.文心兰NaN3离体化学诱变及RAPD检测[J].广西植物,2011,31(6):836-843.
[14] 张林,朱翠翠,王峰,等.青檀诱变育种与种质创新[J].天津农业科学,2016,22(8):134-137.
[15] 陈宇.化学诱导巨尾桉耐寒突变的叶绿素荧光动力学差异分析[D].福州:福建农林大学,2009.
[16] 颜志勤.三种化学诱变剂在杉木育种中的应用研究[D].福州:福建农林大学,2013.
[17] 余小龙.杉木种子诱变及诱变苗林地调查分析[D].北京:北京林业大学,2016.
[18] 胡瑞阳,段红静,林华忠,等.杉木多倍体变异苗诱导及倍性鉴定[J].核农学报,2016,30(8):1491-1497.
[19] 张瑞成,李魏,潘素君,等.化学诱变在种质资源改良上的应用[J].分子植物育种,2017,15(10):1-9.
[20] 詹亚光,唐敬轩,齐凤慧,等.60Coγ诱变对白桦愈伤组织再生的影响及再生植株染色体数量变异分析[J].东北林业大学学报,2008,36(1):16-17.
[21] 张建芳,杨学军,潘远智,等.航天诱变对须苞石竹SP_1代植株生理指标及抗氧化酶的影响[J].东北林业大学学报,2011,39(6):24-25.
[22] 李波,贾秀峰,李云波.苜蓿抗盐愈伤组织的诱导及其生理生化指标的测定[J].种子,2005,24(2):35-37.
[23] 马玉涵,赵岩,张强,等.叠氮化钠诱变对离体蝴蝶兰类原球茎生理的影响[J].核农学报,2010,24(2):411-414.
[24] DOTSON S B, SOMERS D A. Differential metabolism of sodium azide in maize callus and germinating embryos[J]. Mutation Research,1989,213(2):157-163.
[25] VELEMINSKY J, ROSICHAN J L, JURICEK M, et al. Interaction of the mutagenic metabolite of sodium azide, synthesized in vitro, with DNA of barley embryos[J]. Mutation Research,1987,181(1):73-79.
[26] BIERMANS G, HOREMANS N, VANHOUDT N, et al. An organ-based approach to dose calculation in the assessment of dose-dependent biological effects of ionising radiation inArabidopsisthaliana[J]. Journal of Environmental Radioactivity,2014,133(3):24-30.
[27] KUMAR A, KUMAR V, LAL S K, et al. Influence of gamma rays and ethyl methane sulphonate (EMS) on the levels of phytic acid, raffinose family oligosaccharides and antioxidants in soybean seeds of different genotypes[J]. Journal of Plant Biochemistry and Biotechnology,2014,24(2):204-209.
[28] HUSSAIN S. Mutagenic effect of sodium azide (NaN3) on M2generation ofBrassicanapusL. (variety Dunkled)[J]. Pure and Applied Biology,2017,6(1):226-236.
[29] DU Y, LI W, YU L, et al. Mutagenic effects of carbon-ion irradiation on dryArabidopsisthalianaseeds[J]. Mutation Research,2014,759(1):28-36.
[30] 孔佑涵,苑平,吴娟娟,等.叠氮化钠处理纽荷尔脐橙腋芽的诱变效应研究[J].分子植物育种,2016,14(12):3489-3495.
[31] 李洪波,吕顺,刘文清,等.叠氮化钠对‘巴西蕉’不定芽的诱变效果研究[J].中国果树,2016,10(1):35-38.
