食欲素A对慢性不可预见轻度应激抑郁症模型大鼠痛阈的影响*
2018-06-14张如敏李丹丹王培香杨春青
张如敏 李丹丹 王培香 杨春青 陈 京
(济宁医学院神经生物学研究所,济宁 272067)
抑郁症是一种常见的情绪障碍。疼痛是抑郁症患者的主诉症状之一,研究表明65%的抑郁症患者伴有各类不同程度的疼痛,严重影响了患者生活质量。因此,抑郁症患者疼痛阈值和疼痛敏感性的研究对探讨抑郁症患者常伴有疼痛症状的机制具有重要意义。Strigo等[1]认为抑郁症患者的疼痛敏感性增加,痛阈降低;但也有研究结果显示抑郁症患者的疼痛敏感性降低,痛阈升高[2]。因此,对抑郁症患者痛阈研究的结果目前尚无明确定论。Fadel等[3]发现下丘脑神经细胞分泌食欲素到中脑腹侧背盖区、伏核和内侧前额叶皮层等区域,食欲素A(OrexinA,OA)参与睡眠周期、摄食等生理活动和焦虑、恐惧、快感缺乏等行为的调节,能够显著缓解抑郁症患者的抑郁样症状[4-5]。另外,OA还具有明显的镇痛作用,能够缓解应激引起的多种疼痛。本文探讨OA对慢性不可预见轻度应激(chronic unpredictable mild stress,CUMS)抑郁症模型大鼠痛阈的影响,为进一步分析OA对抑郁症状的调节和镇痛作用提供实验依据。
1 材料与方法
1.1 材料
1.1.1动物 健康雄性SD大鼠,周龄5W,济南朋悦实验动物繁育有限公司,许可证号:SCXK(鲁)201400007。
1.1.2药品、试剂及仪器 OA(美国Phoenix制药公司);鼠尾光热测痛仪和智能热板仪(安徽正华生物仪器设备有限公司);旷场视频分析系统(上海欣软信息科技有限公司)。
1.2 方法
1.2.1动物分组 50只大鼠随机分为两组:空白对照组(NC)10只,5只/笼;CUMS模型组40只,1只/笼。
1.2.2建立CUMS模型 按照Katz[6]的方法进行改进后建模:SD大鼠适应实验室环境1周(W1),随后连续刺激4周(W2~W5)。刺激因素包括明暗颠倒12h、4℃冰水游泳6min、禁食24h、禁水24h、夹尾1min、潮湿环境12h、水平垂直震荡30min、束缚6h、笼盒倾斜12h(45°)等,每天随机2~3种刺激。
1.2.3CUMS模型评估
1)体质量。每周记录一次大鼠的体质量,检测大鼠体质量的变化。
2)食物和纯水的消耗量。检测大鼠24h饲料和纯水的消耗量,每周1次,并记录体重。SD大鼠24h食物和纯水的耗量以食物或纯水的摄入量(g)/动物体重(g)进行评定。
3)糖水偏好实验。大鼠熟悉实验室环境期间每只鼠笼2只水瓶,1周后随机将其中一只水瓶内的水换成1%蔗糖水。24h后计算糖水消耗百分比。连续刺激4周后,再次进行检测。糖水偏好百分比=糖水消耗量(ml)/[糖水消耗量(ml)+纯水消耗量(ml)]×100%。
4)自主运动。大鼠的自主运动在100cm×100cm×65cm开放旷场内进行。红外线视频检测系统记录大鼠的运动轨迹。轻轻将大鼠置于旷场的中央格,连续检测5min。第1周和第5周各测1次。计算机分析系统分析大鼠的水平运动和垂直运动得分。
1.2.4OA对CUMS模型大鼠痛阈的影响
将 CUMS模型大鼠随机分为两组,10只/组。侧脑室微量注射OA或生理盐水,对照组:CUMS模型大鼠+10μl生理盐水(CUMS+NS);实验组:CUMS模型大鼠+10μl OA(10μg)(CUMS+OA)。通过辐射热甩尾实验和舔足实验检测OA对抑郁症大鼠痛阈的影响。
1)辐射热甩尾实验。将大鼠置于特质的固定玻璃桶内,鼠尾从固定桶后盖的穿孔处伸出。选择距尾尖1cm处作为痛点。待动物平静后将痛点置于光热测痛仪的测痛孔处,记录鼠尾甩开的时间。以辐射热开始照射到鼠尾致痛摆尾逃避热辐射的潜伏期作为基础阈值,单位为s,每次间隔2min,连续测量3次,取平均值。分别检测大鼠苏醒后15、30、45、60min的甩尾潜伏期。以(给药后痛阈-基础痛阈)/基础阈值×100%计算阈值提高百分比。
2)舔足实验。CUMS模型大鼠置于智能热板仪并记录基础痛阈值,以大鼠舔后足的潜伏期作为痛反应指标(52 ± 0.5)℃。间隔2min,连续记录3次,取平均值。按照上述方法依次记录实验动物苏醒后15、30、45、60min实验大鼠舔后足的潜伏期。以(给药后痛阈-基础痛阈)/基础阈值×100%计算阈值提高百分比。
1.3 统计学分析
采用SPP22.0软件进行统计分析。体质量、食物和纯水的消耗变化以及CUMS模型大鼠甩尾潜伏期、添足潜伏期变化比较采用重复测量的方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 CUMS大鼠抑郁症模型的建立
与NC组相比,CUMS模型组大鼠体质增长量显著降低,差异有统计学意义(F处理因素=49.36,P<0.05);单位体重24h消耗的饲料显著降低,差别有统计学意义(F处理因素=27.20,P<0.05);24h内对纯水的消耗量也显著降低,差别有统计学意义(F处理因素=50.29,P<0.05);大鼠的水平运动得分、垂直运动得分以及糖水消耗百分比均显著降低,差别有统计学意义(P<0.05)。大鼠长期受到多种应激刺激后体重降低、厌食、情绪低落、自主运动能力下降、快感缺乏(对糖水等奖赏刺激的感知能力降低)等,产生抑郁样症状,由此可以看出CUMS抑郁症大鼠模型建立成功。见表1~4。
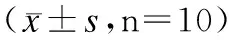
表1 NC组与CUMS模型组大鼠体质量变化
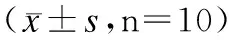
表2 NC组与CUMS模型组大鼠食物耗量变化比较
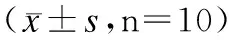
表3 NC组与CUMS模型组大鼠纯水耗量变化比较
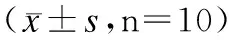
表4 NC组与CUMS模型大鼠W5时自主运动以及糖水消耗百分比变化比较
2.2 OA对CUMS模型大鼠痛阈的影响
与 CUMS+NS组相比,CUMS+OA组大鼠的甩尾潜伏期显著增加,差别有统计学意义(F处理因素=22.12,P<0.05);添足潜伏期也显著增加,差别有统计学意义(F处理因素=72.21,P<0.05)。说明OA能够显著提高CUMS大鼠模型的痛阈。见表5~6。
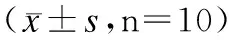
表5 CUMS+NS与CUMS+OA组大鼠辐射热甩尾实验结果比较
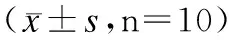
表6 CUMS+NS与CUMS+OA组大鼠添足实验结果比较
3 讨论
抑郁症是临床上常见的精神疾病。据报道中国人群抑郁症发病率已高达6%,严重危及人们的公共健康问题[7]。抑郁症患者除常见的情绪低落、快感缺乏等主要情感症状外,还多伴有非特异的躯体症状,如大约2/3的患者伴有不同程度的疼痛性躯体症状,其中约16.3%的患者因疼痛而引发躯体健康和社会功能受损[8-9]。疼痛不仅会掩盖患者的情绪症状,增加抑郁症早期诊断和治疗的难度,降低患者的生活质量,甚至还会使患者的功能损害加重,增加自杀风险[8]。
1981年Katz等[6]模拟人在社会中不断遇到的非持续、不可预知的刺激而建立了慢性应激模型,该模型对长期抗抑郁药物敏感,并且突出了应激在抑郁症发病中的重要作用。但是该方法需要特殊的仪器设备,操作困难,工作强度大,并且与实际生活中长期低水平应激的抑郁症病因存在一定的差距。因此,我们对Katz法进行改良,尽量避开使用特殊仪器设备和降低应激强度,更多的是去设法模拟社会环境的不良刺激。对抑郁症模型进行检测时不仅评价了大鼠自主运动水平、糖水偏好程度的变化,还进一步综合了其体质量、进食和饮水的变化。本试验结果显示持续轻度刺激4周后,与正常大鼠相比,CUMS模型组大鼠的体质量、饲料和纯水消耗量、自主运动水平以及糖水消耗百分比都显著降低,表现出了抑郁样症状,与抑郁症患者表现出的快感缺乏、厌食、萎靡不振、活动水平降低等抑郁行为相近。
大量的研究证明OA在抑郁症的发生、发展和治疗过程中具有重要作用。食欲素所调节的神经生理活动和行为过程,如睡眠周期、食物摄入量和应急反应等都对抑郁症有重要影响[10]。研究表明OA在抑郁症患者脑脊液和外周血中的表达水平都显著降低[10-11]。OA是食欲素1型受体(OX1R)的天然配体,OA通过激活OX1R发挥其相应的生理功能。在大脑皮层、海马、中缝核以及腹测被盖区等与抑郁样行为调节相关的脑部区域都有OX1R的表达[12]。研究发现,OX1R基因敲除小鼠的焦虑样行为显著增加,并产生多种抑郁样症状[13]。使用OX1R选择性拮抗剂SB-334867后,小鼠在强迫游泳实验中的运动时间和第一轮不动时间潜伏期都降低,表明OX1R活性被抑制后能够增加小鼠的绝望行为[14]。
近年越来越多的研究表明,OA在痛觉调制过程中也可能发挥重要作用。从解剖学方面分析,脊髓背角与背根神经节、延髓头端腹内层网状结构以及中脑导水管周围灰质等不同痛觉调制水平都有下丘脑食欲素能神经纤维的直接神经投射,提示食欲素参与痛觉调制的可能性。在脊髓水平,鞘内注射OA能够减少4%甲醛引起大鼠的添足反应,升高热板实验的阈值,并且该效应能够被SB-334867抑制[15]。本试验结果显示,侧脑室注射OA能够显著增加CUMS大鼠模型的甩尾潜伏期和添足潜伏期,升高抑郁症大鼠的痛阈,表明OA 不仅在脊髓水平参与痛觉的调制过程,在脊髓上水平也能参与痛阈的调节。OA在脊髓水平上对痛觉的调节具有特异性,能够增加神经痛大鼠的热板阈值,但是却不能增加炎性痛大鼠的热板反应[16]。研究报道,抑郁症伴随的躯体性疼痛的病理生理学机制比较复杂,主要由NE通路、脑网络功能异常、促炎症细胞因子以及P物质等共同发挥作用。而本试验结果只是表明OA在脊髓上水平对CUMS模型大鼠痛觉的抑制,但并不能确定其对疼痛抑制的特异性。
由本文结果可以推测出OA不仅能够改善抑郁症患者情感症状,还可以在脊髓上水平参与患者躯体症状的调节,提高抑郁症患者的痛阈,降低患者对疼痛的感知能力,缓解患者的疼痛症状,为伴疼痛性躯体症状抑郁症的治疗提供新思路。
[1] Strigo IA,Simmons AN,Matthews SC,et al.Increased affective bias revealed using experimental graded heat stimuli in young depressed adults:evidence of "emotional allodynia"[J].Psychosom Med,2008,70(3):338-344.DOI:10.1097/PSY.0b013e3181656a48.
[2] Br KJ,Greiner W,Letsch A,et al.Influence of gender and hemispheric lateralization on heat pain perception in major depression[J].J Psychiatr Res,2003,37(4):345-353.DOI:10.1016/s0022-3956(03)00051-7.
[3] Fadel J,Deutch AY.Anatomical substrates of orexin-dopamine interactions:lateral hypothalamic projections to the ventral tegmental area[J].Neuroscience,2002,111(2):379-387.DOI:10.1016/s0306-4522(02)00017-9.
[4] Azhdari Zarmehri H,Semnanian S,Fathollahi Y,et al.Intra-Periaqueductal Gray Matter Microinjection of Orexin-A Decreases Formalin-Induced Nociceptive Behaviors in Adult Male Rats[J].The Journal of Pain,2011,12(2):280-287.DOI:10.1016/j.jpain.2010.09.006.
[5] 徐超,白波.食欲素A 与神经系统相关疾病研究进展[J].济宁医学院学报,41(2):146-149.DOI:10. 3969 /j. issn. 1000-9760. 2018. 02. 016.
[6] Katz RJ,Roth KA,Carroll BJ.Acute and chronic stress effects on open field activity in the rat:implications for a model of depression[J].Neurosci Biobehav Rev,1981,5(2):247-251.DOI:10.1016/0149-7634(81)90005-1.
[7] Gu L,Xie J,Long J,et al.Epidemiology of major depressive disorder in mainland china:a systematic review[J].PLoS ONE,2013,8(6):e65356.DOI:10.1371/journal.pone.0065356.
[8] Jaracz J,Gattner K,Jaracz K,et al.Unexplained Painful Physical Symptoms in Patients with Major Depressive Disorder:Prevalence,Pathophysiology and Management[J].CNS Drugs,2016,30(4):293-304.DOI:10.1007/s40263-016-0328-5.
[9] Husain MM,Rush AJ,Trivedi MH,et al.Pain in depression:STAR*D study findings[J].J Psychosom Res,2007,63(2):113-122.DOI:10.1016/j.jpsychores.2007.02.009.
[10] Brundin L,Bjrkqvist M,Petersén A,et al.Reduced orexin levels in the cerebrospinal fluid of suicidal patients with major depressive disorder[J].Eur Neuropsychopharmacol,2007,17(9):573-579.DOI:10.1016/j.euroneuro.2007.01.005.
[11] Brundin L,Petersén A,Bjrkqvist M,et al.Orexin and psychiatric symptoms in suicide attempters[J].J Affect Disord,2007,100(1-3):259-263.DOI:10.1016/j.jad.2006.10.019.
[12] Marcus JN,Aschkenasi CJ,Lee CE,et al.Differential expression of orexin receptors 1 and 2 in the rat brain[J].J Comp Neurol,2001,435(1):6-25.DOI:10.1002/cne.1190.
[13] Abbas MG,Shoji H,Soya S,et al.Comprehensive Behavioral Analysis of Male Ox1r (-/-) Mice Showed Implication of Orexin Receptor-1 in Mood,Anxiety,and Social Behavior[J].Front Behav Neurosci,2015,9:324.DOI:10.3389/fnbeh.2015.00324.
[14] Scott MM,Marcus JN,Pettersen A,et al.Hcrtr1 and 2 signaling differentially regulates depression-like behaviors[J].Behav Brain Res,2011,222(2):289-294.DOI:10.1016/j.bbr.2011.02.044.
[15] Bingham S,Davey PT,Babbs AJ,et al.Orexin-A,an hypothalamic peptide with analgesic properties[J].Pain,2001,92(1-2):81-90.DOI:10.1016/s0304-3959(00)00470-x.
[16] Yamamoto T,Saito O,Shono K,et al.Activation of spinal orexin-1 receptor produces anti-allodynic effect in the rat carrageenan test[J].Eur J Pharmacol,2003,481(2-3):175-180.DOI:10.1016/j.ejphar.2003.09.022.
