PES1蛋白在乳腺癌组织中的表达及临床意义
2018-06-14李树霞孔庆暖黄维清甄宏伟任永昌
李树霞 孔庆暖 黄维清△ 甄宏伟 任永昌
(1青岛大学医学院,青岛 266000;2临沂市中心医院,沂水 276410;3青岛市立医院,青岛 266000)
乳腺癌是女性常见恶性肿瘤,统计显示其发病率明显上升,位于女性恶性肿瘤的第二位[1],且发病越来越年轻化[2]。乳腺癌是激素依赖性肿瘤,多项研究表明雌激素在乳腺癌的发生发展过程中起了重要作用[3-9]。核仁蛋白(Pescadillo,PES1)主要分布于细胞的核仁中,也少量分布于胞浆[10-11]。已有实验证实PES1在胃癌和结肠癌中的表达水平升高[12]。早在2007年,Zhang H等[13]通过Western blot检测到乳腺癌组织中PES1的表达明显高于癌旁。最近研究报道显示PES1在多种乳腺癌细胞系中的mRNA及蛋白表达水平都明显升高,而且在临床分期Ⅰ到Ⅳ期的原发性乳腺癌中均发现PES1表达水平显著升高[11]。为乳腺癌治疗及靶向药物的研发提供新的思路和方向,本文将应用免疫组化方法检测PES1蛋白在乳腺癌中的表达,分析PES1蛋白与乳腺癌组织雌激素受体(estrogenreceptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)表达之间的关系,并结合患者年龄、病理分型、组织学分级等分析PES1蛋白表达与临床病理特征之间的关系,以期发现PES1蛋白在乳腺癌发生发展过程中的重要作用。
1 资料和方法
1.1 一般资料
收集临沂市中心医院2015年12月30日至2016年5月23日手术切除乳腺癌的标本。所有蜡块均常规中性福尔马林固定,石蜡包埋,采用4μm连续切片, 经HE染色后,由两名高年资病理诊断医师进行读片。选取病理诊断为浸润性癌的60例石蜡标本作为实验组,其中浸润性癌,非特殊型36例,小叶癌22例,特殊类型癌2例,用癌旁组织作为对照。采用 Scarff-Bloom-Richardson 分级系统[14],根据乳腺癌组织中腺管形成与否、细胞核的多形性、异型性和核分裂像3项指标进行分级,腺管形成的能力:1)整个肿瘤可看到为1分;2)不容易发现为3分;3)1分与3分之间为2分;细胞核的多形性:1)核规则、相当于乳腺上皮为1分;2)核明显不规则,明显多形和异型为3分;3)1分与 3分之间为2分;核分裂数(×400):1)1/10 HPF为1分;2)2/10 HPF为2分;3)大于2/10 HPF为3分。 3 项指标的分数相加,Ⅰ级为3~5分,Ⅱ级为6~7 分,Ⅲ级为8~9 分。
1.2 主要仪器 和试剂
HM200 型切片机(MICROM公司,德国)、显微镜BX53(日本奥林巴斯)、一抗为兔多克隆抗体PES1(1∶200 Abcam公司 ab72539 )、单克隆兔抗人雌激素受体ER(1∶200基因科技 GT205607)、单克隆兔抗人孕激素受体PR(1∶200 基因科技 GT205707)、单克隆兔抗人C-erbB-2癌蛋白(1∶200 基因科技 GT210007)。
1.3 实验方法
应用SP免疫组织化学染色法:石蜡切片脱蜡、水化,PBS冲洗3min×3次;非特异性染色剂阻断10min,PBS缓冲液冲洗3min×3次 ;高温高压抗原修复; 3%H2O2去除内源性酶,加入动物血清封闭,加第一抗体,4℃冰箱过夜;PBS冲洗3min×3次;加聚合物增强剂(试剂A),室温下孵育20min; PBS冲洗3min×3次;加新配制的DAB显色液,显微镜下观察3~10min,阳性显色为黄色;自来水冲洗,苏木素复染,0.1%盐酸分化,自来水冲洗,PBS冲洗返蓝;梯度酒精脱水干燥,中性树脂封片。
1.4 结果判定
1)PES1结果判定 随机选取十个高倍镜视野,计数阳性表达率,方法是计数阳性细胞的比率,取十个视野的平均数;评分标准:0分为阴性;1分为阳性表达率≤10%;2分为10%~50%;3分为50%~75%;4分﹥75%。根据染色强度评分:0分无棕黄色产物,1分为淡黄色,2分为棕黄色,3分棕褐色。最终评分为二者的乘积,以﹥3分定为免疫反应阳性[15]。
2)ER、PR、Ki67 结果判定 均采用细胞染色阳性的细胞数计算。ER、PR 结果参考 ASCO/CAP激素受体免疫组化检测指南(2010 版),ER、PR<1%肿瘤细胞着色为阴性;ER、PR≥1%肿瘤细胞着色为阳性。Ki67 的结果参考 St.Gallen 乳腺癌共识(2015)以20%为阳性截断值。HER-2结果判定根据乳腺癌 HER-2 检测指南(2014 版)[16]。0:无染色或≤10%的肿瘤细胞呈现不完整、微弱的细胞膜着色;1+:>10%的肿瘤细胞呈现不完整的、微弱的细胞膜染色;2+:>10%的肿瘤细胞呈现不完整和或弱至中等强度的细胞膜染色或≤10%的肿瘤细胞呈现强而完整的细胞膜染色;3+:>10%的肿瘤细胞呈现强而完整的细胞膜染色。分子亚型参考 St.Gallen 乳腺癌共识(2015)根据乳腺癌组织ER、PR、HER-2的表达分为:Luminal A型(ER+,和/或 PR+,HER-2-);Luminal B型(①ER+,和/或PR+,HER-2+,Ki67任何水平;②ER+,和/或PR+,HER-2-,Ki67≥20%);HER-2过表达型(ER-,PR-,HER-2+);三阴性(ER-,PR-,HER-2-)。
1.5 统计学方法
采用SPSS 22.0 软件进行数据处理。
2 结果
2.1 PES1在乳腺癌组织中表达情况
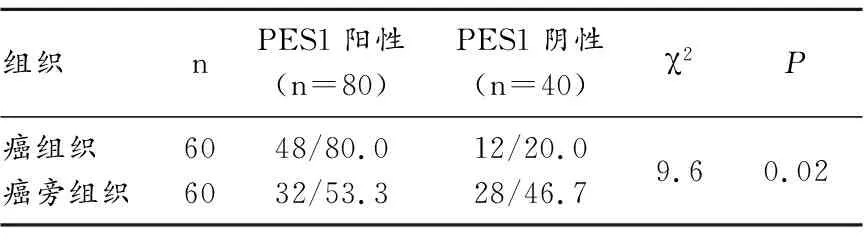
PES1 主要在乳腺癌组织的细胞核中表达,阳性表达时细胞核着色为棕黄色,可呈局部密集分布或弥散分布(图1)。PES1在乳腺癌组织中的表达显著高于癌旁组织,有统计学意义(表1)。

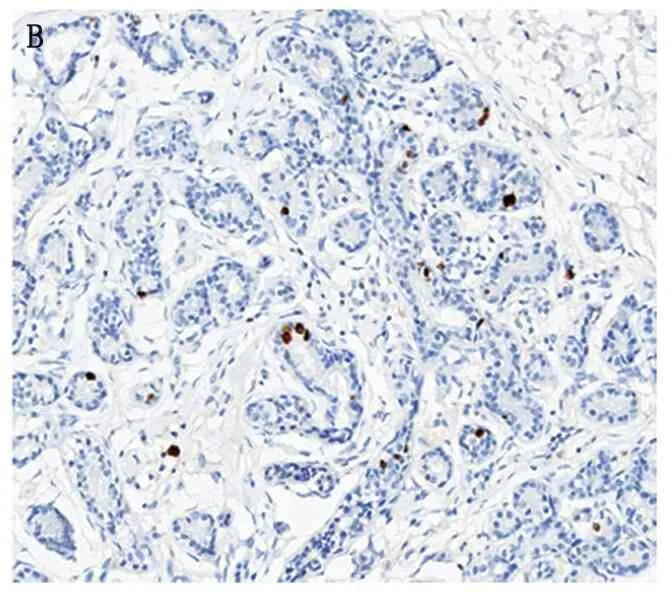
注:A为乳腺癌组织,B为癌旁组织
2.2 PES1与乳腺癌临床病理特征的关系
本文结果表明PES1蛋白的表达与患者年龄,乳腺癌病理分型及组织学学分级均无相关性。见表2。
2.3 PES1与ER、PR、HER-2和Ki67 的关系分析
ER阳性组中,PES1 阳性表达率为90.9%(40/44),ER阴性组中,PES1阳性表达率为50.0%(8/16),PES1的表达水平与ER具有关联性,PES1的表达水平与乳腺癌孕激素受体、HER-2和Ki67的表达无关。见表3。

表2 PES1与临床病理特征之间的关系(n)

表3 PES1与ER、PR、HER-2和Ki67 的关系分析(n)
2.4 PES1与乳腺癌分子亚型的关系
本文结果显示PES1蛋白表达与乳腺癌分子亚型无关。见表4。

表4 PES1与乳腺癌分子亚型的关系分析(n)
3 讨论
乳腺癌是一种发生在乳腺腺上皮细胞的常见恶性肿瘤,近年来发病率迅速上升,严重威胁着女性的健康,乳腺癌具有发病率高和死亡率高的特点,所以乳腺癌的预防和治疗是国内外均急需解决的迫切问题。乳腺癌的发生发展是多基因、多因素和多阶段参与的过程,肿瘤细胞的生物学行为及发生发展过程受诸多因素影响。目前虽然已知乳腺癌发病机制与ER、PR、HER-2等信号通路密切相关,但其具体分子生物学机制尚未明确,对乳腺癌发病机制的深入探讨不仅可以帮助我们理解肿瘤的发生发展特点,还可以通过发现新的生物学靶点为靶向药物的研制提供方向。
PES1 蛋白是一种新近发现的重要的核仁蛋白。研究发现其参与多种肿瘤的发生发展过程,PES1基因如突变或缺陷,可导致细胞周期阻滞[17]。近年来,人们越来越多的关注到PES1在诸多肿瘤发生发展过程中发挥的作用[18-19],并发现PES1在乳腺癌中有表达。April H用雌激素(E2)刺激人乳腺癌细胞的实验方法进行的基因筛查,发现表达显著变化的基因中存在PES1并且证明PES1在乳腺癌中表达可能受到雌激素水平的影响,进一步说明PES1与乳腺癌的发生有着密切关系。研究表明[20],ERα阳性的乳腺癌细胞中,PES1的转录活性与ERα的蛋白表达呈正相关而与ERβ的蛋白表达呈负相关,有可能PES1通过ER调节参与 E2信号通路的调控。本文我们对于PES1的表达水平和ER有关联性,并且PES1的表达明显高于癌旁组织,PES1蛋白可能通过参与ER激素受体通路促进肿瘤的发生发展及增殖。
本文结果表明,乳腺癌组织PES1阳性表达48例(80.0%),癌旁组织PES1阳性表达32例(53.3%),PES1癌组织表达显著高于癌旁组织(P=0.02)。本文结果与2007年Zhang等[13]通过Western blot检测发现乳腺癌组织中PES1的表达明显高于癌旁的结果相符合。我们分析了PES1蛋白表达与临床病理参数间的关系,结果表明PES1蛋白的表达水平与患者年龄、病理分型及组织学分级均无关。同时本文结果还表明, PES1蛋白的表达水平与乳腺癌分子亚型无关。而在研究PES1蛋白与激素受体关系时结果显示, ER阳性组中,PES1 阳性表达率为90.9%,ER阴性组中,PES1阳性表达率为50.0%,PES1的表达水平与ER具有关联性,PES1的表达水平与乳腺癌PR、HER-2和Ki67的表达无关。我们的研究结果不仅进一步证实了PES1蛋白在乳腺癌组织中的高表达,而且在肿瘤组织中证实了PES1蛋白与ER受体表达有关联性,结果表明PES1蛋白可能通过参与ER通路在乳腺癌组织的发病机制中起到重要作用。
总之,本文通过免疫组化方法检测乳腺癌组织中PES1蛋白的表达及与临床病理特征、激素受体之间的关系进一步明确了PES1蛋白促进肿瘤细胞增殖的重要作用,同时通过PES1蛋白与ER受体的正相关性我们推测PES1蛋白可能通过参与ER相关通路参与乳腺癌的发生和发展,也为靶向药物的研发提供新的思路。
[1] McCarthy AM,Yang J,Armstrong K.Increasing disparities in breast cancer mortality from 1979 to 2010 for US black women aged 20 to 49 years[J].Am J Public Health,2015,105 Suppl 3:S446-S448.DOI:10.2105/AJPH.2014.302297.
[2] Roth JA,Etzioni R,Waters TM,et al.Economic return from the Women's Health Initiative estrogen plus progestin clinical trial:a modeling study[J].Ann Intern Med,2014,160(9):594-602.DOI:10.7326/M13-2348.
[3] Lamb J,Ladha M H,McMahon C,et al.Regulation of the functional Interaction between Cyclin D1 and the estrogen receptor[J].Molecular and Cellular Biology,2000,20(23):8667-8675.DOI:10.1128 / mcb.20.23.8667-8675.2000.
[4] Toyama T,Iwase H.p33ING1b and estrogen receptor (ER) alpha[J].Breast Cancer,2004,11(1):33-37.DOI:10.1007/bf02967999.
[5] Gayther SA,Warren W,Mazoyer S,et al.Germline mutations of the BRCA1 gene in breast and ovarian cancer families provide evidence for a genotype-phenotype correlation[J].Nat Genet,1995,11(4):428-433.DOI:10.1038/ng1295-428.
[6] Tilli MT,Reiter R,Oh AS,et al.Overexpression of an N-terminally truncated isoform of the nuclear receptor coactivator amplified in breast cancer 1 leads to altered proliferation of mammary epithelial cells in transgenic mice[J].Mol Endocrinol,2005,19(3):644-656.DOI:10.1210/me.2004-0106.
[7] Dobrzycka KM,Townson SM,Jiang S,et al.Estrogen receptor corepressors--a role in human breast cancer[J].Endocr Relat Cancer,2003,10(4):517-536.DOI:10.1677/erc.0.0100517.
[8] Shang Y,Brown M.Molecular determinants for the tissue specificity of SERMs[J].Science,2002,295(5564):2465-2468.DOI:10.1126/science.1068537.
[9] Kawai H,Li H,Chun P,et al.Direct interaction between BRCA1 and the estrogen receptor regulates vascular endothelial growth factor(VEGF)transcription and secretion in breast cancer cells[J].Oncogene,2002,21(50):7730-7739.DOI:10.1038/sj.onc.1205971.
[10] Dunham I,Shimizu N,Roe BA,et al.The DNA sequence of human chromosome 22[J].Nature,1999,402(6761):489-495.DOI:10.1038/990031.
[11] Kinoshita Y,Jarell AD,Flaman JM,et al.Pescadillo,a novel cell cycle regulatory protein abnormally expressed in malignant cells[J].J Biol Chem,2001,276(9):6656-6665.DOI:10.1074/jbc.M008536200.
[12] Li J,Yu L,Zhang H,et al.Down-regulation of pescadillo inhibits proliferation and tumorigenicity of breast cancer cells[J].Cancer Sci,2009,100(12):2255-2260.DOI:10.1111/j.1349-7006.2009.01325.x.
[13] Zhang H,Li J,Wang X,et al.The antibody preparation and expression of human Pescadillo[J].Sci China C Life Sci,2007,50(3):298-304.DOI:10.1007/s11427-007-0045-x.
[14] Zhang R,Chen HJ,Wei B,et al.Reproducibility of the Nottingham modification of the Scarff-Bloom-Richardson histological grading system and the complementary value of Ki-67 to this system[J].Chin Med J(Engl),2010,123(15):1976-1982.
[15] 许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996(04):229-231.
[16] Wolff AC,Hammond ME,Hicks DG,et al.Recommendations for human epidermal growth factor receptor 2 testing in breast cancer:American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update[J].J Clin Oncol,2013,31(31):3997-4013.DOI:10.1200/JCO.2013.50.9984.
[17] Zhang Y,Opresko L,Shankaran H,et al.HER/ErbB receptor interactions and signaling patterns in human mammary epithelial cells[J].BMC Cell Biol,2009,10:78.DOI:10.1186/1471-2121-10-78.
[18] Maiorana A,Tu X,Cheng G,et al.Role of pescadillo in the transformation and immortalization of mammalian cells[J].Oncogene,2004,23(42):7116-7124.DOI:10.1038/sj.onc.1207916.
[19] Killian A,Le MN,Sesboüé R,et al.Inactivation of the RRB1-Pescadillo pathway involved in ribosome biogenesis induces chromosomal instability[J].Oncogene,2004,23(53):8597-8602.DOI:10.1038/sj.onc.1207845.
[20] 李杰萍.PES1与雌激素受体的相互作用及其在乳腺癌中的意义[D].北京:中国人民解放军军事医学科学院,2008.
