产蛋白质类抑菌物质乳酸菌的分离鉴定与抑菌特性研究
2018-06-13任世英丁沈利
任世英,丁沈利,王 玲,刘 飞
(1.淮阴工学院 生命科学与食品工程学院,淮安 223003; 2.淮阴工学院 化学工程学院,淮安 223003;3.江苏省生物质转化与过程集成工程实验室,淮安 223003)
食品安全及食品中防腐剂的安全性等问题引起了人们的高度关注,使用化学防腐剂有许多副作用,因此,从天然食品中获取抑菌剂来抑制食品中腐败菌和病原菌,从而延长食品保质期和加强食品安全性,已经成为食品加工领域迫切需要解决的问题[1]。
乳酸菌是一类能利用可发酵碳水化合物产生大量乳酸的细菌通称。除极少数外,其中绝大部分都是人体内必不可少的且具有重要生理功能的菌群,其广泛存在于人体的肠道中,肠内乳酸菌与健康长寿有着非常密切的关系。乳酸菌可以从传统的发酵产品中分离获得,其在生长过程中会产生多种代谢产物,如有机酸、过氧化氢、双乙酞、细菌素等,这些代谢产物有重要的功能,对常见的腐败菌和病原菌有明显的抑制作用,其中细菌素的研究引起人们重视,因其具备无毒性、高活性、对热稳定、易被人体消化道中的蛋白酶降解、在人体中无残留等优点,目前被广泛用作食品的天然防腐剂和饲料添加剂,有良好的应用前景[2]。
20世纪中期人们研究大肠杆菌时发现V菌株对φ菌株有明显的抑制作用,将该类物质分离纯化后称为大肠杆菌素,后来又将这类物质称为细菌素。随着对细菌素的深入研究,人们提出,细菌素是某些种类的细菌通过核糖体合成机制产生、能释放到环境中的一类具有抑菌活性的蛋白或多肽类物质,其抑菌范围不仅仅局限于亲缘关系较近的种,对亲缘关系较远的某些菌类也有抑制作用[3],此外,细菌素对产生菌没有抑制作用[4]。
本研究从传统发酵泡菜中通过透明圈法分离乳酸菌,筛选出具有较高抑菌活性的菌株,对其菌体形态、部分生理生化特性、抑菌特性进行研究,通过16S rDNA对其进行鉴定。以期开发具有新型生物防腐剂功能的乳酸菌,并为乳酸菌所产抑菌物质的商业化应用提供基础材料和理论依据。
1 材料与方法
1.1 材料
1.1.1 样品来源:市售泡菜。
所用EscherichiacoliTOP10为实验室保存,用LB培养基进行培养。
指示菌:大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)和枯草芽孢杆菌(Bacillussubtilis),实验室保存。
1.1.2 试剂
PCR用试剂、TaqDNA聚合酶、PCR产物纯化试剂盒、pGM-T克隆试剂盒、质粒抽提试剂盒、MspI酶切试剂盒购自上海生工生物工程有限公司,合成引物、序列测定由上海生工生物工程有限公司完成,其他药品和试剂为国产分析纯。
1.1.3 培养基[3]
MRS培养基:蛋白胨10 g,酵母膏5 g,牛肉膏10 g,乙酸钠5 g,柠檬酸二铵2 g,葡萄糖20 g,吐温-80 1 mL,磷酸氢二钾2 g,MnSO4·4H2O 0.25 g,MgSO4·7H2O为0.58 g,碳酸钙30 g,蒸馏水至1 L,pH 6.2~6.4,琼脂粉15 g,115℃灭菌20 min。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨5 g,NaCl 为3 g,蒸馏水至1 L,pH 7~7.2,115℃灭菌20 min。
石蕊牛奶培养基:牛奶培养基(脱脂奶粉10 g,加水至100 mL),每100 mL中加入2.5 mL石蕊乙醇溶液(石蕊20 g,研磨后置锥形瓶中,加入体积分数为40%乙醇150 mL,煮沸1 min,倒出上层液,再加入40%乙醇150 mL,煮沸1 min,倒出上层液,与第1次倒出液合并,再以体积分数40%乙醇加至300 mL,滴加浓度为1 mol/L盐酸,边加边振荡,至溶液变紫色为止,pH 6~8),混匀,取5~10 mL分装于试管中,115°C灭菌20 min。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水至1 L,pH 7~7.2,121°C灭菌15 min。
1.2 方法
1.2.1 乳酸菌的初筛
吸取1 mL泡菜汤,加入装有9 mL无菌水的试管中,混匀,制成10-1稀释菌悬液,依照上述操作制备10-2、10-3、10-4和10-5的稀释液[5]。吸取10-4和10-5的菌悬液各100 μL涂布含有碳酸钙的MRS固体培养基,37℃培养18 h。挑取有碳酸钙溶解圈的菌落进行过氧化氢实验测试,将过氧化氢实验呈阴性的菌落,经过3次划线分离纯化,然后点种固体MRS平板,每皿点种6个,培养24 h后,待长出菌落,取出备用[6]。
1.2.2 乳酸菌的复筛
用牛肉膏蛋白胨液体培养基将指示菌进行培养,适温培养20 h,吸取100 μL菌悬液,与温度大约45℃左右的5 mL牛肉膏蛋白胨固体培养基混合均匀,马上倒入上述点种有初筛乳酸菌的平板上,37℃培养12 h,根据点种乳酸菌菌落周围能否形成抑菌圈来判断初筛乳酸菌能否产生抑菌性物质[7]。将抑菌圈形成明显的初筛乳酸菌菌株接种于5 mL的MRS液体培养基,37℃培养18 h,在MRS固体培养基上划线,分离3次以上获得纯化的菌株,挑取单菌落镜检,观察菌体形态。
1.2.3 乳酸菌的形态特征及鉴定
1)乳酸菌的形态观察。将分离到的乳酸菌接种于固体培养基平板,观察菌落的形态和颜色变化。挑取菌落细胞均匀涂布于载玻片,染色后用10×100倍油镜观察菌体。
2)乳酸菌的16S rDNA鉴定[7]。参照《伯杰氏细菌鉴定手册》及《乳酸细菌分类鉴定及实验方法》[8]对菌株进行初步鉴定。
采用反复冻融法提取细菌的总DNA。16S rDNA的通用引物:1492R(5′-GGT TAC CTT GTT ACG ACTT-3′)和27F(5′-AGA GTT TGA TCM TGG CTCAG-3′)。
PCR反应体系(25 μL):模板2 μL,引物1492R 1 μL,引物27F 1 μL,10×扩增缓冲液2.5 μL,dNTP混合液1 μL,TaqDNA聚合酶1 μL,MgCl21.5 μL,补无菌水到25 μL。
PCR扩增程序:94℃预变性5 min;94℃变性30 s,55℃复性30 s,72℃延伸90 s,进行30个循环;最后于72℃再延伸10 min。
取2 μL进行1%琼脂糖凝胶电泳检测,然后将PCR产物采用纯化试剂盒进行纯化,送上海生工生物工程技术服务有限公司进行测序。将所得序列与GenBank中核酸序列数据库进行Blast比对分析,找出相似度高的16S rDNA序列,利用软件MEGA 5.0构建系统发育树,进行系统发育分析。
1.2.4 乳酸菌生长曲线绘制
将乳酸菌接种于液体培养基,37℃摇床200 r/min培养,每隔2 h测其OD570值,然后根据所得OD570值为纵坐标,培养时间为横坐标,绘制生长曲线。
1.2.5 发酵上清液的制备
将菌株进行活化,按1%接种量接种到MRS液体培养基,37℃培养24 h,6000 r/min离心5 min,取出上清液用一次性无菌滤菌器过滤,收集到的液体即为发酵上清液。以下实验所用发酵上清液均采用此方法制备。
1.2.6 指示菌平板的制备
将指示菌斜面菌株,于LB固体平板划线得到单菌落,挑取单菌落接种于装有5 mL LB液体培养基的试管中,培养12 h,然后以无菌生理盐水将3种指示菌分别进行稀释,使菌悬液细胞浓度为105CFU/mL,各取100 μL涂布LB平板,待表面干燥后放置牛津杯,每板放4个,即为指示菌平板。
1.2.7 发酵上清液的pH敏感性
用浓度为1 mol/L的NaOH或HCl溶液调整上清液的pH 2、3、4、5、6、7和8,以未处理的发酵上清液作对照,各取200 μL分别加入到指示菌平板上的牛津杯中,盖上陶瓦盖,4℃条件下扩散2.5 h,最后放入37℃恒温培养箱进行培养,测量抑菌圈的直径,评价发酵上清液的pH敏感性,重复3次。
1.2.8 排除酸的抑制作用[9]
用浓度为1 mol/L的NaOH将发酵上清液pH调至7,以未处理的发酵上清液作对照,各取200 μL分别加入到指示菌平板上的牛津杯中,盖上陶瓦盖,4℃条件下扩散2.5 h,最后放入37℃恒温培养箱进行培养,测量抑菌圈的直径,反映抑菌能力的强弱,以此排除上清液中的酸抑制作用,重复3次。
1.2.9 排除过氧化氢的干扰[10]
取200 μL待测菌株的发酵上清液,于80℃保温10 min,以未处理的发酵上清液作对照,分别加入到指示菌平板上的牛津杯中,盖上陶瓦盖,4℃条件下扩散2.5 h,最后放入37℃恒温培养箱进行培养,测量抑菌圈的直径,反映抑菌能力的强弱,以此排除发酵上清液中过氧化氢的干扰,重复3次。
1.2.10 发酵上清液中抑菌物质蛋白质特性的确定
将胰蛋白酶、木瓜蛋白酶和胃蛋白酶分别溶解在浓度为50 mmol/L的磷酸缓冲液(pH 7)中配成母液,分别加入到20 mL发酵上清液中,使其最终质量浓度为1 mg/mL,在37℃水浴中温浴2 h后取出,加热10 min进行灭酶活处理,将pH调到与初始发酵上清液相同的值,以用磷酸缓冲液稀释相同倍数后的发酵上清液作对照,各取200 μL分别加入到指示菌平板上的牛津杯中,盖上陶瓦盖,4℃条件下扩散2.5 h,最后放入37℃恒温培养箱进行培养,测量抑菌圈的直径,评估抑菌能力的大小,以期反映乳酸菌发酵上清液中抑菌物质对各种蛋白酶的敏感性,确定其蛋白质特性,重复3次。
2 结果与分析
2.1 乳酸菌的筛选
从所取样品中初筛到5株能产生CaCO3溶解圈的乳酸菌,将其标为A1、A2、A3、A4和A5。菌株的菌落形态及革兰氏染色结果如表1所示,菌株均为G+。具有较高活性的菌株在平板上能较快地形成透明圈,从表2得知,菌株A5透明圈直径和菌落直径的比值最大,过氧化氢测试为阴性,同时能在大肠杆菌和金黄色葡萄球菌测试平板上形成抑菌圈,故将其作为实验菌株。
2.2 菌株的部分生理生化特性及鉴定
2.2.1 菌株的部分生理生化特性
菌株A5为兼性厌氧菌,部分生理生化特性:淀粉水解呈阴性,运动性、革兰染色、明胶液化、甲基红实验、葡萄糖氧化发酵和纤维素分解呈阳性。

表1 5株乳酸菌的菌落特征及革兰氏染色结果Table 1 Characteristics of colony and gram staining of 5 LAB strains

表2 5株乳酸菌透明圈直径、菌落直径及其比值Table 2 Diameter of clear circle, colony and their ratio of 5 LAB strains
2.2.2 乳酸菌的鉴定
将菌株A5接种到5~10 mL的石蕊牛奶培养基,37℃培养48 h,石蕊被还原为无色,牛奶呈正常凝固现象,培养基上层表面有紫红色环,鉴定其为乳酸菌。将菌株16S rDNA的PCR扩增产物送到上海生工生物工程技术服务有限公司进行测序,序列长度为1472 bp,如图1。
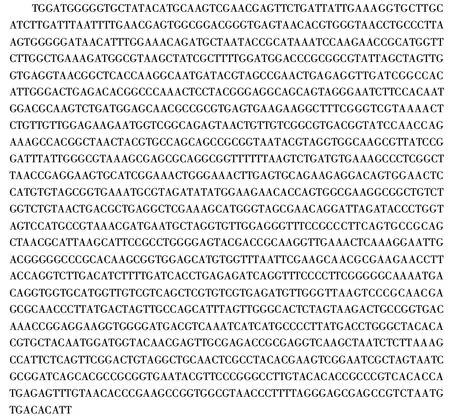
图1 菌株A5的16S rDNA扩增序列Fig 1 16S rDNA sequence of strain A5
2.2.3 系统发育树构建
菌株A5的16S rDNA基因序列,通过GenBank中核酸序列数据库进行Blast比对,与鼠李糖乳杆菌(Lactobacillusrhamnosus)相似度达99%,表明该菌属于鼠李糖乳杆菌属,暂命名为Lactobacillusrhamnosussp.A5,简称为A5。选取相似度高的13个近源乳杆菌的16S rDNA序列,经多重序列对比,用软件MAGE 5.0按Neighbor-Joining法构建系统发育树,结果(见图2)该菌与鼠李糖乳杆菌Lactobacillusrhamnosusstrain JCM 1136同源性最高,相似度为99%。
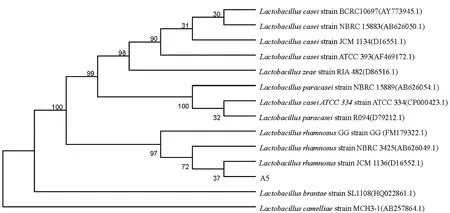
图2 A5的16S rDNA序列系统进化树Fig 2 Phylogenetic tree of strain A5 based on 16S rDNA gene sequences
2.3 菌株生长曲线
由图3可以看出,菌株的延迟期为0~6 h,这是由于细菌进入新的培养条件,需要一个适应环境的时间,不会立即繁殖,此时菌体的代谢机能非常活跃,诱导酶类形成得很快;对数生长期为6~16 h,细菌开始生长繁殖,生长速率迅速增加达最大值,导致细胞数目的对数与培养时间呈直线函数关系;16 h以后属于稳定期,随着微生物的迅速生长繁殖,营养物质被大量消耗,菌体的生长速度下降,此期内细胞的生长速率与死亡速率达到动态平衡,细胞数目达到最大值;在稳定期的末期,由于培养基中的营养物质几乎耗尽,细胞死亡速率增加而使细胞数量显著下降,从而进入衰亡期。
2.4 发酵上清液的pH敏感性
将菌株A5发酵上清液调节至不同pH,通过牛津杯法测定抑菌圈直径的大小,结果如表3所示。在pH为2~5条件下抑菌圈直径较大,随着pH升高,发酵上清液的抑菌圈直径逐渐下降,当pH为8时,几乎未形成抑菌圈。这说明菌株A5所产生的抑菌物质在酸性或弱酸性条件下稳定,能保持较高的抑菌活性。在高pH下抑菌活性丢失,可能是由于pH变化会使抑菌物质构象发生变化,从而引起抑菌活性降低甚至消失。
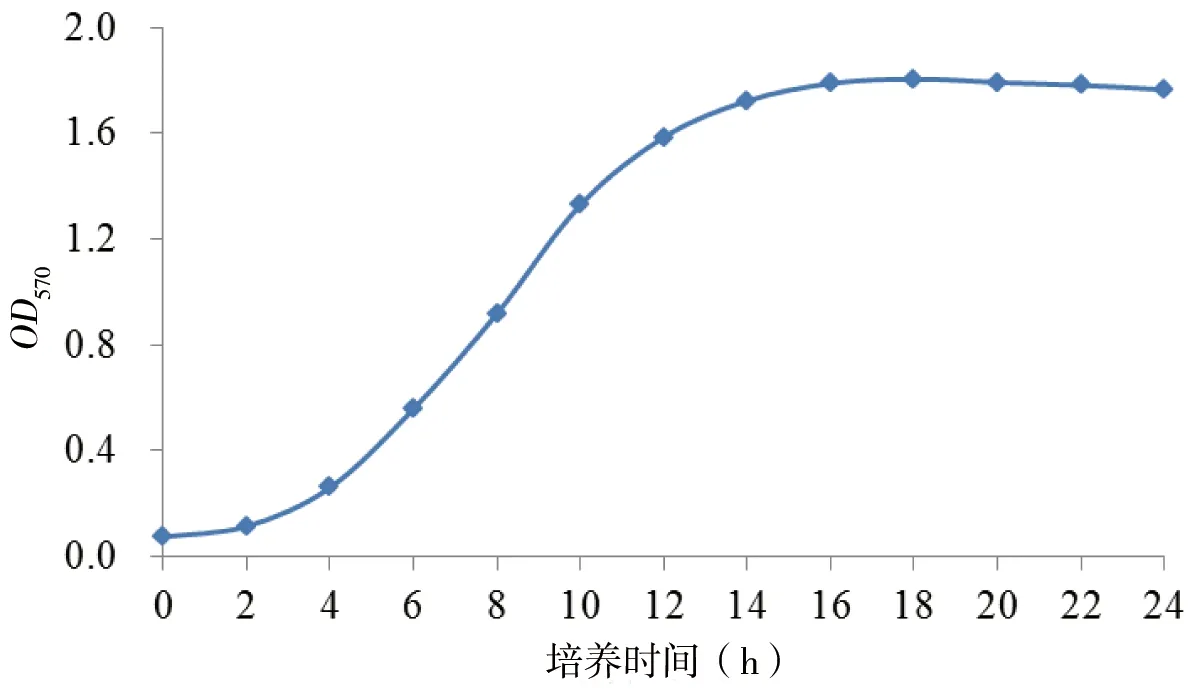
图3 菌株A5的生长曲线Fig 3 The growth curve of strain A5
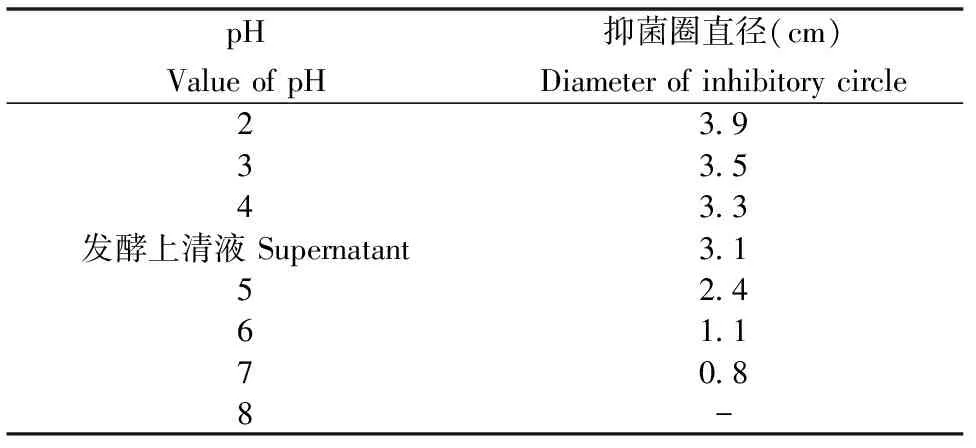
表3 不同pH条件下抑菌圈的直径Table 3 Diameter of inhibitory circle of supernatant under different pH value
“-”表示无抑菌圈产生
2.5 排除酸的抑制作用
用大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌作为指示菌,将实验组的发酵上清液pH调至7,以发酵上清液为对照,通过牛津杯法测定抑菌圈大小。如表4所示,对照组的抑菌圈直径大于实验组的抑菌圈直径,说明乳酸菌的发酵上清液中,有机酸也有抑菌作用,但排除酸作用后,上清发酵液中仍然存在另外的抑菌物质。
2.6 排除过氧化氢的抑制作用
以大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌作为指示菌,以处理的发酵上清液(80℃保温10 min)为实验组,未处理的发酵上清液为对照组进行实验,通过牛津杯法测定抑菌圈大小。结果(如表5)显示,对照组的抑菌圈直径大于实验组的抑菌圈直径,说明乳酸菌的发酵产物中H2O2也有抑菌活性,但将H2O2去除后,发酵液仍然有抑菌活性,说明其中还存在其他的抑菌物质。

表4 发酵上清液、pH调整为7的发酵上清液的抑菌圈直径Table 4 Diameter of inhibitory circle of supernatant and supernatant adjusted pH to 7

表5 发酵上清液和80℃保温处理的发酵上清液的抑菌圈直径Table 5 Diameter of inhibitory circle of supernatant and supernatant treated by heating
2.7 发酵上清液中抑菌物质蛋白质特性的确定
用大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌作为指示菌,以用不同蛋白酶分别处理的发酵上清液为实验组,未处理的发酵上清液为对照组进行实验,通过牛津杯法测定抑菌圈大小。结果(如表6)显示,对照组的抑菌圈直径大于实验组的抑菌圈直径,说明乳酸菌的发酵上清液经过胰蛋白酶、胃蛋白酶、木瓜蛋白酶处理后,抑菌效果减弱,表明发酵产物中存在一类对蛋白酶敏感的蛋白质类物质,该物质对发酵上清液的抑菌效果起主要作用。
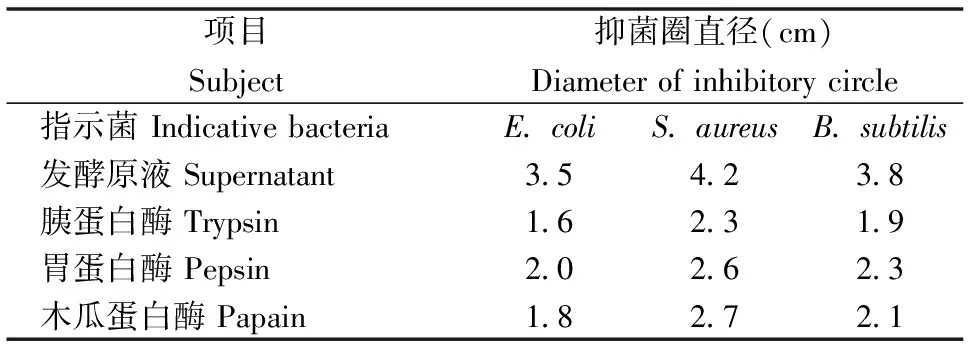
表6 蛋白酶处理后发酵上清液的抑菌圈直径Table 6 Diameter of inhibitory circle of supernatant treated by proteinase
3 讨论
目前已报道的产细菌素的乳酸菌有LGG(LactobacillusrhamnosusGG)、ZJ19[11]及KCA386[12],对李斯特氏菌、枯草芽孢杆菌和多数乳酸菌有抑制作用,但对常见致病菌如金黄色葡萄球菌和革兰氏阴性菌的抑制作用较弱,限制其在食品防腐保鲜加工业中的应用。与LGG所产细菌素相比,菌株A5所产细菌素具有较广的抑菌谱,其所产蛋白质类抑菌物质对常见的金黄色葡萄球菌和大肠杆菌等致病菌、腐败菌均有较好的抑制效果,使其在食品防腐保鲜加工业中的广泛应用成为可能。
本文从泡菜中筛出一株抑菌效果较好的乳酸菌,通过酸排除实验、过氧化氢排除实验和酶敏感实验确定该菌所产抑菌物质除有机酸、过氧化氢等,还有一种蛋白质类物质,即细菌素。对其抑菌特性研究显示:乳酸菌株A5所产细菌素具有较好的耐酸性,在pH 2~5时都有较好的抑菌活性,在pH 2时仍保持稳定的抑菌活性,具有与人体肠道特征相符合的酶敏感性。
4 小结
采用分子生物学手段对菌株A5进行16S rDNA分子鉴定,得到1472 bp的基因序列,同GenBank中核酸序列数据库进行Blast比对后,进行系统发育树分析,结果与鼠李糖乳杆菌(Lactobacillusrhamnosus)相似度达99%,确定该菌株属于鼠李糖乳杆菌属,并将其暂命名为Lactobacillusrhamnosussp.A5。该菌株所产的蛋白质类物质可被蛋白酶降解而不会在体内残留,具有较高的安全性,在抑制各种病原菌和防止食品腐败等方面具有重要意义。后期的研究,需要分离纯化到菌株A5所产抑菌物质(细菌素),并对其生物学活性和安全性进行充分评估,以期开发出新型的天然防腐剂。
[1]彭 浩,邓百万,陈文强,等.虎杖内生真菌产白藜芦醇苷菌株的分离鉴定[J].微生物学通报,2011,38(6):889-894.
[2]ASLIM B,YUKSEKDAG Z N,SARIKAYA E,et al.Determination of the bacteriocin~like substances produced by some lactic acid bacteria isolated from Turkish dairy products[J].Food Science and Technology,2005,38(6):691-694.
[3]朱奇奇,蒲 博,王 周,等.一株降胆固醇乳酸菌的筛选、鉴定及在发酵泡菜中的应用[J].中国调味品,2016,41(5):16-22.
[4]杜胜阳,王斌斌,冯 佳,等.乳酸菌基因敲除技术的研究进展[J].食品与发酵工业,2016,42(1):244-251.
[5]ELAINE M,ALVES V F,FRANCO B.Fundamentals and perspectives for the use of bacteriocins produced by lactic acid bacteria in meat products[J].Food Reviews International,2012,18(2-3):191-208.
[6]HWANHLEM N,JEAB-MARC CHOBERT,ARAN H-KITTIKUN.Bacteriocin-producing lactic acid bacteria isolated from mangrove forests in southern Thailand as potential biocontrol agents in food: isolation, screening and optimization[J].Food Control,2014,41:202-211.
[7]岳喜庆,郭 晨,闵钟熳,等.产Ⅱa类细菌素乳酸菌的筛选、鉴定与生物学特性的研究[J].中国酿造,2010(3):56-59.
[8]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[9]吕好新,王巍东,谈重芳,等.一株产广谱细菌素乳酸菌菌株的筛选及鉴定[J].中国乳品工业,2013,41(10):8-10.
[10]张和平,丁 洁.乳酸菌基因组学研究新进展[J].中国食品学报,2016,16(2):1-8.
[11]王净净,顾 青.1株分泌细菌素屎肠球菌ZJ19的筛选和鉴定[J].中国食品学报,2014,14(1):380-383.
[12]闵钟熳,朱光泽,岳喜庆.不同来源产细菌素乳酸菌的分离筛选及鉴定研究[J].食品研究与开发,2009,30(4):36-39.
