用于增强抗肿瘤功效的共载紫杉醇和基因的壳聚糖衍生物载体
2018-06-13王石,唐翠
王 石,唐 翠
(1.复旦大学 生命科学学院,上海 200438; 2.复旦大学 遗传工程国家重点实验室,上海 200438)
临床治疗恶性肿瘤的方法主要有手术和化疗等,而化疗配合其他疗法已成为肿瘤临床治疗的重要手段[1-3].但化疗药物长期用药后肿瘤细胞出现多药耐药[4-5],药物抗肿瘤功效降低[6-7].肿瘤细胞也可通过调节其复杂的信号通路逃避化疗药物所诱导的细胞凋亡[8].近年,基因治疗已成为治疗恶性肿瘤的一种新手段[9],但肿瘤发生涉及多种基因的改变,对某个或数个基因功能进行干扰难以达到理想治疗效果,如Bcl-2[10].因此,基于化疗药物和基因的联合治疗近年来被广泛用于抗肿瘤研究中,通过靶向肿瘤细胞内多个信号通路,协同增强抗肿瘤功效[11].但常见的化疗药物多为细胞毒性药物,易对正常组织造成毒副作用[12];基因药物等核酸大分子体内稳定性差,体内外转染效率低[13].二者均需借助合适的药物递送载体以改善药物选择性和稳定性,降低毒副作用,增强抗肿瘤功效.纳米递送载体因其较高的靶向性及可显著提高治疗效果而受到广泛关注,常见的纳米递送载体有聚合物纳米粒[14]、无机纳米粒[15]等.
壳聚糖(Chitosan)具有生物相容、生物可降解等特点,已被广泛用作药物递送载体[16].壳聚糖含大量活泼氨基和羟基,接枝疏水基团和亲水基团,可制得两亲性壳聚糖衍生物[17].两亲性壳聚糖衍生物在水中可自组装形成以疏水基团为核心、亲水基团为外壳的核-壳结构纳米粒.疏水修饰可增强纳米粒的稳定性、提高难溶性药物的包封率、增强穿透细胞的能力,如烷基化修饰[18]和油酸(oleic acid)修饰[19].亲水修饰可改善纳米粒的溶解性,提高转染效率,如PEG化修饰[20]和季胺化修饰[21].为提高纳米递送载体的主动靶向能力,可对其进行配体修饰,如叶酸(Folic Acid, FA)修饰[22].
紫杉醇(Paclitaxel, PTX)是一种天然抗肿瘤药物,促进微管蛋白聚合抑制微管蛋白解聚,可使细胞阻滞于G2/M期,从而有效抑制细胞分裂导致细胞死亡,已广泛用于多种实体瘤的治疗[23].Survivin基因是凋亡抑制蛋白(Inhibitor of Apoptosis Protein, AP)基因家族的新成员,编码产物Survivin蛋白既可与半胱氨酸蛋白酶3(Caspase3)、半胱氨酸蛋白酶7(Caspase7)等结合,通过抑制Caspase活性来抑制细胞凋亡;也可与微管蛋白结合,促进细胞增殖分裂,故抑制Survivin蛋白表达可增强肿瘤细胞对PTX等微管靶向类化疗药物的敏感性[24].Survivin shRNA表达质粒(iSur-pDNA)进入细胞核,方可启动基因转录,下调Survivin蛋白表达,发挥基因沉默功效[25].故iSur-pDNA可促进PTX的化疗功效,PTX与iSur-pDNA具协同抗肿瘤作用.
本研究制备了两亲性壳聚糖衍生物OTC(Oleic acid and Trimethyl Chitosan),经叶酸(FA)修饰得到FOTC,以此用作难溶性抗肿瘤药物和基因药物的共递送载体.PTX和iSur-pDNA分别经疏水作用和静电作用包载至纳米粒形成纳米复合物(FOTC/PTX/pDNA NPs),同步递送至病灶部位,体外和体内抗肿瘤试验表明二者有共同的作用靶点可协同发挥抗肿瘤功效.
1 材料与方法
1.1 材料与动物
壳聚糖(脱乙酰度: 85%,分子量: 100kDa)购自浙江金壳生物化学有限公司;油酰氯,购自上海阿拉丁生化科技股份有限公司;碘甲烷购自太仓鑫鹄化工有限公司;异硫氰酸荧光素(FITC)购自Sigma;无内毒素质粒抽提试剂盒购自北京天根生物科技有限公司;PTX购自浙江海正药业有限公司;甘油醛-3-磷酸脱氢酶(GAPDH)抗体、Survivin抗体购自Proteintech,美国;其他试剂均为分析纯.
QGY-7703细胞(人肝癌细胞,购自美国ATCC)以含10%(体积分数)胎牛血清(FBS)、1%(体积分数)谷氨酰胺、1%(体积分数)非必需氨基酸、100U/mL氨苄青霉素和100U/mL链霉素的DMEM培养基,于37℃、5% CO2的培养箱中培养.
昆明小鼠,雌性,体重(20±2)g,购自上海斯莱克实验动物有限公司.
1.2 方法
1.2.1 OTC和FOTC的合成与表征
参照文献[26-27,22]方法分别合成N,N,N-三甲基壳聚糖季铵盐(TMC)、OTC和FOTC.称取适量TMC、OTC和FOTC,分别溶于氘水(D2O)、D2O和D2O与氘代DMSO混合液,AVANCE DMX500型核磁共振仪分别测定样品的核磁图谱.称取适量TMC、OTC和FOTC样品,分别与适量KBr粉末混匀、研磨、压片,NEXUS470型傅立叶变换红外光谱仪测定样品的红外光谱.
1.2.2 纳米粒与纳米复合物的制备与表征
称量OTC和FOTC,分别加入H2O,冰浴下脉冲式超声20min(输出功率220W,工作2s,间歇2s),制得2mg/mL OTC和FOTC纳米粒.
量取50μL 10mg/mL PTX储备液,加5mL 2mg/mL纳米粒溶液,冰浴下脉冲式超声20min(输出功率220W,工作2s,间歇2s),5000r/min离心30min,制得载PTX的OTC/PTX NPs和FOTC/PTX NPs.
2mg/mL OTC和FOTC纳米粒分别与等体积的133μg/mL iSur-pDNA溶液混合,涡旋30s,37℃静置30min,制得载iSur-pDNA的OTC/pDNA NPs和FOTC/pDNA NPs.
2mg/mL OTC/PTX和FOTC/PTX纳米粒分别与等体积的133μg/mL iSur-pDNA溶液混合,涡旋30s,37℃静置30min,制得共载PTX和iSur-pDNA的OTC/PTX/pDNA NPs和FOTC/PTX/pDNA NPs.
透射电子显微镜(TEM)观察纳米粒.Zetasizer Nano-ZS型电位及粒度测定仪测定纳米粒及纳米复合物的粒径和Zeta电势.量取一定体积的裸pDNA或纳米复合物(iSur-pDNA含量为1μg),加入适量溴酚蓝混合均匀,加样至1%琼脂糖凝胶上样孔,120V电泳40min,Gel Safe核酸染料显色,FR-980A生物电泳图像分析系统观察iSur-pDNA条带并拍照.
参照文献[28]方法测定纳米复合物的载药量(Loading Capacity, LC)和包封率(Encapsulation Efficiency, EE).
1.2.3 体外释放
参照文献[28]方法测定纳米复合物的PTX体外释放;参照文献[29]方法制备异硫氰酸荧光素(FITC)标记iSur-pDNA,制备含FITC-iSur-pDNA的纳米复合物,分别量取30μL OTC/pDNA NPs、OTC/PTX/pDNA NPs和FOTC/PTX/pDNA NPs,13300r/min离心30min,弃上清,沉淀加入200μL PBS(pH 7.4,0.2mol/L),重悬分散,37℃、100r/min恒温震荡,分别于1、2、4、6、8、10、12、24、36、48、60和72h吸取50μL释放介质,同时补充50μL新鲜介质,13300r/min离心30min,取上清液,酶标仪测定FITC-pDNA含量(λex=488nm,λem=519nm),计算pDNA浓度和累积释放百分率(η累积释放,%),绘制释放曲线.
1.2.4 细胞毒性
QGY-7703细胞以1×104/孔的密度接种至96孔板,37℃、5% CO2培养24h.每6孔为一组,每组分别加入适量OTC和FOTC纳米粒,使终浓度分别为0.02、0.05、0.1、0.2和0.5mg/ml,以0.2mol/L磷酸盐缓冲液(PBS,pH 7.4)为阴性对照,37℃、5% CO2培养72h.吸弃孔内液体,每孔分别加入200μL新鲜培养基和20μL以0.2mol/L PBS(pH 7.4)配制的5mg/mL MTT溶液,37℃、5% CO2培养4h.吸弃孔内液体,每孔加入200μL DMSO,37℃、100r/min振摇至甲瓒完全溶解,酶标仪测定570nm处吸光值.以阴性对照组吸光值为100%细胞存活率,计算各试验组细胞存活率(η细胞存活,%).
1.2.5 细胞摄取
参照文献[22]方法制备罗丹明B(RhB)标记PTX,QGY-7703细胞以1×105/孔的密度接种至24孔板,37℃、5% CO2培养24h.每3孔为一组,分别加入100μL纳米复合物(1mg/mL),37℃、5% CO2培养4h.吸弃孔内液体,0.2mol/L PBS(pH 7.4)洗涤3次,加入0.5mL 0.5 %(质量浓度)SDS溶液(pH 8.0),37℃、100r/min振荡培养30min以裂解细胞.酶标仪测定细胞裂解液中RhB-PTX(λex=560nm,λem=590nm)和FITC-pDNA含量Lowry法测定蛋白含量.细胞摄取量以每毫克蛋白对应的pDNA量(mpDNA,μg)和PTX量(mPTX,μg)表示.
1.2.6 体外转染
QGY-7703细胞以2×105/孔的密度接种至6孔板,37℃、5% CO2培养24h,更换新鲜无血清培养基,每孔分别加入100μL裸pDNA(66.5μg/mL)或100μL纳米复合物(1mg/mL),37℃、5% CO2继续培养4h,以不加裸pDNA和纳米复合物的孔为对照.吸弃孔中液体,每孔加入2mL培养基(含10% FCS),37℃、5% CO2继续培养68h.吸弃孔内液体,加入200μL RIPA缓冲液,4℃避光条件下裂解20min.收集裂解液,13300r/min离心10min,吸取200μL上清,加50μL蛋白上样缓冲液,沸水浴煮10min.加样20μL至聚丙烯酰氨凝胶(12%)上样孔,80V电泳2h.转膜至PVDF膜,浸入30mL脱脂牛奶(5%(质量浓度)),室温封闭1.5h.50mL Tris-HCL缓冲盐溶液洗涤3次,浸入适量Survivin抗体工作液(以封闭液1∶1000稀释)或GAPDH抗体工作液(以封闭液1∶5000稀释)中,4℃孵育12h.50mL 1× BST洗涤3次,浸入适量辣根过氧化物酶结合的二抗工作液(以封闭液1∶7000稀释)中,37℃孵育2h.50mL 1× TBST洗涤3次,加入2mL ECL Plus显色试剂,G:BOX Chemi XR5仪器曝光蛋白条带观察并拍照.阳性对照为甘油醛-3-磷酸脱氢酶(GAPDH)内参蛋白.
1.2.7 肿瘤细胞增值抑制
QGY-7703细胞以1×104/孔的密度接种至96孔板,37℃、5% CO2培养24h.每6孔为一组,分别加入适量纳米复合物和PTX注射液,使孔内PTX终浓度分别为0.005、0.01、0.05、0.1和0.5μg/mL,以加入0.2mol/L PBS(pH7.4)的细胞为阴性对照,37℃、5% CO2分别培养24h、48h和72h.吸弃孔内液体,每孔分别加入200μL新鲜培养基和20μL以0.2mol/L PBS(pH 7.4)配制的5mg/mL MTT溶液,37℃、5% CO2培养4h.吸弃孔内液体,每孔加入200μL DMSO,37℃、100r/min振摇至甲瓒完全溶解,酶标仪测定570nm处吸光值.以阴性对照组吸光值为100%细胞存活率,计算各试验组细胞存活率和半数抑制浓度(IC50).
1.2.8 细胞凋亡
QGY-7703细胞以密度为2×105/孔接种至6孔板,37℃、5% CO2培养24h,每孔加入90μL PTX注射液(40μg/mL)或纳米复合物(100μg/mL),37℃、5% CO2继续培养24h.吸弃孔内液体,1mL PBS(pH 7.4,0.2mol/L)洗涤1次,适量胰酶消化30s,加入1mL新鲜培养基,混匀;1500r/min离心5min,吸弃上清,加入PBS(pH 7.4,0.2mol/L),混匀;1500r/min离心5min,吸弃上清,加入100μL结合缓冲液(1×Binding Buffer),混匀;分别加入5μL Annexin V-FITC和5μL碘化丙啶(PI),混匀,室温避光条件下静置10min.加入400μL结合缓冲液,混匀,FACS Caliber型流式细胞仪测定细胞凋亡率.以未加PTX注射液和纳米复合物的细胞为空白对照.
1.2.9 体内抗肿瘤功效
无菌环境下,抽取H-22肝癌腹水鼠的腹水,置于已灭菌的50mL烧杯中,加入等体积生理盐水,混匀,制得肿瘤细胞悬液.健康昆明小鼠右前肢腋下部位于无菌条件下接种0.2mL肿瘤细胞悬液.游标卡尺测量瘤块长径(L,mm)和短径(S,mm),计算肿瘤体积(Vt,mm3),Vt=(L×S2)/2,待其长至150mm3时,随机分组,以便进行后续实验.
42只H-22雌性肝癌小鼠,随机分为7组,每组6只,分别尾静脉注射给予生理盐水、空白OTC纳米粒、PTX注射液、OTC/pDNA NPs、OTC/PTX/pGL NPs、OTC/PTX/pDNA NPs和FOTC/PTX/pDNA NPs(给药剂量: 按iSur-pDNA计为2.20mg/kg,按PTX计为1.65mg/kg).第一次给药时间设为第0天,隔两天给药,给药4次.隔天测量肝癌小鼠瘤块长径和短径,计算肿瘤体积Vt,绘制肿瘤生长曲线.隔日称量小鼠体重,观察小鼠精神状态.第16d时,处死小鼠,解剖出瘤块,称量瘤块重量并拍照.按以下公式,计算各试验组抑瘤率:
RTI=(mc-mt)/mc×100%,
其中mt为给药组小鼠肿瘤瘤重(g),mc为生理盐水对照组小鼠肿瘤瘤重(g).
2 结果与分析
2.1 OTC和FOTC的制备与表征
图1为FOTC合成路线图.壳聚糖游离氨基上的氢分别被甲基、油酸基团取代,制得两亲性壳聚糖衍生物OTC,水中可自组装形成纳米粒.为增强纳米粒的主动靶向能力,在水与DMSO混合溶剂中,经EDC·HCL/NHS催化,靶向配体FA羟基与OTC游离氨基形成酰胺键连接,制得FOTC.
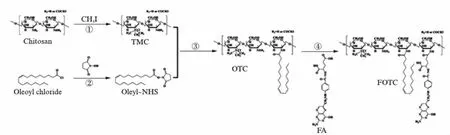
图1 FOTC合成路线Fig.1 Synthetic scheme of FOTC①NaOH,NMP,65℃;②DIEA,THF,0℃;③DMAP,TEA,Dioxane/H2O;④EDC/NHS,DMSO/H2O.
图2(a)为TMC、OTC和FOTC的1H NMR图谱.δ3.26处为壳聚糖上季胺基团的甲基氢峰,表明季胺取代在壳聚糖C-2位氨基上[30].δ0.87、δ1.20处分别为油酸基团末端的甲基氢峰、油酸基团上亚甲基的氢峰,表明油酸基团已连接至TMC[27].δ6.7处的氢峰代表FA芳香族C-NH的氢,δ8.7处的氢峰代表FA的2-异烟酰胺CH的氢,表明FA已成功接枝至OTC[31].
图2(b)为TMC、OTC和FOTC的FTIR图谱.1640cm-1处的信号峰为氨基的反对称伸缩振动峰,1474cm-1处为季铵基团C-H的反对称伸缩振动峰,表明壳聚糖的-NH2发生季铵化取代;1738cm-1为酯键与羧基的C=O伸缩振动峰的叠加峰,表明油酸以酯键接枝至壳聚糖;1508cm-1处吸收峰的出现和1607cm-1处吸收峰的增强,表明FA以酰胺键共价连接至OTC[31].
2.2 纳米粒与纳米复合物的制备与表征
表1为纳米粒、纳米复合物的粒径和Zeta电势以及PTX载药量和包封率,可见粒径为120~160nm,Zeta电势为25~40mV.与纳米粒相比,纳米复合物粒径增大,Zeta电势降低,这是由于纳米粒包载空间位阻较大的PTX进入其疏水核心后,PTX夹在疏水烷基长链间,导致纳米粒内核紧密度下降,粒径增大[32];荷负电pDNA经静电作用交吸附于纳米粒的亲水外壳,导致纳米粒表面游离氨基减少,Zeta电势降低.FOTC/PTX/pDNA纳米复合物粒径和电势无显著变化,表明FA修饰不影响纳米复合物尺度和表面电荷.纳米复合物PTX包封率均大于75%,表明纳米粒可有效包载PTX;FOTC/PTX/pDNA NPs的PTX载药量增加,这是由于FA修饰可增强纳米粒的疏水性,增强纳米粒与PTX间的疏水作用,提高PTX载药量[31].
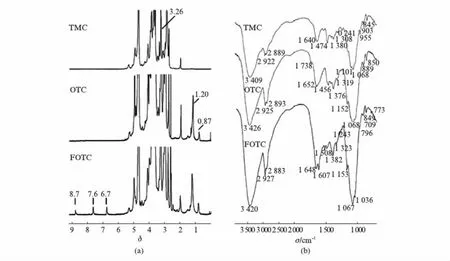
图2 TMC, OTC, FOTC的1H NMR图谱和FTIR图谱Fig.2 1H NMR spectra (a) and FTIR spectra (b) of TMC, OTC and FOTC
注: a,b分别代表OTC与PTX、pDNA的质量比值.
图3(a)(看第176页)为纳米复合物的凝胶电泳图,纳米复合物可完全阻滞iSur-pDNA的迁移,表明纳米粒有效缩合iSur-pDNA.图3(b)(看第176页)为OTC纳米粒的TEM照片,形态为球形,粒径分布均匀,与动态光散射结果吻合.

图3 (a) 质量比15∶1时纳米复合物的凝胶电泳图,(b) OTC纳米粒的TEM图Fig.3 (a) Gel retarding assay of NPs at the weight ratios of 15∶1, (b) TEM images of OTC NPs
2.3 体外释放
图4(a)(看第176页)为PTX从不同纳米复合物中释放36h的累积释放百分率,可见各载药纳米粒均缓慢释放PTX. FOTC/PTX/pDNA NPs的PTX释药速率显著降低,这是由于FA修饰可增强OTC纳米粒与PTX间的疏水作用,减缓PTX从疏水内核向外渗透和扩散[22].
图4(b)(看第176页)为iSur-pDNA从纳米复合物释放72h的累积释放百分率,可见纳米复合物pDNA的释放均为先突释后缓释.FOTC/PTX/pDNA NPs的pDNA释放速率显著增加,这是由于FA修饰可减弱FOTC纳米粒与pDNA间的结合力,加快pDNA向外渗透和扩散.
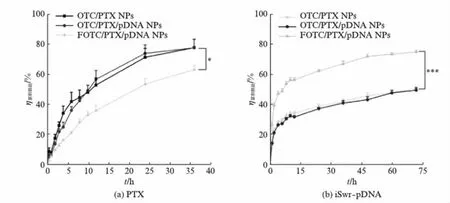
图4 PTX和iSur-pDNA的体外累积释放曲线Fig.4 In vitro release profiles of PTX and iSur-pDNA from NPsn=3.采用Student’s t检验,*P<0.05,***P<0.001.
2.4 细胞毒性
图5(a)为不同浓度的纳米粒与QGY-7703细胞共培养72h后的细胞毒性试验结果,可见在0.02~0.5mg/mL范围时,细胞存活率均超过85%,与对照组相比无显著性差异,表明OTC和FPTC纳米粒不影响正常细胞的代谢活力,细胞毒性小,安全性好,确保了后续细胞试验的可靠性.
2.5 细胞摄取
图5(b)为纳米复合物与QGY-7703细胞共培养4h后细胞摄取量结果,可见PTX和iSur-pDNA的细胞摄取趋势相似,表明二者共载于纳米粒,同步递送进入细胞,确保PTX和iSur-pDNA联合给药的合理.FA修饰后,QGY-7703细胞对纳米复合物的摄取量增加更显著,这是由于FA受体在QGY-7703细胞表面高表达,通过配体-受体介导的主动靶向作用,促进肿瘤细胞对纳米复合物的摄取.
2.6 体外转染
图5(c)为纳米复合物转染QGY-7703细胞72h后Survivin蛋白的表达水平,可见对照组和试验组的GAPDH表达量相同,与对照组、裸pDNA组相比,OTC/pDNA NPs组的Survivin蛋白表达量显著减少,表明pDNA经纳米粒包载后可提高体外转染效率,介导高效的体外基因沉默;FOTC/pDNA NPs组Survivin蛋白表达量较少,表明FA靶向可介导更为高效的体外基因沉默.
2.7 肿瘤细胞增值抑制
图5(d)为QGY-7703细胞与不同浓度PTX注射液和纳米复合物共培养72h的细胞存活率,可见与游离PTX相比,OTC纳米载体可显著增强PTX对肿瘤细胞增殖的抑制功效.PTX主要与细胞质中微管蛋白结合,作用于细胞周期的G2期和M期,干扰细胞分裂[33-34];iSur-pDNA干扰Survivin mRNA表达,降低Survivin蛋白表达量,抑制肿瘤细胞非泵多药耐药参与者Bcl-2蛋白表达,此外Survivin蛋白也作用于微管,因此抑制Survivin蛋白可提高肿瘤细胞对PTX的敏感性[35-36].由于PTX和iSur-pDNA具有共同的作用靶点且iSur-pDNA可增强PTX的化疗效果,PTX与iSur-pDNA可发挥协同抗肿瘤功效,故与OTC/PTX NPs相比,OTC/PTX/pDNA NPs的IC50较低,肿瘤细胞杀伤效果更显著.FOTC/PTX/pDNA NPs的IC50最低,表明FA修饰可进一步增强纳米复合物的抗肿瘤功效[22].
2.8 细胞凋亡
图5(e)为QGY-7703细胞与PTX注射液或纳米复合物共培养24h后经Annexin V-FITC/PI双染后流式细胞仪检测的细胞分布图.PTX经OTX纳米粒包载后,其凋亡诱导能力显著增强,这是由于载药纳米粒细胞摄取量显著高于游离PTX,可快速达到杀伤肿瘤细胞所需浓度;与OTC/pDNA NPs、OTC/PTX NPs组相比,OTC/PTX/pDNA NPs组的凋亡细胞比例显著增加,这是由于PTX和iSur-pDNA发挥了协同作用,表明联合给药的抗肿瘤功效优于单独给药.FOTC/PTX/pDNA NPs组凋亡细胞比例最高,这是由于FA修饰可增强OTC纳米粒的疏水性,提高PTX包封率;FA修饰可显著提高iSur-pDNA的基因沉默功效,增强与PTX的协同抗肿瘤作用;到达肿瘤部位后,FA可通过配体-受体的主动靶向作用,促进肿瘤细胞对纳米复合物的摄取.
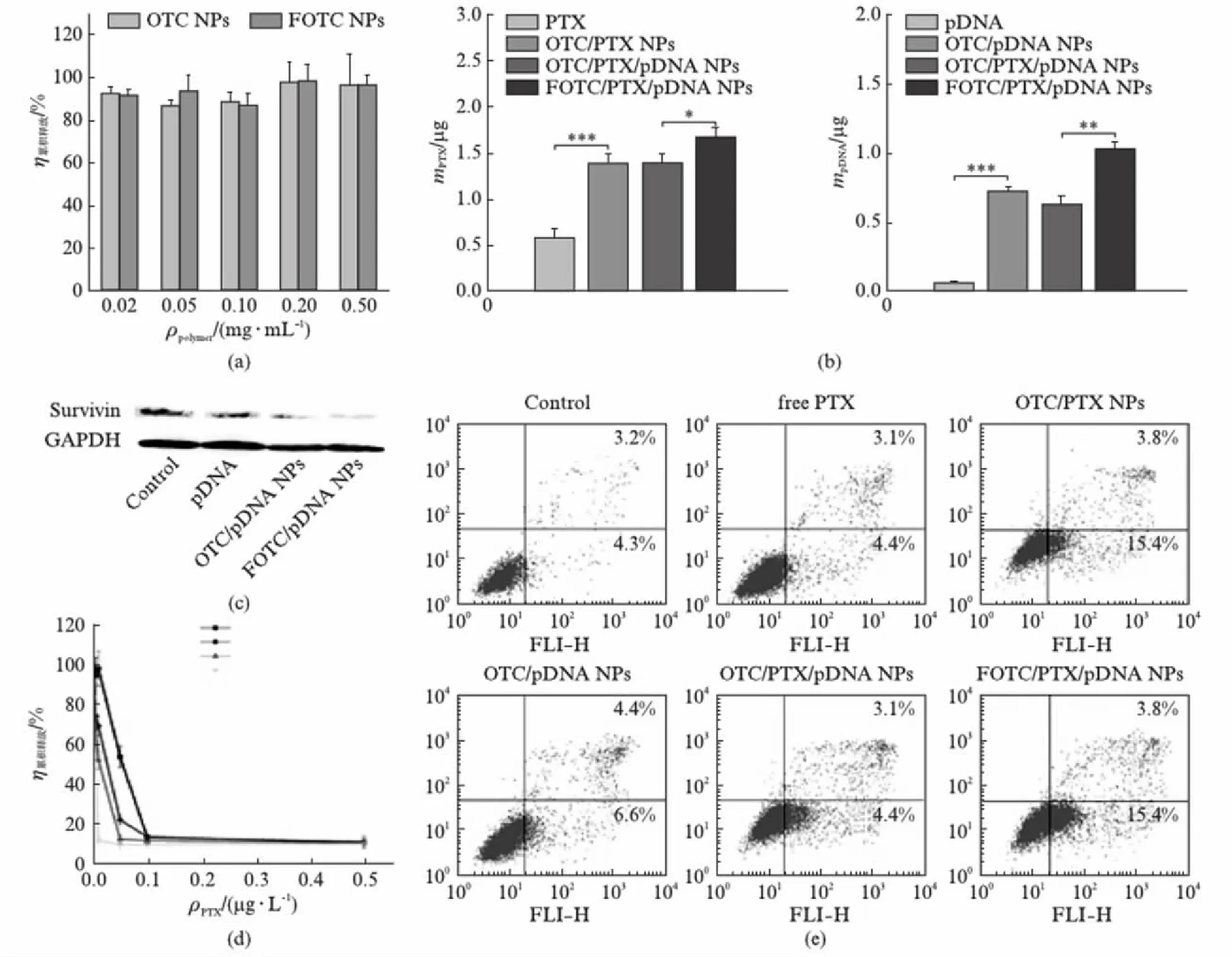
图5 不同浓度下空白OTC纳米粒和FOTC纳米粒与QGY-7703细胞共培养72h后的细胞毒性试验结果Fig.5 In vitro cytotoxicity of blank OTC NPs and FOTC NPs at various concentrations against QGY-7703 cells after 72 h incubation(a) PTX和iSur-pDNA与QGY-7703细胞共培养4h后细胞摄取试验结果(n=3);(b) 采用Student’s t检验,*P<0.05,**P<0.01,***P<0.001.纳米复合物转染QGY-7703细胞72h后Survivin蛋白的表达水平;(c) QGY-7703细胞与不同浓度PTX注射液和纳米复合物共培养72h的细胞存活率(n=6);(d) QGY-7703细胞与PTX注射液或纳米复合物共培养24h后经Annexin V-FITC/PI双染后流式细胞仪检测的细胞分布图(e)
2.9 体内抗肿瘤功效
图6(a)为H-22荷瘤小鼠给药后的体重变化曲线,可见各给药组小鼠体重均增加,且各组间无明显差异,表明小鼠体重增长为自然生长过程.
图6(b)为H-22荷瘤小鼠尾静脉给药后的肿瘤生长曲线,可见OTC空白纳米粒组与生理盐水组肿瘤生长迅速,两者无显著差异.与生理盐水组相比,静脉注射PTX注射液和载药纳米复合物可抑制肿瘤生长,且载药纳米复合物的抑瘤效果更显著,这是由于PTX经OTC纳米粒包载后,可延长其在体内的半衰期,且可通过纳米粒EPR效应被动靶向聚集于肿瘤部位[37],增加肿瘤中PTX的浓度,提高PTX的抗肿瘤功效.与OTC/PTX/pGL NPs、OTC/pDNA NPs相比,OTC/PTX/pDNA NPs组肿瘤生长更为缓慢,表明pDNA与PTX联合给药抗肿瘤效果优于PTX、pDNA单独给药,证明了PTX与pDNA可协同抗肿瘤.与OTC/PTX/pDNA NPs组相比,FOTC/PTX/pDNA NPs组肿瘤生长更为缓慢,表明FA修饰后,主动靶向肿瘤细胞,进一步增加肿瘤中PTX和iSur-pDNA浓度,提高抗肿瘤功效.
图6(c)为给药后16d荷瘤小鼠的肿瘤照片,生理盐水组和空白纳米粒组肿瘤体积大,表面血管丰富;抑瘤效果最显著的FOTC/PTX/pDNA NPs组肿瘤体积小,表面血管较少,呈白色,与周围组织无黏连,易于刨离,表明肿瘤生长受到明显抑制.
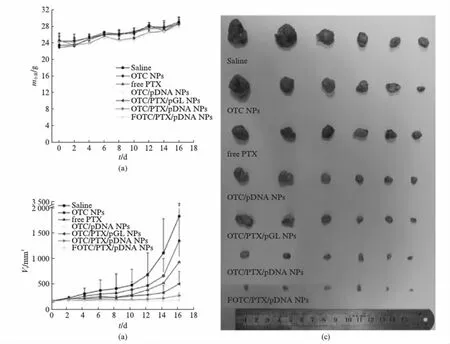
图6 (a)H-22荷瘤小鼠给药后的体重变化曲线(n=6);(b)H-22荷瘤小鼠尾静脉给药后的肿瘤生长曲线(n=6);(c)给药后16d荷瘤小鼠的肿瘤照片.结果以mean±SD表示Fig.6 (a) The variation in body weight of H-22 tumor bearing mice treated with different formulations. Values were shown as mean±SD (n=6); (b) Tumor growth curves of H-22 tumor bearing mice after various formulations treatment. Values were shown as mean±SD (n=6); (c) Photographs of tumor from each treatment group excised on day 16.
表2为H-22荷瘤小鼠给药后16d的瘤重和抑瘤率,可见与生理盐水组相比,OTC空白纳米粒组无显著差异;其他给药组均表现出抗肿瘤功效: FOTC/PTX/pDNA>OTC/PTX/pDNA>OTC/PTX/pGL>OTC/pDNA>PTX injection,与肿瘤生长曲线吻合.

表2 H-22荷瘤小鼠给药后16d的瘤重和抑瘤率
注:n=6.采用Student’st检验,*P<0.05,**P<0.01,***P<0.001.*表示与生理盐水之间的差异,#P<0.05,##P<0.01,#表示与PTX注射液之间的差异.&P<0.05,&&P<0.01.&表示与OTC/PTX/pGL之间的差异.εP<0.05.ε表示与OTC/PTX/pDNA之间的差异.
3 讨 论
本研究采用两亲性壳聚糖衍生物纳米粒共载PTX与iSur-pDNA联合给药,协同发挥抗肿瘤作用,FA修饰可提高主动靶向能力.粒径和Zeta电势影响纳米复合物细胞摄取和生物分布,最终影响其抗肿瘤效果[38-39].纳米复合物粒径约150nm,呈致密球形结构,这有利于避免网状内皮系统的捕获[40].FA修饰后,纳米复合物与PTX的疏水相互作用增强,增加了PTX负载能力,减少了PTX从疏水核心的过早释放,促进了pDNA的释放.到达肿瘤细胞后,纳米复合物的细胞摄取亦可影响抗肿瘤作用[41].经纳米粒包封后,PTX和pDNA的细胞摄取增加,QGY7703细胞上FA受体高表达,FA修饰可显著促进细胞摄取.pDNA的基因沉默效率和体外抗肿瘤活性可反映纳米复合物的递送效果.OTC/pDNA NPs组Survivin蛋白表达水平明显降低,这是由于pDNA经纳米粒包载后细胞摄取提高;FOTC/pDNA NPs组Survivin蛋白表达水平最低,这是由于FA修饰可显著促进细胞摄取.FOTC/PTX/pDNA NPs肿瘤细胞增殖抑制能力最强,这是由于较高的细胞摄取,进入细胞后pDNA的快速释放特征以及PTX与iSur-pDNA协同效应,与细胞凋亡和体外转染试验结果吻合.体内抗肿瘤试验结果,OTC/PTX/pDNA NPs具有更强的体内抗肿瘤功效,这是由于iSur-pDNA和PTX的同步递送进入细胞,协同增强抗肿瘤作用;FOTC/PTX/pDNA NPs抗肿瘤功效最强,这是由于FA修饰提高了PTX的包封率,抑制了PTX的过早释放,加速了pDNA的细胞内解离,且与肿瘤细胞上FA受体相互作用提高细胞摄取.
FOTC共载PTX与iSur-pDNA,具有理想的粒径和Zeta电势,可将PTX和pDNA同步递送进入肿瘤细胞协同发挥抗肿瘤作用.因此,FOTC有望作为PTX和pDNA递送纳米载体用于癌症治疗.
参考文献:
[1] WARD E M, DESANTIS C E, LIN C, et al. Cancer statistics: Breast cancer in situ [J].CACancerJClin, 2015,65(6): 481-495.
[2] SIEGEL R L, FEDEWA S A, MILLER K D, et al. Cancer statistics for Hispanics/Latinos, 2015 [J].CACancerJClin, 2015,65(6): 457-480.
[3] GALL T M, TSAKOK M, WASAN H, et al. Pancreatic cancer: Current management and treatment strategies [J].PostgradMedJ, 2015,91(1080): 601-607.
[4] WANG X, CHEN Y, DAHMANI F Z, et al. Amphiphilic carboxymethyl chitosan-quercetin conjugate with P-gp inhibitory properties for oral delivery of paclitaxel [J].Biomaterials, 2014,35(26): 7654-7665.
[5] ZHANG X, YAO S, LIU C, et al. Tumor tropic delivery of doxorubicin-polymer conjugates using mesenchymal stem cells for glioma therapy [J].Biomaterials, 2015,39: 269-281.
[6] YHEE J Y, SONG S, LEE S J, et al. Cancer-targeted MDR-1 siRNA delivery using self-cross-linked glycol chitosan nanoparticles to overcome drug resistance [J].JControlRelease, 2015,198: 1-9.
[7] SARASWATHY M, GONG S. Different strategies to overcome multidrug resistance in cancer [J].BiotechnolAdv, 2013,31(8): 1397-1407.
[8] CREIXELL M, PEPPAS N A. Co-delivery of siRNA and therapeutic agents using nanocarriers to overcome cancer resistance [J].NanoToday, 2012,7(4): 367-379.
[9] YANG N, EKANEM N R, SAKYI C A, et al. Hepatocellular carcinoma and microRNA: New perspectives on therapeutics and diagnostics [J].AdvDrugDelivRev, 2015,81: 62-74.
[10] YANG G, YIN B. The advance of application for microRNAs in cancer gene therapy [J].BiomedPharmacother, 2014,68(1): 137-142.
[11] DAI X, TAN C. Combination of microRNA therapeutics with small-molecule anticancer drugs: Mechanism of action and co-delivery nanocarriers [J].AdvDrugDelivRev, 2015,81: 184-197.
[12] WAGLAND R, RICHARDSON A, ARMES J, et al. Treatment-related problems experienced by cancer patients undergoing chemotherapy: A scoping review [J].EurJCancerCare(Engl), 2015,24(5): 605-617.
[13] GANDHI N S, TEKADE R K, CHOUGULE M B. Nanocarrier mediated delivery of siRNA/miRNA in combination with chemotherapeutic agents for cancer therapy: current progress and advances [J].JControlRelease, 2014,194: 238-256.
[14] WANG Y, WANG P G. Polysaccharide-based systems in drug and gene delivery [J].AdvancedDrugDeliveryReviews, 2013,65(9): 1121-1122.
[15] WU S H, HUNG Y, MOU C Y. Mesoporous silica nanoparticles as nanocarriers [J].ChemCommun(Camb), 2011,47(36): 9972-9985.
[16] BUSCHMANN M D, MERZOUKI A, LAVERTU M, et al. Chitosans for delivery of nucleic acids [J].AdvDrugDelivRev, 2013,65(9): 1234-1270.
[17] CASETTARI L, VLLASALIU D, LAM J K, et al. Biomedical applications of amino acid-modified chitosans: A review [J].Biomaterials, 2012,33(30): 7565-7583.
[18] LIU W G, ZHANG X, SUN S J, et al. N-alkylated chitosan as a potential nonviral vector for gene transfection [J].BioconjugateChemistry, 2003,14(4): 782-789.
[19] LI Y, ZHANG S, MENG X, et al. The preparation and characterization of a novel amphiphilic oleoyl-carboxymethyl chitosan self-assembled nanoparticles [J].CarbohydratePolymers, 2011,83(1): 130-136.
[20] GE Z, CHEN Q, OSADA K, et al. Targeted gene delivery by polyplex micelles with crowded PEG palisade and cRGD moiety for systemic treatment of pancreatic tumors [J].Biomaterials, 2014,35(10): 3416-3426.
[21] BENEDIKTSDOTTIR B E, BALDURSSON O, MASSON M. Challenges in evaluation of chitosan and trimethylated chitosan (TMC) as mucosal permeation enhancers: From synthesis toinvitroapplication [J].JControlRelease, 2014,173: 18-31.
[22] YU B, TANG C, YIN C H. Enhanced antitumor efficacy of folate modified amphiphilic nanoparticles through co-delivery of chemotherapeutic drugs and genes [J].Biomaterials, 2014,35(24): 6369-6378.
[23] LIANG H F, CHEN C T, CHEN S C, et al. Paclitaxel-loaded poly(gamma-glutamic acid)-poly(lactide) nanoparticles as a targeted drug delivery system for the treatment of liver cancer [J].Biomaterials, 2006,27(9): 2051-2059.
[24] ALTIERI D C. Targeting survivin in cancer [J].CancerLett, 2013,332(2): 225-228.
[25] HU Q, LI W, HU X, et al. Synergistic treatment of ovarian cancer by co-delivery of survivin shRNA and paclitaxel via supramolecular micellar assembly [J].Biomaterials, 2012,33(27): 6580-6591.
[26] ZHAO X, YIN L, DING J, et al. Thiolated trimethyl chitosan nanocomplexes as gene carriers with high in vitro andinvivotransfection efficiency [J].JControlRelease, 2010,144(1): 46-54.
[27] YIN L, SONG Z, KIM K H, et al. Non-viral gene delivery via membrane-penetrating, mannose-targeting supramolecular self-assembled nanocomplexes [J].AdvMater, 2013,25(22): 3063-3070.
[28] LIU Z, ZHANG T, TANG C, et al. Amphiphilic nanoparticles based on poly(vinyl pyrrolidone) and stearoyl modified chitosan as drug vehicles for paclitaxel delivery [J].MaterLett, 2016,185: 226-229.
[29] ISHII T, OKAHATA Y, SATO T. Facile preparation of a fluorescence-labeled plasmid [J].ChemistryLetters, 2000,29(4): 386-387.
[30] ZHENG H, TANG C, YIN C. The effect of crosslinking agents on the transfection efficiency, cellular and intracellular processing of DNA/polymer nanocomplexes [J].Biomaterials, 2013,34(13): 3479-3488.
[31] ZHAO Z M, HE M, YIN L C, et al. Biodegradable nanoparticles based on linoleic acid and poly(beta-malic acid) double grafted chitosan derivatives as carriers of anticancer drugs [J].Biomacromolecules, 2009,10(3): 565-572.
[32] HUH K M, LEE S C, CHO Y W, et al. Hydrotropic polymer micelle system for delivery of paclitaxel [J].JournalofControlledRelease, 2005,101(1-3): 59-68.
[33] ZHANG Z, MEI L, FENG S S. Paclitaxel drug delivery systems [J].ExpertOpinDrugDeliv, 2013,10(3): 325-340.
[34] HOWAT S, PARK B, OH I S, et al. Paclitaxel: Biosynthesis, production and future prospects [J].NBiotechnol, 2014,31(3): 242-245.
[35] MITA A C, MITA M M, NAWROCKI S T, et al. Survivin: Key regulator of mitosis and apoptosis and novel target for cancer therapeutics [J].ClinCancerRes, 2008,14(16): 5000-5005.
[36] RYAN B M, O’DONOVAN N, DUFFY M J. Survivin: A new target for anti-cancer therapy [J].CancerTreatRev, 2009,35(7): 553-562.
[37] FANG J, NAKAMURA H, MAEDA H. The EPR effect: Unique features of tumor blood vessels for drug delivery, factors involved, and limitations and augmentation of the effect [J].AdvDrugDelivRev, 2011,63(3): 136-151.
[38] HE C B, HU YP, YIN L C, et al. Effects of particle size and surface charge on cellular uptake and biodistribution of polymeric nanoparticles [J].Biomaterials, 2010,31(13): 3657-3666.
[39] BERTRAND N, WU J, XU X Y, et al. Cancer nanotechnology: The impact of passive and active targeting in the era of modern cancer biology [J].AdvancedDrugDeliveryReviews, 2014,66: 2-25.
[40] GAUMET M, VARGAS A, GURNY R, et al. Nanoparticles for drug delivery: The need for precision in reporting particle size parameters [J].EurJPharmBiopharm, 2008,69(1): 1-9.
[41] SAHAY G, ALAKHOVA D Y, KABANOV A V. Endocytosis of nanomedicines [J].JControlRelease, 2010,145(3): 182-195.
