Jab1基因的RNAi对乳腺癌MCF-7细胞增殖和迁移的影响
2018-06-13朱根凤余同露蔡栋梁叶晓娟闵太善陈浩明卢大儒
朱根凤,余同露,2,蔡栋梁,2,叶晓娟,2,闵太善,2,陈浩明,2,卢大儒,2
(1.复旦大学 生命科学学院,上海 200438; 2.复旦大学 现代人类学教育部重点实验室,上海 200438)
乳腺癌严重威胁着女性健康,全世界每年新发病例高达150万人,近年来,其发病率逐年上升[1],在我国大城市已居女性恶性肿瘤发病率之首.乳腺癌细胞的恶性增殖和转移是患者死亡的主要原因[2],揭示其分子机制迫在眉睫.
1996年Claret等报导Jab1可与c-Jun的N端结合,将其名为Jab1(Jun activation domain-binding protein 1),随后发现其是COP9信号体(COP9 Signalosome Complexes, CSN)的第5个亚单位,因而Jab1又被称为CSN5[3-4].Jab1在动物、植物和真菌中序列高度保守,表明Jab1具有重要的功能[5-6].
Jab1基因定位于人类8号染色体上,Jab1蛋白由334个氨基酸分子组成.它不仅存在于COP9信号体中,而且作为单体也与很多重要功能的蛋白相互作用,如介导P53从细胞核中转运到细胞质中并降解,在多种肿瘤组织中检测到Jab1过量表达,促进细胞增殖[7-9].此外,Jab1能激活Jun家族中c-Jun和JunD,增强AP-1活性,与细胞癌变相关[10-12].研究表明Jab1在乳腺癌、肝癌、肺癌和胰腺癌等多种肿瘤组织中特异性高表达,且这种高表达与肿瘤的发生相关[13-15],但目前对Jab1调控的分子机制有待进一步揭示.
研究表明,THBS1(Thrombospondins1)蛋白是细胞膜表面钙结合糖蛋白,属于血小板反应蛋白家族[16-17].它参与肿瘤新血管生成、肿瘤转移,以及细胞粘附、迁移、增殖、凋亡等重要过程[18-19],其编码基因THBS1是潜在的抑癌基因,在胃癌、大肠腺癌等多种肿瘤中发生基因启动子CpG岛的异常甲基化而失活,并且THBS1基因甲基化与肿瘤的发生发展紧密相关.
MCF7是常见的低浸润性乳腺癌细胞代表,探索Jab1干扰对其生物学特性的影响,揭示相关的分子机制,对于深入了解低浸润性乳腺癌的发生机制有重要意义.因此本研究在乳腺癌细胞MCF-7中建立Jab1的干扰表达系统,研究Jab1基因对乳腺癌细胞增殖、细胞迁移和细胞周期的影响,初步揭示Jab1可通过甲基化介导调控THBS1的表达,为进一步的分子机制研究打下基础.
1 材料与方法
1.1 实验材料
人乳腺癌细胞MCF-7、293T细胞为本室保存;TRIzol、Lipofectamine 2000试剂购自Invitrogen公司;实时定量PCR试剂购自Toyobo公司;HRP标记的Western blot二抗购自碧云天公司;体外侵袭实验试剂盒购自Cell Biolabs公司;Jab1抗体购自于Thermo公司,THBS1和β-actin抗体购自Cell signaling公司;细胞培养试剂均购自Gibco公司.
1.2 细胞培养
293T、MCF-7培养使用高糖DMEM培养基,添加10% FBS以及1%的青霉素-链霉素双抗,37℃培养于CO2培养箱.
1.3 慢病毒包装
干扰Jab1表达的慢病毒shRNA,Jab1sh2: 5’-GCACTGAAACCCGAGTAAATG-3’,Jab1sh5: 5’-GCTTGAGCTGTTGTGGAATAA-3’;干扰Luciferase基因的对照组慢病毒shRNA序列,shLuc: 5’-CGTACGCGGAATACTTCGA-3’.
慢病毒包装时,取生长状态好的293T细胞,在10cm细胞培养皿中,以40μL的Lipofectamine 2000介导,转入表达shRNA的慢病毒载体质粒7.5μg,以及3种辅助质粒PLP1、PLP2和VSVG各2.5μg,12h后换液,60h后收集病毒上清,2000r/min离心10min,上清用0.45μm滤器过滤并分装后冻存于-80℃冰箱;感染时,取适量慢病毒,与悬浮的乳腺癌细胞混匀,添加4μg/mL的polybrene溶液.
1.4 实时定量PCR
慢病毒感染的细胞弃去培养基后使用PBS(137mmol/L NaCl,2.7mmol/L KCl,10mmol/L Na2HPO4,2mmol/L KH2PO4)将培养基洗干净,加入TRIzol裂解,将细胞冰上放置10min,加入三氯甲烷震荡15s,冷冻离心取上层,加入等量异丙醇充分混匀后离心,沉淀用75%乙醇洗涤,离心,弃上清,晾干,加入适量DEPC处理的水溶解,保存于-80℃冰箱.
定量PCR在ABI公司7900HT定量PCR仪上进行,结果由配套的SDS 2.4软件进行分析,GAPDH基因作为内参,实验进行3组重复;THBS1上游引物: CGGCCTCCCCTATGCTATCA;THBS1下游引物: GGTAACTGAGTTCTGACAGTGAC.
1.5 Western blot
经过慢病毒感染的细胞弃去培养基后用PBS将培养基洗干净后,RIPA裂解液将细胞至于冰上裂解1h,冷冻离心取上清,Bradford法定量后将各蛋白裂解液用RIPA裂解液调整至统一浓度,加入适量蛋白上样缓冲液,煮沸10min,取20μL进行SDS-PAGE电泳,电泳结束后300mA恒流转膜2h至PVDF膜,5%脱脂奶粉封闭1h,TBST洗3次,加入一抗(按1∶1000稀释)孵育2h,TBST洗3次,再加相应二抗(1∶1000稀释)室温孵育1h,加入显色底物,显影仪拍照.
1.6 CCK-8细胞增殖实验
用Dojindo公司的CCK-8试剂盒,按照操作说明进行细胞增殖实验的测定.将乳腺癌细胞消化后制成单细胞悬液,计数后,配成每毫升2×104个细胞后,每孔铺100μL细胞,细胞培养一定时间后,加入CCK-8试剂显色,温育后酶标仪450nm测OD值.
1.7 划痕实验
接种乳腺癌细胞MCF-7于六孔板培养板中,形成致密单层后,用Tip头贴着直尺在六孔板中轻轻划痕,PBS洗去细胞碎片,再加入无血清培养基.选择不同时间点,显微镜观测细胞迁移情况,照相.
1.8 流式细胞仪检测细胞周期
消化细胞,1000r/min 5min离心收集细胞,PBS洗2次.加适量PBS重悬(小于500μL),加5mL -20℃预冷的70%乙醇,固定30min.离心,弃上清,PBS悬浮,再离心,弃上清.加400μL含25μg/mL碘化丙啶和1μg/mL RNase A的染色液室温避光染色30min后,上机检测细胞周期,用ModFit软件分析结果.
1.9 统计分析
本研究中数值用“均值+标准差”表示,所有实验重复3次以上,组间通过SPSS软件的t-检验进行统计学分析.
2 结 果
2.1 慢病毒介导的Jab1基因的shRNA干扰
用制备的Jab1基因的shRNA干扰慢病毒(Jab1sh2和Jab1sh5)和对照慢病毒(shLuc)分别感染MCF-7细胞,192h后荧光显微镜观察慢病毒介导的shRNA干扰表达情况,并抽提相应细胞总蛋白质,进行Western blot分析,检测细胞内Jab1基因的表达水平,结果如图1所示,可见光视野和荧光视野的对比结果表明(图1(a)),高于90%的MCF-7细胞表达GFP荧光基因,说明shLuc、Jab1sh2和Jab1sh5慢病毒对MCF-7细胞的感染率高.
图1(b)的Western blot检测结果表明,在蛋白质水平上Jab1基因的shRNA慢病毒干扰细胞组中的Jab1蛋白的表达量显著低于对照组.综合图1的结果表明,慢病毒介导的shRNA干扰使得MCF-7细胞中Jab1基因的表达显著下调,乳腺癌细胞MCF-7中Jab1表达干扰系统构建成功.
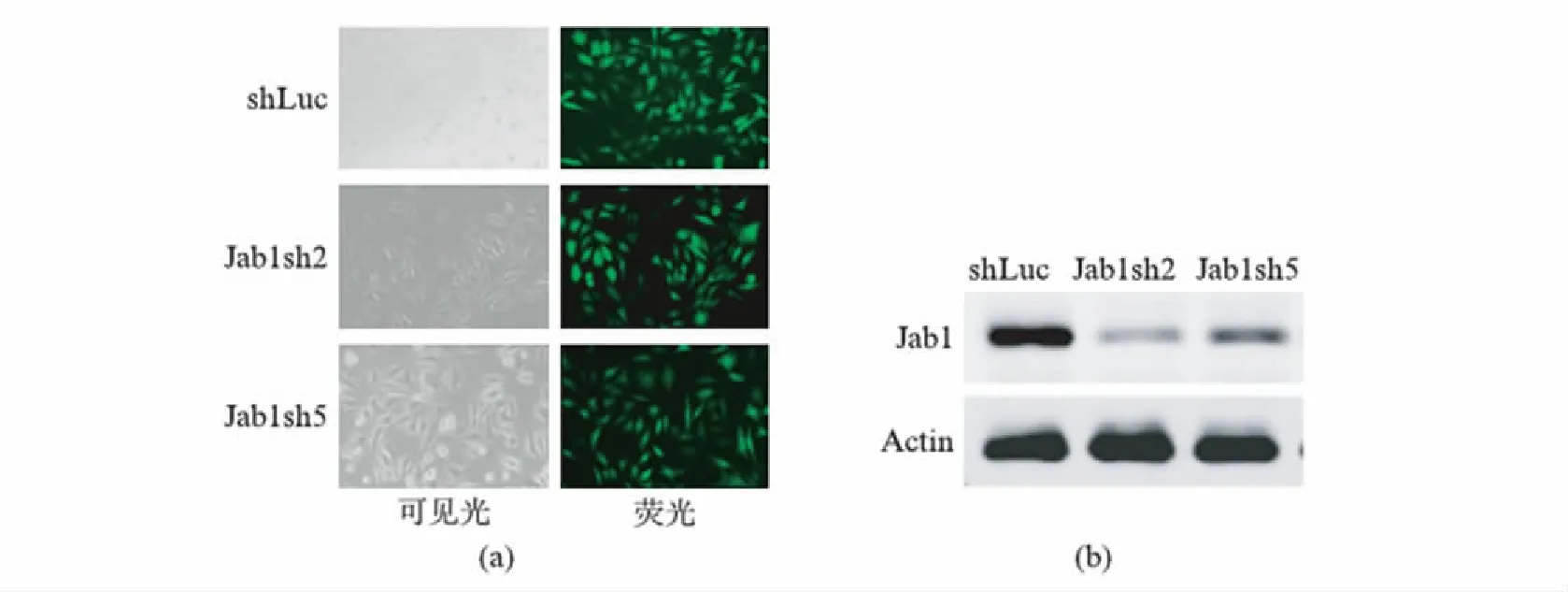
图1 MCF-7细胞中慢病毒介导的Jab1 RNAi的检测Fig.1 Detection of Jab1 RNAi by Lentivirus-mediated shRNA in MCF-7 cells(a) 对照慢病毒和Jab1基因的shRNA干扰慢病毒感染后,显微镜拍摄的可见光和荧光照片,左边为可见光照片,右边为荧光照片;(b) Western blot检测对照慢病毒和Jab1基因的shRNA干扰慢病毒感染后细胞中Jab1蛋白的表达水平,β-Actin基因为内参.
2.2 Jab1 RNAi对MCF-7细胞增殖的影响
用Jab1基因的shRNA干扰慢病毒(Jab1sh2和Jab1sh5)和对照慢病毒(shLuc)分别感染MCF-7细胞,CCK8细胞增殖检测试剂盒检测在Jab1基因的表达受到干扰后细胞增殖能力的变化,结果如图2所示.可见Jab1sh2以及Jab1sh5慢病毒感染的两组MCF-7实验组细胞中的Jab1表达被干扰之后,细胞在450nm处的平均吸光值显著低于对照慢病毒shLuc感染细胞的平均吸光值,由对照组的0.659分别下降至两组实验组的0.444以及0.401,统计分析表明,两组实验组和对照组相比差异极显著(P<0.01).这表明MCF-7细胞中Jab1基因的表达干扰使得细胞的增殖能力显著下降,即Jab1对于MCF-7的细胞增殖能力具有重要作用.
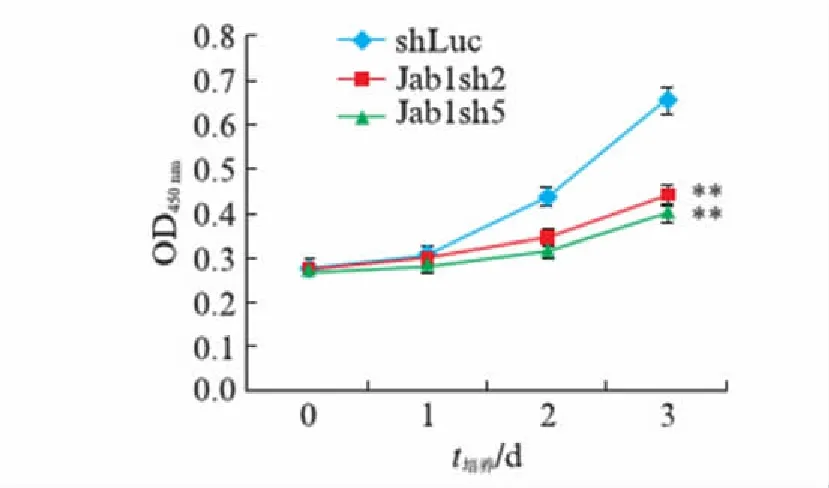
图2 Jab1 RNAi对MCF-7细胞增殖的影响Fig.2 Effect of Jab1 RNAi on the proliferation of MCF-7 cells450nm处的平均吸光值(n=5)代表细胞相对的增殖能力,**: P<0.01.
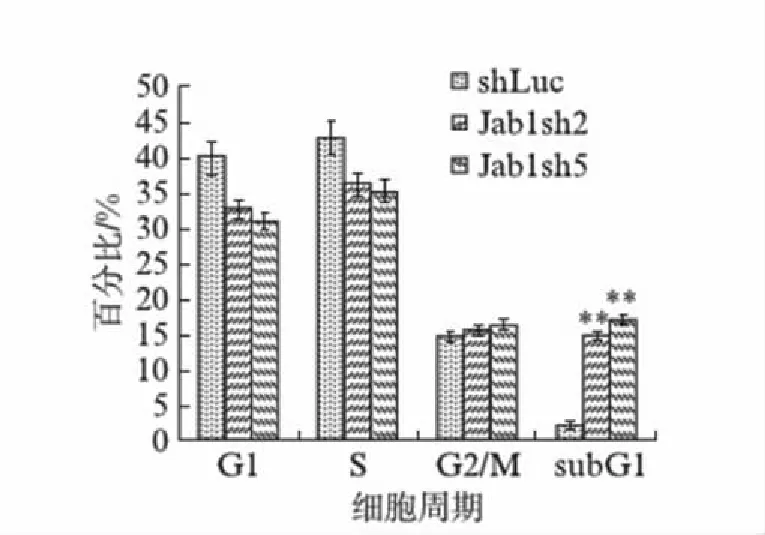
图3 Jab1 RNAi对MCF-7细胞周期的影响Fig.3 Effect of Jab1 RNAi on the MCF-7 cell cycle将Jab1干扰表达实验组和shLuc对照组MCF-7细胞PI避光染色后,用流式细胞仪测定细胞周期和sub G1期比例.
2.3 Jab1 RNAi对MCF-7细胞凋亡的影响
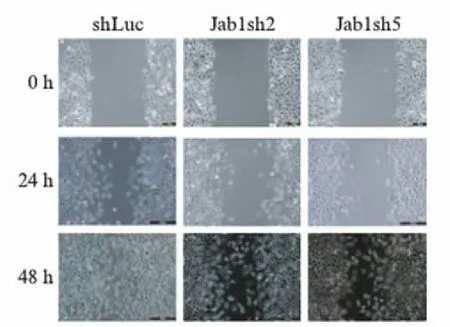
图4 Jab1 RNAi对MCF-7细胞迁移能力的影响Fig.4 Effects of Jab1 RNAi on migration ability of MCF-7 cells对照慢病毒和Jab1基因的shRNA干扰慢病毒感染的细胞在划痕0h、24h和48h观察划痕愈合情况.
流式细胞仪测定Jab1干扰表达实验组和shLuc对照组MCF-7细胞的细胞周期和sub G1期比例,结果如图3所示,测定的Jab1干扰表达实验组Jab1sh2组和Jab1sh5组的sub G1期比例相较于shLuc对照组分别增加13.0%和15.2%,统计分析表明,两者差异极显著(P<0.01).这表明乳腺癌中干扰Jab1的表达会增加细胞凋亡的比例.
2.4 Jab1 RNAi对MCF-7细胞迁移能力的影响
本研究用细胞划痕愈合情况测定细胞的迁移能力,在划痕后0h、24h和48h 3个时间点进行观察拍照,结果如图4所示,shLuc对照组细胞划痕48h后已基本愈合,而Jab1干扰表达实验组(Jab1sh2和Jab1sh5)则还留有明显的划痕口未能合拢,表明干扰Jab1的表达降低了MCF-7细胞的迁移速率,Jab1基因决定了细胞的迁移能力.
2.5 Jab1 RNAi对MCF-7细胞中THBS1蛋白表达的影响
本室前期的基因芯片研究表明,在MDA231细胞中干扰Jab1的表达,导致细胞中THBS1 mRNA水平下调.在MCF-7细胞中是否有类似情况,本研究做进一步揭示.
提取对照慢病毒和Jab1基因的shRNA干扰慢病毒感染后MCF-7细胞的总RNA,RT-PCR检测表明,与对照组相比,Jab1表达干扰组中THBS1 mRNA的表达水平大大降低,如图5(a)所示,统计分析表明,Jab1表达干扰组和对照组的表达水平差异极显著(P<0.01).
提取对照慢病毒和Jab1基因的shRNA干扰慢病毒感染后MCF-7细胞的总蛋白,Western blot检测Jab1和THBS1的表达,结果如图5(b)所示,随着细胞内Jab1蛋白表达的下降,THBS1蛋白表达的水平明显下调.
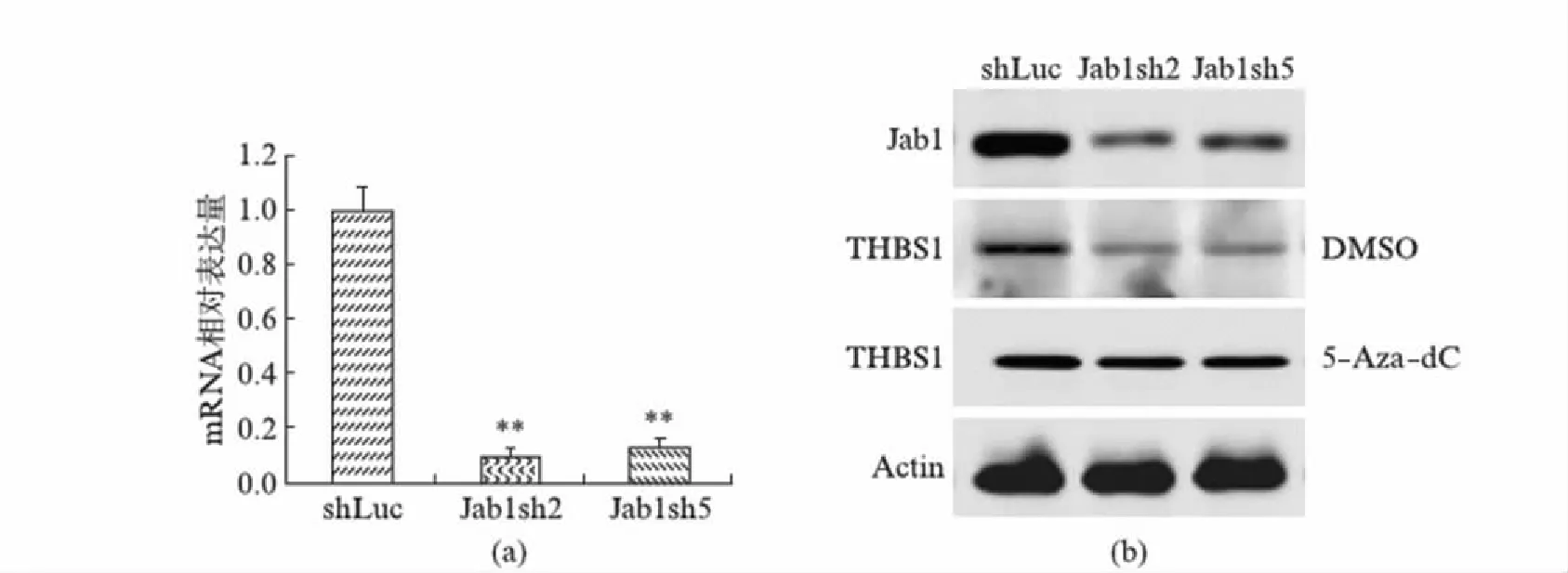
图5 Jab1 RNAi对MCF-7细胞中THBS1蛋白表达的影响Fig.5 Effect of Jab1 RNAi on the expression of THBS1 protein in MCF-7 cells(a) RT-PCR检测对照慢病毒和Jab1基因的shRNA干扰慢病毒感染后细胞中THBS1 mRNA的表达水平;(b) Western blot检测对照慢病毒和Jab1基因的shRNA干扰慢病毒感染后细胞中Jab1和THBS1蛋白的表达水平(DMSO为空白组,5-Aza-dC为添加甲基化转移酶抑制剂组),β-Actin为内参.
为进一步研究Jab1是否会影响THBS1基因的DNA甲基化,本研究使用甲基化转移酶抑制剂5-Aza-dC分别处理Jab1干扰表达实验组和shLuc对照组,提取总蛋白Western blot检测.如图5(b)所示,5-Aza-dC处理Jab1干扰表达实验组和shLuc对照组后,THBS1的表达水平相对于未加5-Aza-dC(DMSO组)发生了上调,甲基化转移酶抑制剂5-Aza-dC能增加Jab1干扰组的THBS1表达水平,几乎与对照组持平.说明Jab1基因调控THBS1的表达受甲基化水平的影响.
3 讨 论
目前的研究表明,Jab1不仅作为COP9信号复合体的成员扮演着重要角色,而且作为单体,它调控了细胞内多种关键蛋白,在细胞周期调控、细胞信号传递等过程中发挥了重要功能,它在乳腺癌、肝癌和胃癌等多种肿瘤中表达上调,与肿瘤的发生发展有紧密相关[1,20],但是,Jab1在乳腺癌细胞中的分子机制还有待深入的揭示.
本室前期的研究表明,在乳腺癌MDA-231细胞中,Jab1基因调控Nov基因和FraI基因的表达[21-22],为Jab1分子机制研究打下了基础.因MDA231为高侵染的乳腺癌细胞,因此本研究选择低侵染的乳腺癌细胞MCF-7,试图从另外一个角度阐明Jab1的调控机制.本研究首先建立了MCF-7细胞中Jab1的干扰表达系统,实现了对细胞中Jab1基因表达的高效干扰.CCK8细胞增殖实验发现Jab1的表达干扰使得MCF-7细胞的增殖能力发生了显著的下降,划痕实验证实Jab1的表达干扰能显著抑制细胞的迁移,流式细胞仪分析表明干扰Jab1的表达能极大地诱导细胞进入凋亡.
研究表明干扰Jab1的表达能极大的增加sub G1期细胞的比例,sub G1代表细胞中亚二倍体的含量,这是细胞凋亡的重要指标,说明干扰Jab1的表达能造成部分细胞中DNA的断裂和降解,诱导其凋亡,使得Jab1成为低浸润乳腺癌细胞中一个重要的治疗靶点,对将来的治疗研究有积极意义.
越来越多的研究表明,THBS1在肿瘤的发生中具有多种功能,在胃癌、大肠癌、白血病等中是抑癌基因,而在乳腺癌演进的不同过程中功能迥异,乳腺原位癌中THBS1表达于基底膜,抑制肿瘤发生,在高组织学分级及伴有广泛坏死的原位癌中表达缺失[23-26].而Horiguchle等研究表明在淋巴结转移阳性的乳腺癌中,THBS1的肿瘤细胞阳性表达率很高,提示它与肿瘤侵袭转移相关[27].本研究表明,在MCF-7细胞中其表达高,Jab1基因表达被干扰后,其表达也下降,说明THBS1的表达受Jab1调控.
前人有报导在肿瘤细胞中,THBS1的启动子被甲基化而被抑制表达,Jab1是通过何种途径调控THBS1的呢?本研究表明,用甲基转移酶抑制剂5-Aza-dC处理,Western blot检测表明Jab1基因表达干扰实验组中THBS1的表达下降被极大的抑制,暗示Jab1可能是抑制表观遗传学中的甲基化修饰方式来调控THBS1基因的表达,Jab1干扰表达后其对THBS1启动子区甲基化的抑制作用可能大大降低,增加了THBS1启动子区的甲基化水平,抑制了THBS1的表达,在5-Aza-dC的作用下,THBS1启动子区的甲基化被抑制,THBS1的表达增加.
参考文献:
[1] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012 [J].CACancerJClin, 2015,65(2): 87-108.
[2] CHAMBERS A F, NAUMOV G N, VANTYGHEM S A, et al. Molecular biology of breast cancer metastasis Clinical implications of experimental studies on metastatic inefficiency [J].BreastCancerRes, 2000,2(6): 400-407.
[3] CLARET F X, HIBI M, DHUT S, et al. A new group of conserved coactivators that increase the specificity of ap-1 transcription factors [J].Nature, 1996,383(6599): 453-457.
[4] WEI N, DENG X W. The cop9 signalosome [J].AnnuRevCellDevBiol, 2003,19(1): 261-286.
[5] TOMODA K, KUBOTA Y, KATO J. Degradation of the cyclin-dependent-kinase inhibitor p27kip1 is instigated by Jab1 [J].Nature, 1999,398(6723): 160-165.
[6] BAE M K, AHN M Y, JEONG J W, et al. Jab1 interacts directly with HIF-1α and regulates its stability [J].JBiolChem, 2002,277(1): 9-12.
[7] BECH-OTSCHIR D, KRAFT R, HUANG X, et al. Cop9 signalosome-specific phosphorylation targets p53 to degradation by the ubiquitin system [J].EMBOJ, 2001,20(7): 1630-1639.
[8] SUI L, DONG Y, OHNO M, et al. Jab1 expression is associated with inverse expression of p27(kip1) and poor prognosis in epithelial ovarian tumors [J].ClinCancerRes, 2001,7(12): 4130-4135.
[9] RASSIDAKIS G Z, CLARET F X, LAI R, et al. Expression of p27(kip1) and c-jun activation binding protein 1 are inversely correlated in systemic anaplastic large cell lymphoma [J].ClinCancerRes, 2003,9(3): 1121-1128.
[10] KARIN M, LIU Z, ZANDI E. Ap-1 function and regulation [J].CurrOpinCellBiol, 1997,9(2): 240-246.
[11] EFERL R, HOEBERTZ A, SCHILLING A F, et al. The Fos-related antigen Fra-1 is an activator of bone matrix formation [J].EMBOJ, 2004,23(14): 2789-2799.
[12] PRUSTY B K, DAS B C. Constitutive activation of transcription factor Ap-1 in cervical cancer and suppression of human papillomavirus (HPV) transcription and Ap-1 activity in hela cells by curcumin [J].IntJCancer, 2005,113(6): 951-960.
[13] DONG Y, SUI L, WATANABE Y, et al. Prognostic significance of Jab1 expression in laryngeal squamous cell carcinomas [J].ClinCancerRes, 2005,11(1): 259-266.
[14] HARADA K, KAWASHIMA Y, YOSHIDA H, et al. High expression of jun activation domain-binding protein 1(Jab1) is a strong prognostic marker in oral squamous cell carcinoma patients treated by UFT in combination with radiation [J].AnticancerRes, 2006,26(2B): 1615-1619.
[15] HSU M C, HUANG CC, CHANG H C, et al. Overexpression of Jab1 in hepatocellular carcinoma and its inhibition by peroxisome proliferator-activated receptor γ ligandsinvitroandinvivo[J].ClinCancerRes, 2008,14(13): 4045-4052
[16] CHEN H, HERNDON M E, LAWLER J. The cell biology of thrombospondin-1 [J].MatrixBiol, 2000,19(7) : 597-614.
[17] RESOVI A, PINESSI D, CHIORINO G, et al. Current understanding of the thrombospondin-1 interactome [J].MatrixBiol, 2014,37: 83-91
[18] JAYACHANDRAN A, ANAKA M, PRITHVIRAJ P, et al. Thrombospondin 1 promotes an aggressive phenotype through epithelial-to-mesenchymal transition in human melanoma [J].Oncotarget, 2014,5(14): 5782-5797.
[19] IOACHIM E, DAMALA K, TSANOU E. Thrombospondin-1 expressionin breastcancer: Prognostic significance and association with p53 alterations,tumourangiogenesis and extracellular matrix components [J].HistolHistopathol, 2012,27(2): 209-216.
[20] SHACKLEFORD T J, CLARET F X. Jab1/csn5: A new player in cell cycle control and cancer [J].CellDiv, 2010,5(1): 26
[21] 王靖坤,王顺妮,陈红岩,等.慢病毒介导的Jab1基因表达干扰在乳腺癌细胞中功能的初步研究 [J].复旦学报(自然科学版),2013,52(6): 724-727
[22] 王顺妮,陈红岩,叶晓娟,等.乳腺癌Jab1蛋白调控Nov基因的表达受甲基化水平影响 [J].复旦学报(自然科学版),2016,55(1): 112-118.
[23] RICE A J, STEWARD M A, QUINN C M. Thrombospondin 1 protein expression relates to good prognostic indices in ductal carcinoma in situ of the breast [J].JClinPathol, 2002,55(12): 921-925.
[24] GASPARINI G, TOI M, BIGANZOLI E, et al. Thrombospondin-1 and -2 in node-negative breast cancer: Correlation with angiogenic factors,p53, cathepsin D,hormone receptors and prognosis [J].Oncol, 2001,60(1): 72-80.
[25] MIYATA Y, SAKAI H. Thrombospondin-1 in urological cancer: Pathological role, clinical significance, and therapeutic prospects [J].IntJMolSci, 2013,14(6): 12249-12272.
[26] OKADA K, HIRABAYASHI K, IMAIZUMI T, et al. Stromal thrombospondin-1 expression is a prognostic indicator and a new marker of invasiveness in intraductal papillary-mucinous neoplasm of the pancreas [J].BiomedRes, 2010,31(1): 13-19.
[27] HORIGUCHI H, YAMAGATA S, RONG Q Z, et al. Thrombospondin-1 is highly expressed in desmoplastic components of invasive ductal carcinoma of the breast and associated with lymph node metastasis [J].JMedInvestigation, 2013,60(1/2): 91-96.
