辣椒ToMMV的分子鉴定
2018-06-13陈灵芝张茹魏兵强王兰兰高彦萍张
陈灵芝张 茹魏兵强王兰兰高彦萍张 武
〔1甘肃省农业科学院蔬菜研究所,甘肃兰州 730070;2甘肃省马铃薯脱毒种薯(种苗)病毒检测及安全评价工程技术研究中心,甘肃兰州 730070〕
辣椒病毒病是近年来甘肃省辣椒生产中普遍发生的病害,植株一旦被病毒病感染,常表现为叶片皱缩、斑驳、黄化、花叶、坏死、畸形和植株矮化,且发病率极高,传播迅速,易造成严重减产,产量损失达20%~70%。徐秉良(2001)报道侵染甘肃省辣椒的主要病毒为CMV,文朝慧等(2010)利用DAS-ELISA和RT-PCR法对甘肃省制种基地辣椒病样进行检测,结果表明TMV和CMV是优势毒原种群,检出率分别为44.4%和33.3%。
笔者多年来从事辣椒杂交育种工作,自2014~2016年在甘肃省农业科学院蔬菜研究所辣椒育苗棚、试验地分别发现辣椒幼苗和成株疑似感染病毒病,主要症状表现为幼苗从第1片真叶畸形,叶片皱缩、黄化,个别植株生长点坏死。此后,随着幼苗生长及定植,症状有所缓解,但在9、10月辣椒采收后期,叶片皱缩、黄化、畸形症状加重。对辣椒病毒病病原种类进行准确的鉴定是进行有效防控和筛选抗毒种质的前提。在参考前人对辣椒病毒病鉴定的工作基础上,本试验以采集于甘肃省农业科学院蔬菜研究所试验地的病样为材料,利用TMV/CMV双抗体夹心酶联免疫试剂盒(DAS-ELISA)和RT-PCR方法进行病原的检测和鉴定。
1 材料与方法
1.1 病毒病发病调查及样品采集
2015年3月至2016年9月,在甘肃省农业科学院蔬菜研究所辣椒育苗棚和试验田调查病毒病发生情况,并采集疑似感染病毒病的样品。
2015年3月在育苗棚采集病样25份,2016年3月和9月在育苗棚、试验田采集病样47份,健康样品5份,样品保存于4 ℃冰箱和液氮中。分别进行CMV/TMV双抗体夹心酶联免疫吸附法(DASELISA)检测及RT-PCR检测。
1.2 DAS-ELISA检测
用于DAS-ELISA检测的抗体及阳性、阴性对照样品为美国Agdia公司产品。取采集到的新鲜待测样品按0.1 g·mL-1加入样品抽提缓冲液中充分研磨,将样品、阳性对照及阴性对照分别加入到酶联板反应孔中,室温条件下于黑暗潮湿环境中孵育2 h。具体检测步骤参照产品说明书。
1.3 ToMMV分子鉴定
1.3.1 引物设计与合成 根据姚玉荣等(2013)、Li等(2014)以及Genbank数据库中已公布的TMV和ToMMV的基因组全长序列,应用软件Primer Premier 5.0设计合成3对TMV引物和3对ToMMV引物(表1)。引物由生工生物工程技术(上海)有限公司合成。
1.3.2 总RNA的提取和cDNA的合成 采用天根生化科技(北京)有限公司总RNA提取试剂盒提取每个样品中的总RNA,利用Thermo Scientific RevertAid First Strand cDNA Synthesis Kit对提取的总RNA进行反转录。反应体系:RNA模板2.5 μL,RNase Free ddH2O 4.0 μL,5×PrimerScript Buffer 2.0 μL,Random Primer 1.0 μL,PrimerScript RT Enzyme Mix I 0.5 μL。反应程序:37 ℃,15 min,85 ℃变性20 s,合成的cDNA用于后续PCR扩增反应。
1.3.3 PCR扩增反应 以反转录后合成cDNA为模板,采用PCR扩增相应病毒的序列。反应体系:Mix( 含 Mg2+,dNTP,buffer,Taq 酶 )12.5 μL,上下游引物各1 μL,模板1.5 μL,ddH2O 9 μL。扩增程序:94 ℃,4 min;94 ℃,30 s,55 ℃,30 s,72 ℃,1 min,30 个循环;72 ℃,5 min。
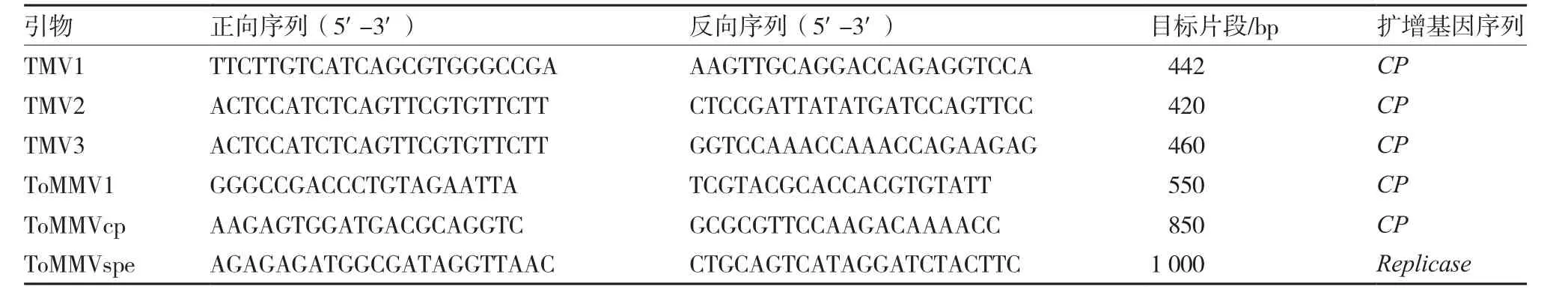
表1 用于RT-PCR反应的辣椒病毒引物序列
1.3.4 序列分析 将PCR扩增产物中的特异条带切胶,采用天根生化科技(北京)有限公司的DNA回收试剂盒纯化后与克隆载体PMD19连接,转化感受态E.coli TOP10,采用PMD19的通用引物对阳性克隆经菌液鉴定后委托生工生物工程(上海)股份有限公司进行测序。采用生物学软件DNAMAN进行核苷酸及编码氨基酸序列的多重比对,系统进化树的构建采用MEGA 6.0软件的邻接法(Neighbor-Joining)进行,Bootstrap重复次数为1 000。所用ToMMV参照分离物来源及序列登录号见表2。
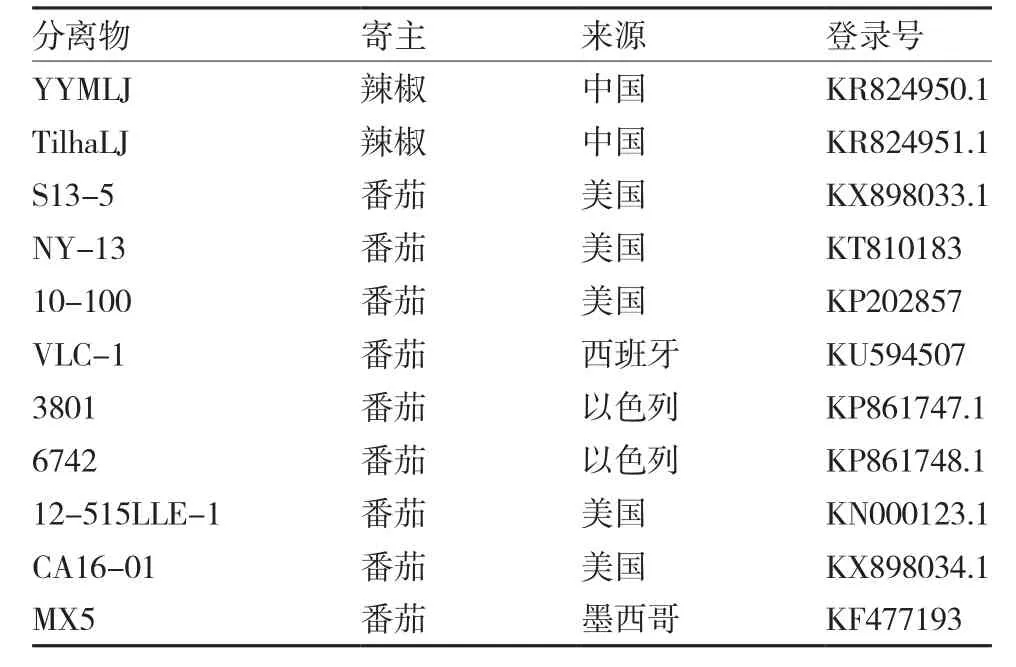
表2 用于序列比对及系统进化分析的ToMMV分离物来源和登录号
2 结果与分析
2.1 辣椒病毒病发病情况
在甘肃省农业科学院蔬菜研究所育苗棚和试验地调查发现,辣椒病毒病普遍发生。苗期发病时期可提前至第1片真叶,表现为叶片上卷、畸形,随着苗龄的增大,症状有所缓解,有的植株4~5层新叶表现为健康;定植后,随着抗性的提高及田间病害防控,病情进一步得到缓解;在采收后期,伴随虫害,病毒病发病严重,症状也复杂多样,诸如明脉、斑驳、花叶、皱缩、畸形、黄化、坏死和矮化等(图1)。
2.2 双抗体夹心酶联免疫吸附法检测
采用CMV和TMV双抗体夹心酶联免疫试剂盒对采集的辣椒病样进行检测,TMV的总检出率为66.7%,未检出CMV(图2)。
2.3 RT-PCR检测
2.3.1 TMV扩增结果 采用TMV双抗体夹心酶联免疫试剂盒检测出TMV的阳性率为66.7%,设计3对TMV引物对阳性病样进行扩增,只有引物TMV1(姚玉荣,2013)在阳性样品上扩增出了预期大小的条带,其他2对引物没有扩增出条带(图3)。对扩增出的条带经回收、纯化和克隆、测序(图4、5),得到536 bp大小的序列片段,通过NCBI BLAST检索证明与ToMMV(MX5,KF477193)达到97%的序列一致性。

图1 辣椒病样病毒病症状

图2 CMV(左)和 TMV(右)的DAS-ELISA检测
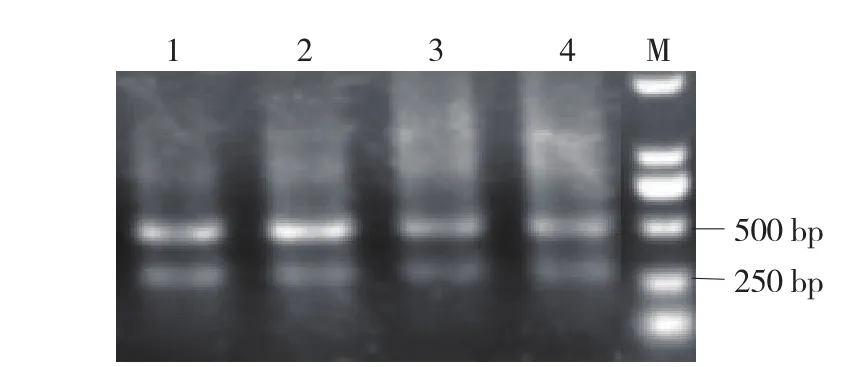
图3 引物TMV1在辣椒病样的扩增
图4 相似目的条带切胶回收
图5 阳性克隆的RT-PCR检测
2.3.2 ToMMV扩增结果 为了进一步确认病毒种类,针对ToMMV(MX5,KF477193)设计3对引物ToMMV1/ToMMVcp/ToMMVspe,ToMMV1扩增的是ToMMV病毒CP基因的部分序列,ToMMVcp扩增的是包括ToMMV病毒CP基因完整序列在内的片段,ToMMVspe扩增的是病毒基因组RNA酶复制区(nt830-1828),3对引物在阳性样品上都扩增出了预期大小的片段,ToMMV1扩增出的条带大小为550 bp,ToMMVcp扩增出的条带大小为850 bp,ToMMVspe扩增出的条带大小为1 000 bp(图6),而3对引物在阴性样品上均未扩增出目的条带(图 7)。
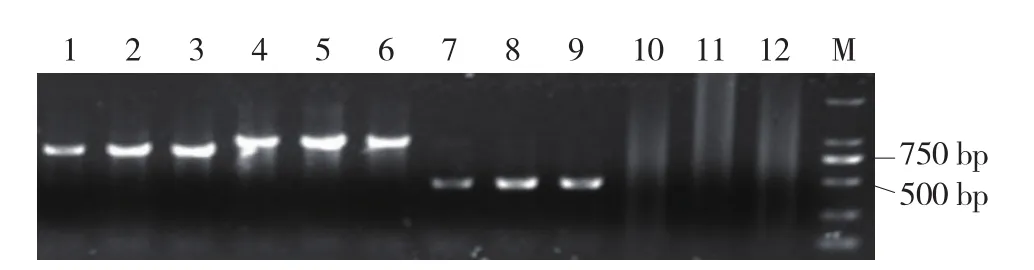
图6 引物TMV2、ToMMV1、ToMMVcp、ToMMVspe在阳性样品上的RT-PCR扩增
图7 引物TMV2、ToMMV1、ToMMVcp、ToMMVspe在阴性样品上的RT-PCR扩增
2.4 ToMMV 的CP基因序列比对及分析
挑选3个分离物,分别命名为Gansu-1、Gansu-2、Gansu-3,对其扩增的完整CP基因核苷酸序列进行分析。结果显示,核苷酸序列相似性为99.2%~99.6%。将3个分离物与GenBank中已报道的11个ToMMV CP基因(表2)核苷酸序列和氨基酸序列进行比较,核苷酸和氨基酸序列同源性均达到98%以上。
在基于ToMMV CP基因氨基酸的进化树(图8)中,本试验中得到的3个分离物和下载的11个ToMMV CP基因氨基酸可聚为2类,2个来自以色列的ToMMV聚为一类,其余9个ToMMV和分离物Gansu-1、 Gansu-2、Gansu-3聚为一类,其中分离物Gansu-1和来自中国的TiLhaLJ关系较近,分离物Gansu-2和来自美国的S13-5聚为紧密的一族,分离物Gansu-3和来自美国的CA16-01聚为紧密的一族。
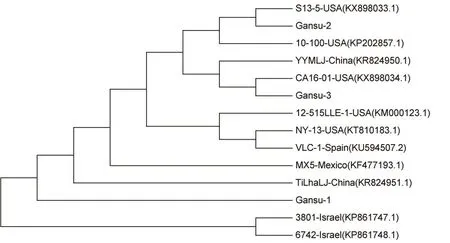
图8 基于ToMMV CP基因氨基酸序列构建的系统发育树
3 结论与讨论
帚状病毒科(Virgaviridae)烟草花叶病毒属(Tobamovirus)的成员为棒状结构,很容易通过植物之间的接触和机械接种传播,种子也可传播病毒。烟草花叶病毒属有33个种,这33个种在世界范围内广泛传播,其中TMV是第1个被鉴定的(Jacobi et al.,1998;Fillmer et al.,2015)。烟草花叶病毒属基因组编码4个蛋白,编码1个126 kD和1个183 kD复制需要的蛋白,还编码1个30 kD 的运动蛋白和1个17.5 kD的外壳蛋白(Kumar et al.,2011)。ToMMV是烟草花叶病毒属中1个新发现的病毒,于2013年首次在墨西哥报道(Li et al.,2013),继而在美国发现(Webster et al.,2014)。中国于2015年报道在云南、拉萨等地有ToMMV侵染辣椒(Li et al.,2014)。ToMMV侵染辣椒的症状为叶片斑驳花叶,皱缩和坏疽。
本试验对甘肃省农业科学院蔬菜研究所辣椒育苗棚和试验地病毒病病原种类进行了DASELISA鉴定,检测出TMV的侵染率高达66.7%。为了从分子层面进一步确认TMV病毒,在随后的RT-PCR扩增中,设计了3对TMV引物,却只有TMV1在阳性样品上扩增出了与目的片段大小相似的条带,其他2对引物没有扩增出条带。通过用琼脂糖凝胶电泳将PCR产物分离后,选取目的条带回收后连接到载体上,并转化感受态大肠杆菌,将阳性克隆测序后经NCBI BLAST检索证明与ToMMV(MX5,KF477193)序列一致性达到97%。随后针对ToMMV(MX5,KF477193)进一步设计引物,证明在甘肃省农业科学院蔬菜研究所辣椒育苗棚和试验地的病毒病病原种类为ToMMV。选取3个分离物CP基因氨基酸序列构建系统进化树,结果表明其中的2个分离物与来源于中国的2个分离物 YYMLJ(KR824951.1)、TilhaLJ(KR824951.1)关系较近。
本试验中使用TMV DAS-ELISA检测试剂盒和试纸条(试验结果未列出)均在病样上检测出阳性结果,但通过RT-PCR技术证明病毒种类为ToMMV,进一步说明烟草花叶病毒属的成员之间的交叉反应影响DAS-ELISA检测过程中对病原的准确诊断。
文朝慧,刘志杰,张丽萍,刘箐,王军平,刘雅莉,宋蕤,施颖波,侯健雄.2010.甘肃省河西地区辣(甜)椒病毒病毒原鉴定.中国蔬菜,(16):74-78.
徐秉良.2001.甘肃省辣椒病毒病毒原种群鉴定.甘肃农业大学学报,(专刊):238-243.
姚玉荣,陈国华,冯兰香,谢丙炎.2013.北运蔬菜基地辣椒病毒病病原种类的分子检测.中国蔬菜,(10):84-89.
Fillmer K,Adkins S,Pongam P D,Elia T.2015.Complete genome sequence of a Tomato mottle mosaic virus isolate from the United States.Genome Announcements,3(2):e00167-15.
Jacobi V,Bachand G D,Hamelin R C,Castello J D.1998.Development of a multiplex immunocapture RT-PCR assay for detection and differentiation of tomato and tobacco mosaic viruses.J Virol Methods,74:167-178.
Kumar S,Udaya Shankar A C,Nayaka S C,Lund O S,Prakash H S.2011.Detection of Tobacco mosaic virus and Tomato mosaic virus in pepper and tomato by multiplex RT-PCR.Letters in Applied Microbiology,53:359-363.
Li R,Gao S,Fei Z,Ling K S.2013.Complete genome sequence of a new Tobamovirus naturally infecting tomatoes in Mexico.Genome Announcements,1:e00794-13.
Li Y Y,Wang C L,Xiang D,Li R H,Liu Y,Li F .2014.First report of Tomato mottle mosaic virus infection of pepper in China.Plant Disease,98:1447.
Webster C G,Rosskopf E N,Lucas L,Mellinger H C,Adkins S.2014.First report of Tomato mottle mosaic virus infecting tomato in the United States.Plant Health Progess,15(4):151-152.
