腰椎间盘突出融合术后症状性邻近节段退变再次手术方式选择研究*
2018-06-12西安交通大学附属西安市红会医院脊柱外科西安710054
西安交通大学附属西安市红会医院脊柱外科(西安710054)
腰椎间盘突出症是脊柱外科常见病及多发病,治疗方法有很多种,选择腰椎融合的目的是为了稳定腰椎和减少椎间盘再复发,然而椎间融合后会引发相邻节段应力增加,导致发生退变的可能性增大[1-2]。对于腰椎融合术后邻近节段退变(Adjacent segment disease,ASD)引发临床症状经过严格保守治疗无效时,往往需要再次手术来缓解症状。选择哪一种手术方式一直困扰着临床医师,若选择经典手术后路开窗髓核摘除,术后可能会出现复发及不稳定需要再次进行融合手术。然而若直接选择融合手术,会再次引发融合后相邻节段继续发生 ASD的风险,从而行成恶性循环。就症状性的ASD如何选择较佳手术方案,系统报道较少,本研究回顾性分析腰椎间盘突出融合术后症状性邻近节段突出再手术的病例,对治疗方法进行经验总结,为症状性的ASD手术方案制定提供参考。
资料与方法
1 一般资料 收集2008年12月至2015年12月本院收治因腰椎间盘突出融合术后症状性邻近节段突出再手术的病例19例,男11例,女8例,平均年龄(58.6±7.3)岁;首次手术在外院进行15例,本院4例;病变节段分布为 L3/45 例,L4/511例,L5/S13例,平均复发时间4.7年(3.9~6.4 年);患者再次手术前均行常规腰椎正侧位、动力位X 线片表现为腰椎矢状位不稳定4例,腰椎 CT 观察首次腰椎间盘突出融合情况,行腰椎MR检查观察ASD合并椎管狭窄10例。
2 手术方式 19例均采用全身麻醉。①对ASD责任间隙,动态位未见明显不稳,腰椎MR检查无中央管及后方黄韧带肥厚引发椎管狭窄患者选取则以经皮椎间孔镜髓核摘除术5例(图1)。②ASD责任间隙伴有动态位不稳或椎管狭窄,考虑原融合间隙已完成融合,取出内固定,共用上方或下方钉道,更换直径较粗椎弓根螺钉,行TLIF手术14例(图2)。
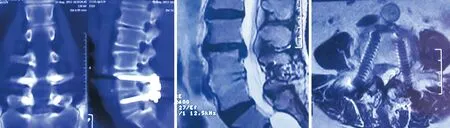
图1 患者行L4-5行TLIF术后6年,发生邻近L3-4椎间盘再突出

图2 患者在外院行L4-S1椎间盘切除后外侧融合术4年,邻近L3-4椎间盘再次突出伴椎管狭窄。术中探查L5-S1小关节完全骨性融合满意(黑箭头),行内固定取出后,再次TLIF
3 术后处理 术后静脉给予抗生素1 d。脱水治疗2 d,行椎间孔镜手术患者术后3 d佩戴腰部支具辅助下床活动,持续佩戴1个月。1个月内减少腰部负重及剧烈运动。行TLIF术后2~4 d拔除伤口引流管、1周后佩戴腰部支具辅助下床活动,持续3个月,期间避免腰部负重及剧烈运动。如果术后出现脑脊液漏则延长引流管拔管时间至7d,期间注意脑脊液量的变化来调整液体总量。
4 临床疗效评定 术后 3、6、9个月及1年定期复查,采用视觉模拟评分法VAS、ODI再手术前、术后及末次随访各评价1次,比较临床症状改善差异是否有统计学意义,以后每半年复查1次。临床疗效按照改良Macnab 法分为优、良、可、差。优:症状和体征消失,恢复正常丁作;良:偶有疼痛, 可恢复工作;可:症状有改善, 但仍有疼痛,可以工作;差:症状无改善或加重, 括约肌功能障碍,不能坚持工作。
5 统计学方法 采用SPSS 18.0统计学软件,对手术前后的VAS、ODI评分进行比较,以P<0.05为差异有统计学意义。
结 果
19例患者均顺利完成手术,平均随访时间16个月(15~38个月),末次随访VAS评分2.34±0.61分、ODI评分为(18.55±7.21)%,出现硬脊膜破裂4例,给予间断性缝合后再覆盖人工硬脊膜,术后发生脑脊液漏1例。Mac Nab标准评定疗效:优10例(52.63%),良6例(31.58%),可3例(15.79%),差0例,优良率84.21%。术前平均腰椎ODI功能评价(56.21±2.74)%,术后下降为(19.65±2.48)%; VAS评分术前(7.46±0.37)分,术后下降为(2.58±0.72)分;术后较术前均显著减低,差异均有统计学意义(P<0.01)。但末次随访时VAS和ODI评分与术后比较,差异没有统计学意义(P=0.173)。
讨 论
目前对于腰椎间盘突出症手术治疗,选择传统髓核摘除术据Shimia等[3]回顾文献其复发率占5%~15%,为了减少再复发及术后的腰椎不稳等并发症,传统经典的髓核摘除术逐步向腰椎融合过度并成为流行趋势,不幸的是腰椎融合术后因应力改变致相邻节段间盘突出。根据Park等人[4]研究腰椎融合术后有症状的邻近节段退变性疾病的其发生率5.2%~18.5%。我们对比不难发现传统髓核摘除术的复发率明显小于融合后的症状性ASD发生率。因此本次研究考虑对于处理症状性ASD,首选考虑进行髓核摘除术,然而因首次手术破坏脊柱后方解剖结构,再次行椎板开窗必须充分暴露椎板及小关节突,切开瘢痕组织出血明显会增加,显露时寻找突出髓核组织势必要进行牵拉硬膜囊及神经根,因下方瘢痕黏连,硬膜囊及神经根牵拉幅度会降低,出现损伤机会明显加大。Choi等人[5]研究中发现对翻修手术采用开窗髓核摘除术时硬膜囊撕裂发生率高达20%。本次研究中我们对14例患者进行TLIF融合时出现4例(4/14)占28.57%的硬脊膜损伤,其中显露时损伤出现3例损伤,主要发生在ASD责任间隙下方,首次减压是范围较大,硬膜囊与后方结构粘连较重,牵拉时损伤1例。如何避免硬膜囊损伤,改变手术路径可能是最为直接方法,经皮椎间孔镜下髓核摘除术(Percutaneous endoscopic lumbar discectomy,PTED)的出现及发展为症状性ASD的治疗开拓了新的天地。余晓杰等人[6]对58例腰椎间盘突出症患者在局麻下行PTED手术治疗术后3个月时优良率为89.7%。其优势在于:①因PTED手术入路从侧后方进入可以有效地避开首次后路手术形成的瘢痕组织减少出血;②不需要显露后方上下关节突及关节囊的破坏,保留了脊柱后柱的完整及稳定性减少ASD发生;③手术在局麻下进行,患者处于清醒状态,减少对手术恐惧心理,易于患者接受。④创伤较小,切口美观,并且术后患者无腰背僵硬感。
对于症状性ASD伴有动态不稳或椎管狭窄时,考虑进行再次减压固定融合手术。本研究中无论是首次手术采用PLF还是TLIF,因平均复发时间4.7年原固定融合节段已经骨性融合,并发现本次研究中共有19例患者出现症状性ASD,其中PLF患者13例,TLIF患者6例。目前的病例收集中体现PLF发生ASD的机率明显大于TLIF,作者推测可能与植骨融合率有关。根据Yee 等[7]进行回顾性队列研究发现,TLIF 术后 ASD 发生率较传统开放手术低。因此研究中对14例不稳或合并椎管狭窄患者均行腰椎后路椎间融合术(TLIF)将内固定物取出共用其椎体上方或下方钉道,更换直径较粗螺钉。术前ODI评分由56.21±2.74%下降为19.65±2.48%,VAS评分由术前7.46±0.37分下降为2.58±0.72分。短期随访平均16个月,未见复发,疗效满意优良率达82.35%。 据Smorgick等人[8]报道行腰椎后路翻修手术的失血量平均为1606ml,较首次手术平均增加 16%。 手术时间明显延长, 神经及硬脊膜损伤明显增加,本次手术中出现4例硬膜囊撕裂,均给予间断性缝合,术后仍有1例发生脑脊液漏,延长拔管时间及住院日,未影响手术疗效。随着融合节段的增加,其相邻节段的应力会再次加大, 再加上这部分患者年龄相对较大,相邻椎间盘本身都存在一定程度的自然退变,因此,这些患者继续发生 ASD 的风险也相对较大。Cheh等人[9]通过5年随访发现随着融合节段的逐步增加,ASD也呈上升趋势,单节段ASD 发生率为27.2% ,双节段为35.0%、三或四节段为45.1%。因此严格把握手术适应证,尤其对初次采用融合方案时务必谨慎,从源头上阻断恶性循环,这对减少ASD 的发生有十分重要的意义。对腰椎融合术后ASD预防,目前最新研究报道采用PEEK棒杂交术与钛棒双节段融合术进行对比研究随访2年,观察术后邻近节段退变(ASD)情况。结果杂交组无ASD发生,融合组有6例患者发生ASD,发生率为26%, PEEK棒杂交术延缓ASD有明显的优势[10]。其次动态内固定系统(如 Dynesys ),能够保留脊柱责任节段活动度,从理论上来说,可以减少 ASD 的发生率。 Mashaly等人[11]对28例腰椎管狭窄症状伴有ASD患者,发现在充分减压的同时,运用 Dynesys系统内固定临床效果明显,随访2~8年中未再次进行手术。
因此,对于腰椎间盘突出融合术后症状性邻近节段突出,若未合并椎管狭窄和失稳时,可以考虑行椎间孔镜下髓核摘除术,短期疗效确切,选择再次固定融合时务必慎重,并且可以尝试使用PEEK棒杂交技术,进一步论证其临床疗效。由于本研究涉及病例数量较少,观察时间较短,再次融合术后发生ASD时间,所得结论尚需进一步大样本研究随访来证实。
[1] Hilibrand AS,Robbins M.Adjacentse gmentde generationandadja centsegment disease: the consequences of spinal fusion[J].Spine J, 2004, 4(6 Suppl): S190-194.
[2] Helgeson MD, Bevevino AJ, Hilibrand AS. Update on the evidence for adjacent segment degeneration and disease [J].Spine J, 2013, 13(3): 342-351.
[3] Shimia M, Babaei-Ghazani A, Sadat B E,etal. Risk factors of recurrent lumbar disk herniation[J]. Asian J Neurosurg, 2013, 8(2): 93-96.
[4] Park P, Garton HJ, Gala VC,etal.Adjacent segment disease after lumbar or lumbosacral fusion: review of the literature[J].Spine,2004,29(17):1938-44.
[5] Choi KB, Lee DY, Lee SH. Contralateral reherniation after open lumbar microdiscectomy : a comparison with ipsilateral reherniation[J]. J Korean Neurosurg Soc,2008,44(5):320-6.
[6] 余晓杰,蒙思锋,唐光伟,等.经皮椎间孔镜治疗腰椎间盘突出症的临床观察[J].陕西医学杂志,2017,46(1):75-77.
[7] Yee TJ, Terman SW, La Marca F,etal. Comparison of adjacent segment disease after minimally invasive or open transforaminal lumbar interbody fusion[J].J Clin Neurosci,2014 ,21(10):1796-801.
[8] Smorgick Y, Baker KC, Bachison CC,etal.Hidden blood loss during posterior spine fusion surgery [J]. Spine J, 2013, 13(8):877-81.
[9] Cheh G, Bridwell KH, Lenke LG,etal. Adjacent segmentdisease following lumbar /thoracolumbar fusion with pediclescrew instrumentation:a minimum 5 -year follow -up [J].Spine, 2007, 32(20): 2253-2257.
[10] 韩志伟,于秀淳,黄伟敏,等. 杂交与融合手术治疗双节段腰椎退变性疾病的对比[J]. 中国矫形外科杂志,2017,25(13):1158-1163.
[11] Mashaly H, Paschel EE, Khattar NK,etal. Posterior lumbar dynamic stabilization instead of arthrodesis for symptomatic adjacent -segment degenerative stenosis: description of a novel technique[J]. Neurosurg Focus, 2016, 40(1): E5.
