环境因子对微藻胞外多聚物主要组分的影响
2018-06-12吴琪璐崔文倩卢英华
吴琪璐,崔文倩,沈 亮,卢英华
(厦门大学化学化工学院,福建 厦门 361005)
利用微藻处理污水的生态修复技术已经成为世界上有关环境治理和能源发展方面最热门的研究方向之一,然而,利用污水培养微藻往往面临环境条件波动大以及营养元素不均衡等问题.为了得到更好的污水处理效果,需要进一步研究微藻的生长特性,包括其胞外多聚物(extracellular polymeric substances,EPS)的组分.一般而言,EPS是由微生物分泌到胞外的复杂混合产物,主要包括多糖、蛋白质、脂质、核酸和其他一些高分子聚合物[1-2].根据存在状态,EPS又可分可溶性EPS(soluble EPS,S-EPS)和结合性EPS(bound EPS,B-EPS)[3-4].S-EPS主要存在于培养基质中或者轻轻附着在细胞表面,B-EPS则紧密结合在细胞表面.EPS在细胞的生长、聚集和生物膜形成等方面发挥很重要的作用.EPS的存在会影响微藻的絮凝,这在微藻污水处理后收集藻细胞中起关键作用.
目前对于EPS组分的研究主要针对胞外多糖和蛋白质:多糖是EPS中含量最高的组分,除个别藻细胞分泌的胞外多糖为均聚物外,大多数为带有不同取代基的杂多糖[5];蛋白质是EPS的另一个重要组分,目前发现绿藻的EPS中多为糖蛋白[6].不同生长时期和条件下,微藻的蛋白质在EPS中所占比例不同,富氮培养条件下蛋白质所占比例更高[7].
EPS的产生受到许多外界因素的影响.首先,培养基质的不同会对EPS产量产生影响,研究发现活性污泥中醋酸盐作为碳源比葡萄糖作为碳源产生的EPS更多[8].其次,微生物的兼养、自养和异养间的变化对EPS也会产生影响,从兼养变为异养会给微生物带来环境压力,从而产生更多EPS[9].再者,不同的营养元素含量也会产生影响,如:在污水中生长的微藻受氮、磷等营养元素含量的影响,当氮和磷含量都低于标准液体培养基中的含量时,藻细胞会产生大量EPS[10];活性污泥产生的EPS则随着环境中碳氮比的降低,其蛋白质和多糖的比例升高[11].此外,还有一些其他外界条件影响微藻EPS的分泌,其中常见的是一些有毒成分,如重金属元素的存在会加剧EPS的分泌[12].
本研究中选择4种常见的淡水微藻,分别考察氮源含量、pH值、温度和培养方式对EPS组分和含量的影响,以期获得微藻对于环境的适应性生长条件,为微藻污水处理应用和藻细胞收集提供理论依据.
1 材料与方法
1.1 实验材料
实验中使用的4种微藻分别为葡萄藻(Botryococcussp.NJD-1)、栅藻(Scenedesmussp.NJD-5)、小球藻A(Chlorellasp. NJD-3)以及小球藻B(Chlorellasp. NJD-10),由本课题组从本地一家污水处理厂污水环境中分离得到,均属于绿藻.
1.2 绿藻的培养

组分含量按每克细胞中的质量计,不同.图1 4种微藻EPS中多糖(a)和蛋白质(b)含量的对比Fig.1 Contents of polysaccharide (a) and protein (b) in EPS of four different microalgae
采用BG11液体培养基进行无菌分批培养,培养过程包括预培养和培养两个阶段.
在异养条件下,预培养阶段持续4 d,首先在250 mL锥形瓶中加入100 mL灭菌液体培养基(含10 g/L葡萄糖),pH值调至7(用1 mol/L HCl溶液和1 mol/L NaOH溶液调节,下同),再加入10 mL藻液,置于30 ℃、150 r/min的恒温摇床中培养.培养阶段持续12 d,首先在250 mL锥形瓶中加入150 mL灭菌液体培养基(含10 g/L葡萄糖),将pH值调至7,再加入一定量预培养的藻液,其他条件与预培养阶段一致.
在自养条件下,预培养阶段持续4 d,首先配制500 mL灭菌液体培养基,pH值调至7,再向其中加入10 mL藻液,24 h光照(飞利浦TWG121/2005型支架灯管4根,功率21 W),恒温30 ℃,经过灭菌过滤膜通入CO2(纯度≥99.9%),气体流量保持在100 mL/min.培养阶段持续12 d,首先配制1 L灭菌液体培养基,将pH值调至7,再向其中加入一定量预培养的藻液,其他条件与预培养阶段一致.
上述条件即为标准培养条件.分析环境因子对微藻EPS的影响,仅改变单一环境条件,其他条件均不变,其中缺氮培养条件指将培养基中氮的含量减少50%.
1.3 EPS的提取
微藻EPS的分离提取选用超声降解法[13]:首先在不同培养时间的摇瓶中取4 mL微藻样品,在9 000 r/min转速下离心15 min,上清液即为S-EPS;沉淀重新用磷酸盐缓冲液(10 mmol/L NaCl,1.2 mmol/L KH2PO4,6 mmol/L Na2HPO4)溶解,将样品放入冰水中,在40%最大功率的条件下进行超声处理2 min;然后在9 000 r/min转速下离心15 min,上清液即B-EPS.利用丙酮提取的方法测定总的EPS干质量:取一定量培养过程中的微藻样品,用Whatman No.1滤膜进行过滤,保留清液,1 000 r/min转速下离心10 min;取上清液,加入等体积的丙酮,在4 ℃条件下保存48 h;之后10 000 r/min转速下离心10 min,保留沉淀,冻干24 h即得EPS并称量其干质量[14].
1.4 藻细胞生长指标测定与组分分析
取4 mL微藻样品于离心管,10 000 r/min转速下离心10 min后倒去上清液,保留沉淀,放入60 ℃烘箱烘干24 h后进行称量,该质量减去空管质量即为藻细胞干质量;同时采用双光束紫外-可见分光光度计在波长680 nm条件下检测同一微藻样品的光密度(OD),绘制OD值与藻细胞干质量的标准曲线.蛋白质测定采用考马斯亮蓝法[15],使用Bradford染色剂.多糖测定采用苯酚-硫酸法[16].所有实验重复3次,结果取平均值.
2 结果与讨论
2.1 缺氮对不同微藻EPS的影响
2.1.1 标准条件下微藻EPS组分比较
在异养标准培养状态下测定4种微藻的EPS组分含量,结果如图1所示:小球藻B的EPS中多糖含量明显大于其他3种微藻,经过最初微藻迅速生长的变化阶段,从第8天开始稳定在约0.56 g;小球藻A的多糖含量次之,从第4天开始稳定在约0.21 g;葡萄藻和栅藻中多糖含量均较低(图1(a)).小球藻B的EPS中蛋白质含量最高,最大值达到0.12 g;小球藻A的蛋白质含量则基本稳定在0.03 g左右,即50 mg/L(上清液),与前人研究结果[8]相似;而栅藻的蛋白含量最低,最大值仅0.001 4 g(图1(b)).综上,2种小球藻分泌的EPS中多糖与蛋白质的含量高于葡萄藻和栅藻.
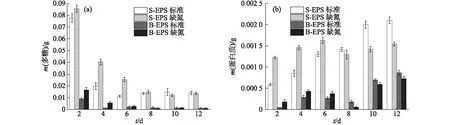
图2 葡萄藻的EPS中多糖(a)和蛋白质(b)含量的变化Fig.2 Changes of polysaccharide (a) and protein (b) contents in EPS of Botryococcus sp. NJD-1
对4种微藻在标准生长条件下的生物量情况进行分析,结果显示葡萄藻最快(第4天)达到生物量最大值14.97 g/L,另外3种微藻在第6天后才达到生物量最大值(栅藻16.67 g/L,小球藻A 1.64 g/L,小球藻B 0.95 g/L).虽然葡萄藻长势最好,但是以单位生物量来衡量EPS组分含量时发现其EPS中多糖含量最低.已有研究发现微生物细胞在底物限制时可利用EPS中的物质作为碳源和能量来源[17],由于葡萄藻生长速率较快,栅藻生物量较高,相同培养条件下葡萄藻和栅藻更容易受底物限制,所以可能会吸收更多的EPS多糖作为自身能量来源.
2.1.2 缺氮条件下4种微藻EPS组分比较
氮作为微藻生长过程中重要的营养元素,起着至关重要的作用.有机氮存在于许多生物基质中,如肽、蛋白质、酶、叶绿素、能量转移分子(ADP和ATP)和基因材料(RNA和DNA).有机氮的无机来源包括硝酸根(NO3-)、亚硝酸根(NO2-)、硝酸(HNO3)、铵根(NH4+)、氨(NH3)和氮气(N2).微藻在无机氮通过同化作用转化为有机氮的过程中起着决定性作用.
对葡萄藻、栅藻、小球藻A和小球藻B分别进行标准培养和缺氮培养条件下的实验,结果显示2种培养条件下的多糖含量均远大于蛋白质含量,但是在不同微藻的生长过程中两者变化趋势有所差异(图2).
葡萄藻EPS中多糖含量的变化如图2(a)所示.总体来看基本均呈下降趋势,且前6天的下降速率极快.生长初期在S-EPS和B-EPS中,缺氮培养条件下的多糖含量均高于标准培养条件下,其中第4天和第6天的S-EPS中多糖含量均高出标准培养条件下50%以上;但生长至第10天后,葡萄藻生长状态趋于稳定,2种培养条件下多糖的含量基本相同,随之趋于稳定,S-EPS中的多糖含量均维持在0.014 g左右;在同一培养条件下,B-EPS中的多糖含量远低于S-EPS中,到稳定期时B-EPS中的多糖含量仅有0.001 g.
葡萄藻EPS中蛋白质含量的变化如图2(b)所示.总体来看S-EPS中的蛋白质含量均大于B-EPS中.标准培养条件下葡萄藻的S-EPS中蛋白质含量不断增加,前6天虽低于缺氮培养条件下,但在生长稳定期超过缺氮培养条件下,在第12天达到0.002 1 g.这可能是因为缺氮培养的葡萄藻在生长初期会因为缺氮带来的环境压力促使细胞分泌更多蛋白质,但到了后期,环境中缺少氮源,葡萄藻开始吸收之前释放的蛋白质来满足生长的营养需求;然而在标准培养条件下,葡萄藻生长迅速,其细胞数量更多,在分批培养初始底物浓度相同情况下死亡的细胞也更多,细胞死亡破裂释放出蛋白质导致其含量不断增加.
综上,葡萄藻EPS中多糖含量逐渐减少,而蛋白质含量略微增多,这可能是因为葡萄藻在逐渐分泌EPS的同时也会吸收EPS中的组分,其对EPS中多糖的吸收量大于分泌量而对蛋白质的吸收量小于分泌量,所以出现上述变化趋势.

图3 栅藻的EPS中多糖(a)和蛋白质(b)含量的变化Fig.3 Changes of polysaccharide (a) and protein (b) contents in EPS of Scenedesmus sp. NJD-5
栅藻EPS中多糖含量的变化与葡萄藻类似.如图3(a)所示,总体上多糖含量在生长初期急速下降,缺氮培养条件下的多糖含量均高于标准培养条件下;但到了生长稳定期(第10天后)相差不大,标准培养和缺氮培养条件下的S-EPS中多糖含量分别稳定在0.025和0.030 g.这可能是因为栅藻生长后期大量的细胞衰老并死亡,从而造成细胞破裂,释放出了一定量的多糖.此外,S-EPS中的多糖含量始终高于B-EPS中.由于栅藻EPS中蛋白质含量相对较低,测定误差较大,所以仅选取培养初期(第2天)和末期(第12天)进行对比.由图3(b)可知,2种培养条件下,其S-EPS中的蛋白质含量均有所增加,但B-EPS中的蛋白质含量在标准条件下变化不大,甚至略有减少,而在缺氮条件下则有所增加.
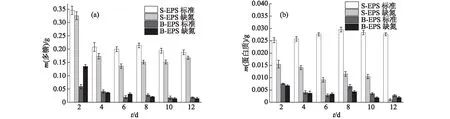
图4 小球藻A的EPS中多糖(a)和蛋白质(b)含量的变化Fig.4 Changes of polysaccharide (a) and protein (b) contents in EPS of Chlorella sp. NJD-3
小球藻A的EPS中多糖含量的变化如图4(a)所示,在标准培养条件下S-EPS中多糖含量明显高于缺氮培养条件下,而B-EPS中除培养初期外则基本相同,这与葡萄藻和栅藻的结果不同,但整体变化趋势基本一致.小球藻A的EPS中蛋白质含量的变化与葡萄藻和栅藻有所差别,如图4(b)所示,除标准培养条件下S-EPS中蛋白质含量变化不大外,其余均呈减少趋势.这可能是因为小球藻A在缺氮培养条件下生物量更大,且生长速率更快,需要更多的氮源,此时蛋白质可作为有效的氮源被细胞吸收利用,所以蛋白质含量逐渐减少.此外,与葡萄藻类似,小球藻A的S-EPS中的蛋白质含量始终高于B-EPS中,标准培养条件下S-EPS中的蛋白质含量最高可达到0.030 g.
如图5(a)所示,小球藻B的S-EPS中多糖含量在2种培养条件下,生长至第8天后均稳定在0.45 g左右;B-EPS中则稳定在相对较低的水平,标准培养条件下最后维持在0.11 g,而缺氮培养条件下仅为0.041 g,这可能与其生长稳定期的细胞数量较少有一定关系.从图5(b)中可见,小球藻B生长至稳定期后,S-EPS中的蛋白质含量明显高于B-EPS中,这与多糖含量的结果一致;并且在缺氮培养条件下,由于细胞对EPS中蛋白质的吸收利用,蛋白质含量整体呈下降趋势.
2.1.3 不同微藻EPS中多糖和蛋白质含量比较
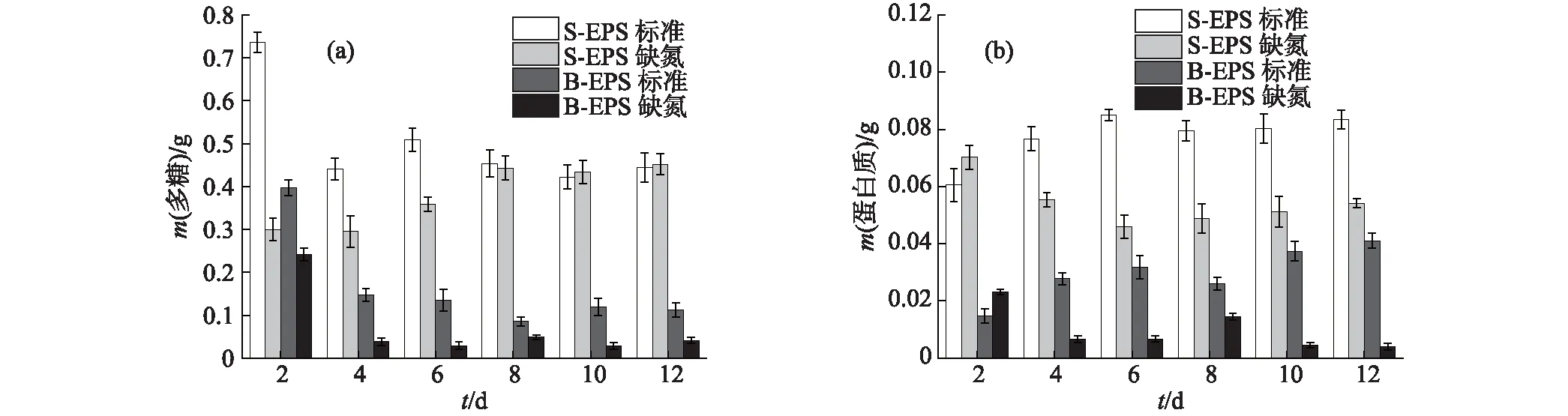
图5 小球藻B的EPS中多糖(a)和蛋白质(b)含量的变化Fig.5 Changes of polysaccharide (a) and protein (b) contents in EPS of Chlorella sp. NJD-10
由于栅藻的EPS中多糖含量变化与葡萄藻类似且蛋白质含量极少,表1仅列出了葡萄藻、小球藻A和小球藻B在标准和缺氮2种培养条件下EPS的总量及其中多糖和蛋白质的质量分数.由表1可知,微藻在缺氮培养条件下EPS中多糖和蛋白质的质量分数相对于标准培养条件下有所降低,其中多糖质量分数降低最多的为葡萄藻,下降了22.7%,而蛋白质质量分数降低最多的为小球藻A,下降了56.0%,这说明缺氮培养会导致EPS的组成发生变化.葡萄藻和小球藻B的EPS总量在缺氮培养条件下均有所减少,而小球藻A在缺氮培养条件下相对于标准培养条件下增加了约29.3%,这可能与小球藻A在缺氮培养条件下生长更好有关,符合已有文献报道的培养条件改变会导致微生物EPS组分比例发生改变,且变化趋势和微生物种类、生长情况和改变的培养条件等有关[18-20].

表1 3种微藻的EPS总量及多糖和蛋白质组分的质量分数
综合以上结果及微藻自身的生长情况,鉴于葡萄藻有一定代表性,且能在不适宜生长的条件中保持稳定生长,后续实验选择葡萄藻研究pH值、温度和培养方式对EPS组分的影响.
2.2 pH值对葡萄藻EPS组分的影响
2.2.1 多糖含量
培养阶段分别在pH值为5,7,9和11条件下进行葡萄藻的培养及EPS组分的分析,所得EPS中多糖含量的变化结果如图6所示.由图6(a)可知:当pH值为11时,S-EPS中的多糖含量始终大于同时期其他pH条件下,到第12天时仍能达到0.15 g;而pH值为7时,生长稳定后S-EPS中的多糖含量最低.B-EPS中的多糖含量如图6(b)所示,总体上远小于S-EPS中,pH值为11时的最大值也仅有0.021 g;与S-EPS中的结果类似,pH值为11时的B-EPS中多糖含量始终高于同时期其他pH条件下,且pH值为7时,生长稳定后B-EPS中的多糖含量最低.
2.2.2 蛋白质含量
pH值对EPS中蛋白质含量的影响如图7所示.由图7(a)可知:S-EPS中的蛋白质含量随着葡萄藻的生长整体呈增大趋势,在生长稳定后,pH值为5时的蛋白质含量明显大于其他pH条件下,最高达到0.004 5 g;在pH值为9时,生长稳定后的蛋白质含量最低.因为葡萄藻B-EPS中蛋白质含量相对较低,测定结果存在较大误差,所以选取培养初期(第2天)和培养末期(第12天)进行蛋白质含量的测定并对比,结果如图7(b)所示:生长初期,pH值为11时的蛋白质含量最高,达0.002 6 g,而pH值为7时最低;但随着葡萄藻的生长,到了生长末期,pH值为11时的蛋白质含量明显降低,仅有0.000 4 g,而pH值为7时的蛋白质含量则明显升高,达0.000 9 g.
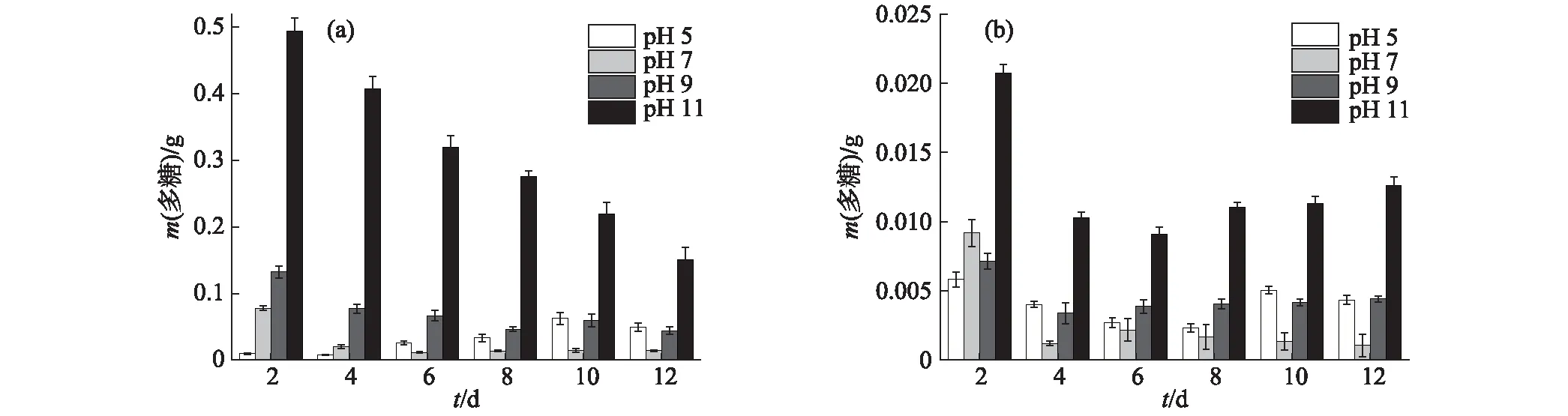
图6 葡萄藻在不同条件下S-EPS(a)和B-EPS(b)中多糖含量的变化Fig.6 Changes of polysaccharide contents in S-EPS(a) and B-EPS(b) of Botryococcus sp. NJD-1 under different pH values

图7 葡萄藻在不同pH条件下S-EPS(a)和B-EPS(b)中蛋白质含量的变化Fig.7 Changes of protein contents in S-EPS (a) and B-EPS (b) of Botryococcus sp. NJD-1 under different pH values

图8 葡萄藻在不同温度条件下EPS中多糖(a)和蛋白质(b)含量的变化Fig.8 Changes of polysaccharide (a) and protein (b)contents in the EPS of Botryococcus sp. NJD-1 at different temperature
2.3 温度对葡萄藻EPS组分的影响
葡萄藻在不同温度条件下EPS中多糖含量的变化如图8(a)所示:总体来看,多糖含量随着葡萄藻的生长呈降低趋势,温度为25 ℃时葡萄藻倾向于分泌更多的多糖,S-EPS和B-EPS中的多糖含量均高于30 ℃时.这一结果也印证了EPS的分泌是微藻对恶劣环境的一种响应机制:在30 ℃时,葡萄藻处于适宜的生长环境中,EPS的分泌减少;而当温度降低到25 ℃时,温度条件偏离了葡萄藻适应范围,葡萄藻减缓生长进而分泌出更多的多糖.不同温度条件下,EPS中蛋白质含量的变化如图8(b)所示:当温度为25 ℃时,S-EPS中的蛋白质含量随着葡萄藻的生长快速增加,B-EPS中则在初期快速增加后趋于稳定;与25 ℃相比,30 ℃时S-EPS和B-EPS中的蛋白质含量均维持在极低的水平,与多糖的结果一致.
2.4 自养和异养对葡萄藻EPS组分的影响

图9 葡萄藻在异养和自养条件下EPS的多糖(a)和蛋白质(b)含量的变化Fig.9 Changes of polysaccharide(a) and protein(b)contents in EPS of Botryococcus sp. NJD-1 under autotrophic and heterotrophic conditions
将葡萄藻在自养和异养2种培养条件下的EPS组分进行对比分析,结果如图9所示.从图9(a)可以明显看出:葡萄藻在自养培养条件下多糖含量在初期下降后趋于稳定,且生长稳定后S-EPS中的多糖含量(约0.006 3 g)远低于异养条件下(约0.014 0 g);B-EPS中多糖含量随着葡萄藻生长逐渐下降,至生长稳定后,自养条件下的多糖含量略高于异养条件下.蛋白质含量的变化如图9(b)所示:异养培养条件下的葡萄藻EPS中蛋白质含量整体呈上升趋势,而自养培养条件下的葡萄藻则在初期分泌出大量蛋白质后,随着细胞增长蛋白质含量降低,在生长到达稳定期后又有所上升.此外,在相同培养条件下多糖的总含量始终大于蛋白质的总含量,印证了之前相关研究[13]所得的结论.
3 结 论
微藻在适宜的培养基中生长时,EPS中多糖的含量会随着细胞增多而下降,蛋白质含量则呈现相反趋势.对比本研究中的4种微藻,小球藻释放更多的多糖和蛋白质.氮作为微藻生长的必要元素,其减少不一定会抑制微藻的生长,但会迫使微藻细胞从其他来源吸收营养,因此缺氮培养条件会造成EPS中的蛋白质含量减少.环境呈碱性(pH值为11)会刺激葡萄藻产生更多EPS多糖和蛋白质,含量与中性(pH值为7)时相比分别增加0.135和0.018 g.温度的降低(从30至25 ℃)可使葡萄藻EPS中多糖和蛋白质的含量急剧增加,最高达约40倍.自养和异养的培养类型改变对葡萄藻EPS中多糖和蛋白质含量的影响不同,自养会导致EPS中出现大量蛋白质,而异养则会产生更多的多糖,这与其对于碳源利用方式的不同有关.综上,本研究初步探讨了各种外界环境条件对微藻EPS多糖和蛋白质的影响规律,对于了解微藻处理污水时的生长情况和取得更好的集藻效果有一定指导意义.
[1] PARK C,NOVAK J T,HELM R F,et al.Evaluation of the extracellular proteins in full-scale activated sludges[J].Water Research,2008,42(14):3879-3889.
[2] SHENG G P,YU H Q,LI X Y.Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review[J].Biotechnology Advances,2010,28(6):882-894.
[3] YANG Z,KONG F,SHI X,et al.Changes in the morphopogy and polysaccharide content ofMicrocystisaeruginosa(Cyanobacteria) during flagellate grazing(1)[J].Journal of Phycology,2008,44(3):716-720.
[4] QU F,LIANG H,WANG Z,et al.Ultrafiltration membrane fouling by extracellular organic matters (EOM) ofMicrocystisaeruginosain stationary phase:influences of interfacial characteristics of foulants and fouling mechanisms[J].Water Research,2012,46(5):1490-1500.
[5] DE JESUS RAPOSO M F,DE MORAIS A M M B,DE MORAIS R M S C.Bioactivity and applications of polysaccharides from marine microalgae[M]∥RAMAWAT K G,MERILLON J-M.Polysaccharides:bioactivity and biotechnology.Cham:Springer International Publishing,2015:1683-1727.
[6] PAULSEN B,ASLAKSEN T,S.FREIRE-NORDI C,et al.Extracellular polysaccharides fromAnkistrodesmusdensus(Chlorophyceae)[J].Journal of Phycology,1998,34(4):638-641.
[7] WANG M,KUO-DAHAB W C,DOLAN S,et al.Kinetics of nutrient removal and expression of extracellular polymeric substances of the microalgae,Chlorellasp. andMicractiniumsp.,in wastewater treatment[J].Bioresour Technol,2014,154:131-137.
[8] LI X Y,YANG S F.Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation,sedimentation and dewaterability of activated sludge[J].Water Research,2007,41(5):1022-1030.
[9] SHIPIN O V,MEIRRING P,PHASWANA R,et al.Integrating ponds and activated sludge process in the PETRO concept[J].Water Research,1999,33(8):1767-1774.
[10] BOONCHAI R,KAEWSUK J,SEO G.Effect of nutrient starvation on nutrient uptake and extracellular polymeric substance for microalgae cultivation and separation[J].Desalination and Water Treatment,2014,55(2):360-367.
[11] LIU Y,FANG H H P.Influences of extracellular polymeric substances (EPS) on flocculation,settling,and dewatering of activated sludge[J].Critical Reviews in Environmental Science and Technology,2003,33(3):237-273.
[12] 陈长平,徐华林,梁君荣,等.镉离子对红树林底栖硅藻新月筒柱藻胞外多糖的影响[J].厦门大学学报(自然科学版),2013,52(1):122-126.
[13] XU H,CAI H,YU G,et al.Insights into extracellular polymeric substances of cyanobacteriumMicrocystisaeruginosausing fractionation procedure and parallel factor analysis[J].Water Research,2013,47(6):2005-2014.
[14] ABREU I,CERDA M E,DE NANCLARES M P,et al.Boron deficiency affects rhizobia cell surface polysaccharides important for suppression of plant defense mechanisms during legume recognition and for development of nitrogen-fixing symbiosis[J].Plant and Soil,2012,361(1):385-395.
[15] HAMMOND J B W,KRUGER N J.The Bradford method for protein quantitation[J].Methods in Molecular Biology,1994,32(32):9.
[16] TAYLOR K A C C.A modification of the phenol/sulfuric acid assay for total carbohydrates giving more comparable absorbances[J].Applied Biochemistry and Biotechnology,1995,53(3):207-214.
[17] DURMAZ B,SANIN F D.Effect of carbon to nitrogen ratio on the composition of microbial extracellular polymers in activated sludge[J].Water Science and Techno-logy,2001,44(10):221-229.
[18] LIU L Z,HUANG Q,ZHANG Y L,et al.Excitation-emission matrix fluorescence and parallel factor analyses of the effects of N and P nutrients on the extracellular polymeric substances ofMicrocystisaeruginosa[J].Limnologica,2017,63:18-26.
[19] METIVIER R,BOURVEN I,LABANOWSKI J,et al.Interaction of erythromycin ethylsuccinate and acetami-nophen with protein fraction of extracellular polymeric substances (EPS) from various bacterial aggregates[J].Environ Sci Pollut Res Int,2013,20(10):7275-7285.
[20] ZHANG W J,CAO B D,WANG D S,et al.Variations in distribution and composition of extracellular polymeric substances (EPS) of biological sludge under potassium ferrate conditioning:effects of pH and ferrate dosage[J].Biochemical Engineering Journal,2016,106:37-47.
