乳酸菌对口腔幽门螺杆菌的拮抗作用
2018-06-11孙宗科李琳李亚鹏张莹冯海霞车团结高恺
孙宗科,李琳,李亚鹏, 张莹,冯海霞,车团结,高恺,
1.甘肃省医疗器械检验检测所,甘肃兰州 730000;2.甘肃省功能基因组与分子诊断重点实验室,甘肃兰州 730000
幽门螺杆菌(Helicobacter pylori,以下简称HP),自1983年被成功地从胃镜活检标本中培养出来[1],关于消化性溃疡HP存在的意义引起国内外专家的重视。1994年世界卫生组织/国际癌症研究机构(WHO/IARC)将幽门螺杆菌定为I类致癌原。有研究表明[2]患有消化性疾病患者口腔Hp与其胃粘膜内的形态学和生物学特征相似,具有同源性。治疗HP感染的常用方法是质子泵抑制剂加两种抗生素的三联疗法,但随之产生的耐药菌株的增多, 使得疗效下降, 感染复发率高。近年来, 利用微生态制剂通过多种途径拮抗病原菌, 减少了耐药性的发生, 为控制细菌感染性疾病提供了新的途径[3]。有研究结果表明[4],某种特定的乳酸菌对幽门螺杆菌具有抑制乃至杀灭作用,可以缓解甚至治愈幽门螺杆菌引起的相关疾病,因此,在医学上有很好的应用价值。乳酸菌抗幽门螺杆菌感染的效果已经在大量实验中得到证实[5]。目前临床上将其作为抗生素疗法的佐剂有一定的疗效。本文通过研究口腔乳酸菌对幽门螺杆菌的拮抗作用,旨在为应用微生态疗法治疗HP感染提供一定的理论基础。
1. 材料和方法
1.1 材料
植物乳酸菌标准菌株、副干酪乳酸菌标准菌株从酸奶中分离、口腔唾液幽门螺旋杆菌由甘肃省生物芯片工程实验室提供。选择性脑心浸液琼脂培养基, TPY琼脂培养基以及MRS琼脂培养基均购自青岛海博生物技术有限公司。
1.2 方法
采用直接点种法、反点种菌落计数法、活菌与幽门螺旋杆菌液体共培养法、细菌培养基上清液与幽门螺旋杆菌共培养、灭活细菌与幽门螺旋杆菌液体共培养法观测2种乳酸菌对幽门螺旋杆菌的拮抗作用。
1.2.1 直接点种法[6-7]
配置1×108、1×107CFU·mL-1的幽门螺旋杆菌菌悬液和1×108、1×107、1×106CFU·mL-1的乳酸菌菌悬液(植物乳酸菌和副干酪乳酸菌)。以1:10来配置含有幽门螺旋杆菌菌悬液的TPY琼脂培养基。用无菌移液器各取5μL不同浓度的乳酸菌菌悬液分别点种在含乳酸菌菌悬液的TPY琼脂培养基上,对照组为点种相同剂量的0.9%氯化钠的培养基。各处理中都设置两个平行实验,在微氧环境下培养24h后观察有无抑菌圈出现。
1.2.2 反点种菌落计数法[8]
以1:10来配置含有乳酸菌菌悬液(1×108CFU.mL-1)的TPY琼脂培养基,对照组为不含乳酸菌菌悬液的TPY琼脂培养基。用0.9%氯化钠将已配置的幽门螺旋杆菌菌悬液持续稀释至1×103CFU.mL-1。用无菌移液器每次吸取5 μL幽门螺杆菌菌悬液置于各平板上点种6个点。将培养基置于微氧环境下培养24h后观察每个点的幽门螺旋杆菌菌落变化。
1.2.3 活菌与幽门螺旋杆菌液体共培养法
分别配置1×108CFU·mL-1的幽门螺旋杆菌和两种乳酸菌菌悬液,用无菌移液器各取100μL幽门螺旋杆菌和两种乳酸菌菌悬液于2mL TPY琼脂培养基(1:10)上共培养,共设置5组用于观察。对照组为培养5组各含100μL幽门螺旋杆菌菌悬液的1mL TRY琼脂培养基。将其都放置于微氧环境下培养120h,其中每隔24h取出一组连续稀释至1×103CFU·mL-1,各取20μL稀释液点种于选择性脑心浸液培养基上,于24h之后数菌落,每组重复3次。
1.2.4 细菌培养基上清液与幽门螺旋杆菌液体共培养
配置1×108CFU.mL-1的两种乳酸菌菌悬液。混合均匀1 mL乳酸菌菌悬液与9 mL TPY琼脂培养基,培养24 h。之后各取 2mL液体培养基于2000 r.min-1离心5 min,提取1 mL上清液与已制的幽门螺杆菌菌悬液(1×108CFU.mL-1)1mL共同培养于8mL TPY琼脂培养基(1:10)中。以 0.9%氯化钠溶液1 mL与幽门螺旋杆菌菌悬液1 mL培养于8mLTPY琼脂培养基中为对照组。连续培养120h,每隔24h取出1mL菌悬液倍比稀释至1×103CFU.mL-1,各取20μL稀释液点种于选择性脑心浸液培养基上,培养24h后进行菌落计数,并将结果换算成对数值,每组重复3次。
1.2.5 灭活细菌与幽门螺旋杆菌液体共培养法
将植物乳酸菌和副干酪乳酸菌分别点种在MRS琼脂平板上,在37 ℃培养24h,在紫外灯下0.5 m处照射平板2h。照射后将菌转移至另一个MRS琼脂平板经37 ℃培养24h,观察有无菌落产生来确定细菌是否已灭活。结果显示两个平板上均未出现菌落,证明此两种乳酸菌均已灭活。制备灭活菌菌悬液(1×108CFU.mL-1)。实验设为3组,包括1mL植物乳酸菌菌悬液或者1mL副干酪乳酸菌与1mL幽门螺旋杆菌菌悬液置于8 mL液体培养基中(实验组),以及1mL 0.9%氯化钠溶液与1mL幽门螺旋杆菌菌悬液置于8mL TPY液体培养基中(对照组),将它们都连续培养120h,每隔24h取出1mL菌悬液倍比稀释至1×103CFU.mL-1后,取20μL稀释液点种于选择性脑心浸液琼脂培养基上,培养24h后进行菌落计数,并将结果换算成对数值,每组重复3次。
1.3 统计分析
采用SPSS 19.0 软件进行统计分析,反点种菌落计数法组间均数比较用单因素方差分析,其余试验结果均采用重复测定方差分析,检验水平P=0.05。
2. 结 果
2.1 直接点种法
幽门螺杆菌菌悬液1×108CFU.mL-1和乳酸菌(植物乳酸菌和副干酪乳酸菌)菌悬液(1×108、1×107、1×106CFU·mL-1)的混合液均未出现抑菌圈。幽门螺杆菌菌悬液1×107CFU.mL-1和植物乳酸菌菌悬液1×108的抑菌圈直径为0.71mm和0.72mm,和植物乳酸菌1×107的混合液的抑菌圈直径为0.73mm和0.73mm,和副干酪乳酸菌1×108CFU.mL-1的混合液的抑菌圈直径为0.70mm和0.74mm。
2.2 反点种菌落计数法
口腔乳酸菌(植物乳酸菌和副干酪乳酸菌)软琼脂上的幽门螺杆菌菌落数较对照组减少(P<0.05)。空白对照上,TPY上点种幽门螺杆菌稀释样,随着菌落浓度的稀释状况观察,浓度越来越小其菌落生长越稀疏。
2.3 活菌与幽门螺旋杆菌液体共培养法
根据各个时间点菌落数的对数值(取平均值)绘制的幽门螺杆菌生长变化曲线见图1。统计分析表明:在各个时间点上乳酸菌与对照组之间菌落计数差异均有统计学意义(p<0.05)。2个实验组幽门螺杆菌菌落数目在24、48、72和96h均低于正常对照组,说明2种乳酸菌可抑制幽门螺杆菌的生长。

图1 乳酸菌与幽门螺旋杆菌液体共培养中幽门螺旋杆菌的生长变化曲线Fig.1 Growth crve of Helicobacter pylori in mixted culrure with bacteria
2.4 细菌培养基上清液与幽门螺杆菌液体共培养
根据各个时间点菌落数的对数值表(取平均值)绘制的幽门螺杆菌生长变化曲线见图2。统计分析表明:在24、48、72h时间点上,各实验组与对照组之间菌落数计数差异均有统计学意义(p<0.05);多数时间点上,各实验组间菌落计数差异无统计学意义(p>0.05)。总体来讲,2种乳酸菌上清液对幽门螺杆菌的生长具有抑制作用,但是随着时间的推移,这种抑制作用呈现衰退趋势。与活菌与幽门螺杆菌液体共培养的结果做横向比较,二者结果基本一致,说明2种乳酸菌可分泌某种物质从而产生对幽门螺杆菌的拮抗作用。
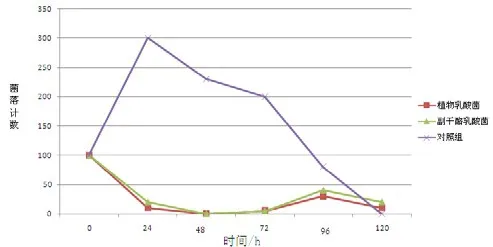
图2 细菌培养基上清液与幽门螺杆菌液体共培养中幽门螺杆菌的生长变化曲线Fig.2 Growth curve of Helicobacter pylori in mixted culture with supernate of bacteria culture media
2.5 灭活细菌与幽门螺杆菌液体共培养法
根据各个时间点菌落数的对数值表(取平均值)绘制的幽门螺杆菌生长变化曲线见图3。从图3可见,各组细菌总量呈下降趋势,但对照组与实验组之间数据波动大,曲线呈交织状,尚不能肯定2种乳酸菌在此种处理下对幽门螺杆菌仍有抑制作用。
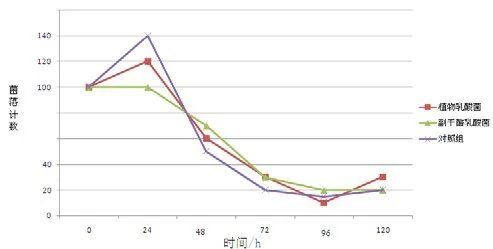
图3 灭活的细菌与幽门螺杆菌液体共培养中幽门螺杆菌的生长变化曲线Fig.3 Growth curve of Helicobacter pylori in mixed culture with killed bacteria.
3 讨 论
Hp 是慢性胃炎、消化性溃疡、胃癌、胃粘膜组织相关淋巴瘤的主要致病因素。1989 年Krajden 等首次从胃炎患者牙菌斑中分离出Hp,推测口腔可能是Hp的胃外聚集地。之后,大量研究证实口腔Hp感染在一定程度上与胃内Hp感染相关,唾液和牙菌斑可作为Hp的长期储存场所[9-10],且口腔Hp与其相对应的胃内Hp具有相同的基因型,不同定植部位的Hp可能来自同一菌株或是不相同菌株的突变体[11-12],Hp 架起了口腔疾病与消化道疾病的一座桥梁。流行病学调查资料显示,我国Hp感染率处在40%~70%水平[13],全国胃癌发病率以西北地区甘肃最高[14],目前, 不少患者已经对临床治疗幽门螺杆菌感染的药物产生抗性;多重抗菌药物会扰乱肠道内微生态平衡;尤其是抗生物疗法容易产生耐药性。在发展中国家,80%~90%HP临床分离株对甲硝唑具有耐药性,在欧洲耐药菌株也高达25.6%,导致三联药物疗效降低,甚至失效,感染复发率高[15]。
乳酸菌属于益生菌之列,具有抑制人畜肠道致病菌,加强肠道正常菌群,限制需氧菌群生长,维持肠道微生态环境的平衡以及增加机体免疫、调整代谢酶活性等功能,因此乳酸菌已被国内外广泛应用与食品工业、医疗保健、乳制品工业、饲料加工业等生产工业中。孙珊等[16]在一次体外试验中测试了7种乳酸菌抗菌素物质对不同幽门螺杆菌菌株的抑菌活性, 发现细菌素的抑菌能力是随着幽门螺杆菌菌株的不同而改变的, 来自于乳酸乳球菌的两种乳链球菌素A164和BH5在所测细菌素中显示出了最强的抑菌活性。龙敏等[17]的研究认为人嗜酸乳杆菌在体外对HP毒力株具有明显拮抗作用,他筛选出4株对HP毒力株有明显拮抗作用的嗜酸乳杆菌。植物乳酸菌和副干酪乳酸菌作为两种常见乳酸菌,在本次研究中被选取来观察其与幽门螺旋杆菌体外生长的关系。实验结果显示这两种乳酸菌均可抑制幽门螺旋杆菌的体外生长和繁殖。直接点种法实验中,浓度为1×107CFU.mL-1的幽门螺旋杆菌菌悬液与1×107和1×108CFU.mL-1的植物乳酸菌以及1×108CFU.mL-1均产生出明显的抑菌圈,因此可以推断这两种乳酸菌可能分泌某种抗菌物质来抑制幽门螺旋杆菌。在两种乳酸菌活体和上清液与幽门螺旋杆菌共培养实验中,结果都显示均对于幽门螺旋杆菌有明显抑制作用。通过各实验组的幽门螺旋杆菌菌落计数来绘制的生长曲线显示,抑制作用逐渐衰减,特别是在72h或者96h之后。由此可以推测衰减的抑制作用可能与细菌生长环境的改变以及细菌自身的生长繁殖周期有关。最后,为明确此种拮抗作用是否还有可能来源于细菌组成成分,将灭活菌体和幽门螺旋杆菌进行共同培养,但得到的数据不稳定,波动性较大,无法得出准确结论。
口腔细菌种类繁多,细菌之间相互作用的研究还有待深入,其中乳酸菌的开发与利用国内研究得已经很普遍,然而有关其作用机理方面研究的试验却报道的不多,特别有关对致病菌生长作用的影响试验更为少见。本文的研究将对重建口腔有益菌群的优势状态、口腔疾病、消化道疾病的预防和治疗具有重大帮助。