印楝素对黄粉虫幼虫呼吸作用和保护酶活性的影响
2018-06-08郭春晖宁昌龙王蕊蕊吴广赵鹏飞杨丙烨杨振德
郭春晖 宁昌龙 王蕊蕊 吴广 赵鹏飞 杨丙烨 杨振德
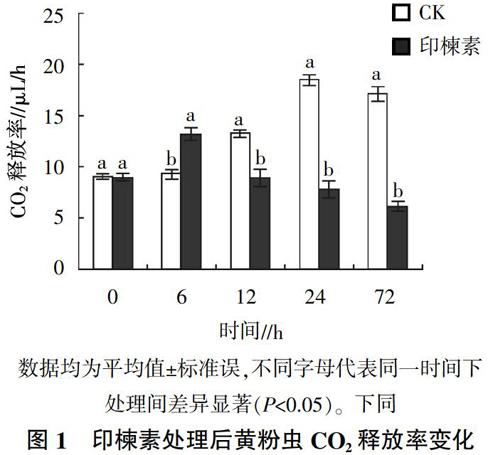
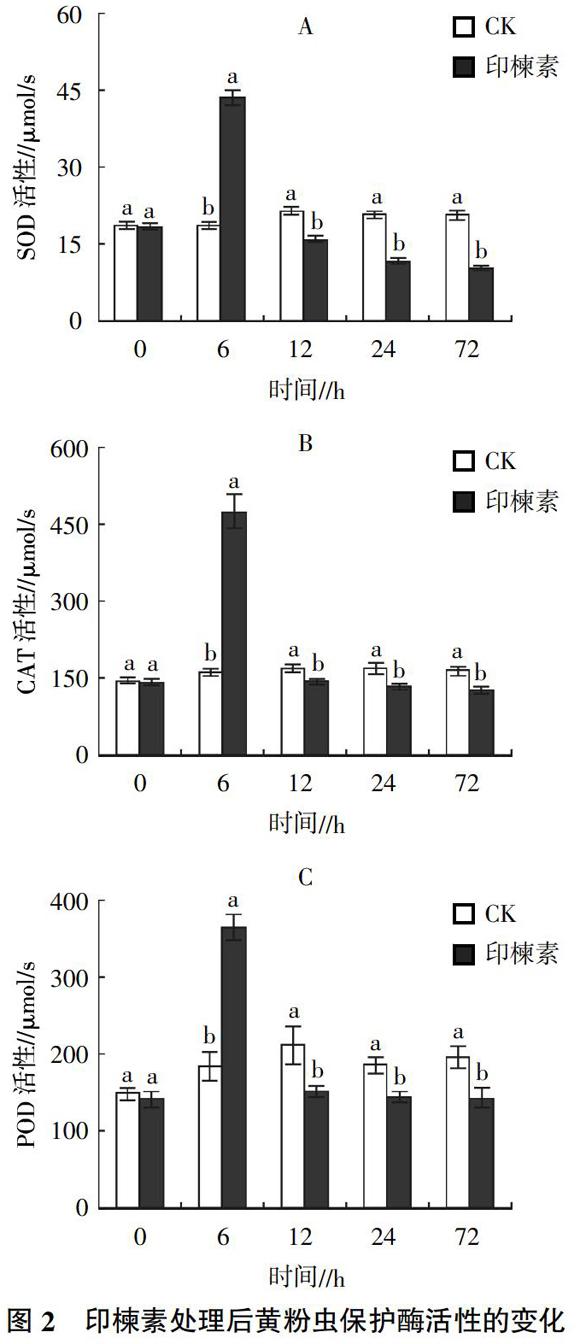
摘要:为了解植物源农药对鞘翅目昆虫呼吸代谢和保护酶活性的影响,以黄粉虫(Tenebrio molitor)8龄幼虫为研究对象,以印楝素为供试农药,采用饲喂法测定印楝素对黄粉虫末龄幼虫CO2释放率和保护酶活性的变化。结果表明,印楝素处理后,黄粉虫的CO2释放率和保护酶活性均先升高后迅速下降。摄入印楝素6 h后,黄粉虫的CO2释放率达到最大值,为13.2 μL/h,之后迅速下降并显著低于对照;保护酶SOD、CAT和POD活性在6 h时达到最大,分别是对照的2.34、2.91和1.98倍,其后呈现下降趋势。
关键词:印楝素;黄粉虫(Tenebrio molitor);呼吸;保护酶
中图分类号:S433 文献标识码:A 文章编号:0439-8114(2018)08-0055-03
DOI:10.14088/j.cnki.issn0439-8114.2018.08.014
Effects of Azadirachtin on Respiration and Protective Enzymes Activity of Tenebrio molitor Larvae
GUO Chun-hui1,NING Chang-long2,WANG Rui-rui1,WU Guang1,ZHAO Peng-fei1,YANG Bing-ye3,YANG Zhen-de1
(1.College of Forestry,Guangxi University,Nanning 530001,China;2.Guangxi Liuwan State-owned Forest Farm,Yulin 537000,Guangxi,China;
3.College of Plant Protection,Fujian Agriculture and Forest University,Fuzhou 350002,China)
Abstract: To investigate the effects of botanical pesticide on the respiration and protective enzymes of coleopteran,CO2 release rate and protective enzymes in the 8th instar larvae of Tenebrio molitor fed with azadirachtin were examined. The results showed that the CO2 release rate and protective enzymes of T. molitor fed with azadirachtin increased initially and then declined rapidly. The highest CO2 release rate of T. molitor was 13.2 μL/h after 6 hours of feeding with azadirachtin and then fell quickly,remarkably lower than the value of control groups. The maximum activities of protective enzymes including SOD,CAT and POD appeared after 6 hours of feeding with azadirachtin, which were 2.34,2.91 and 1.98 times than those in the control group,respectively. And these protect enzymes lowered fast subsequently.
Key words: azadirachtin; Tenebrio molitor; respiratory; protective enzymes
殺虫剂的应用是防治害虫的重要手段之一。但随着有机合成农药的弊端日益明显,急需新的、安全性高的药剂代替有机合成农药来保障农作物的高产稳产。印楝素(Azadirachtin)是从印楝(Azadirachta indica A. Juss.)中提取的一种三萜类化合物,对多种昆虫具有忌避、触杀、拒食和抑制生长发育等作用[1]。其杀虫范围广、对高等动物毒性低、不易产生抗药性、在环境中能迅速而彻底地降解以及对天敌安全,因此印楝素杀虫剂已成为有发展前景的植物源农药[2,3]。
黄粉虫(Tenebrio molitor Linnaeus)又称大黄粉虫、黄粉甲,俗称“面包虫”。隶属于昆虫纲(Insecta)鞘翅目(Coleoptera)拟步甲科(Tenebrionidae)粉甲属(Tenebrionini)[4]。其体内含有丰富的糖类、脂肪、蛋白质、维生素、矿物质、氨基酸和多种对人类有益的微量元素[5,6]。目前关于黄粉虫的研究大都集中在资源利用等方面,如对其所含营养物质蛋白、黄酮等的提取及利用[7,8]。然而,在自然环境中黄粉虫大多出现于各种农林产品的库房中,其幼虫食性杂,并且能够以一切有营养的物质为食,是一种大型的仓储害虫[9]。在重视黄粉虫经济价值的同时也不能忽视对黄粉虫的防治,因此,本研究以黄粉虫8龄幼虫为供试虫源,研究印楝素对黄粉虫呼吸代谢和保护酶的影响,为这类害虫的安全防治提供参考,也为印楝素的合理使用提供科学的理论依据。
1 材料与方法
1.1 材料
供试虫源:黄粉虫购自南宁市花鸟市场,在培养箱内培养至第2代8龄时使用。饲养条件:温度(25±1) ℃,相对湿度20%±5%,光周期L∶D=12 h∶12 h。饲料由麦麸和苹果按9∶1比例配成。供试药剂为0.3%印楝素乳油(云南中科生物产业有限公司)。
1.2 方法
1.2.1 试虫处理 用75%乙醇将印楝素配制成200 mg/L溶液,将配好的印楝素乙醇溶液按体积比1∶1浸泡麦麸,置于阴暗处让乙醇完全蒸发。挑选大小、体重相近的刚蜕皮的8龄幼虫,每组20只,设3次重复,饥饿处理12 h后,用上述印楝素处理的饲料喂养,以未用印楝素处理的饲料饲养的8龄幼虫为对照。
1.2.2 CO2释放率的测定 采用多通道昆虫呼吸仪组成呼吸信号采集系统(Sable System International Inc.(USA))测定对照和取食0、6、12、24、72 h后的CO2释放量。呼吸室气流速度设置为125 mL/min,测试前将供试幼虫静置30 min以适应环境,待幼虫的CO2释放量平稳后开始测定,每隔2 s记录1次数据,每头试虫连续测定10 min,数据自动记录到EXPADATA的程序软件中,每个处理测定幼虫10头,即10个重复。
1.2.3 保护酶活性的测定 将对照和取食0、6、12、24、72 h后的黄粉虫加入0.1 mol/L pH=7.0的磷酸缓冲液,冰浴研磨,匀浆在12 000 r/min离心15 min,取上层清液为粗酶提取液,并在4 ℃冰箱中保存备用。超氧化物歧化酶(SOD)参照李周直等[10]的方法测定;过氧化氢酶(CAT)活性采用紫外吸收法[11]测定;过氧化物酶(POD)活性按改进的Simon等[12]方法测定。
1.3 数据处理
采用SPSS 19.0软件进行分析数据,用最小显著差数法(LSD)分析测得数据的差异显著性。
2 结果与分析
2.1 CO2释放率的变化
印楝素处理后黄粉虫CO2释放率变化见图1。由图1可知,最初短暂升高,6 h时CO2释放率达到最大,为13.2 μL/h,之后迅速下降,并显著低于对照。
2.2 保护酶活性的变化
印楝素处理后黄粉虫体内保护酶活性变化见图2。由图2可知,6 h之内保护酶活性迅速升高,其中,超氧化物歧化酶(SOD)活性最高值为对照的2.34倍(图2A),过氧化氢酶(CAT)活性最大值为对照的2.91倍(图2B),过氧化物酶(POD)活性是对照的1.98倍(图2C);其后3种保护酶活性快速下降,12 h后均显著低于对照,72 h时最弱,分别为10.05、126.76、142.65 μmol/s。
3 小結与讨论
温度[13-15]、体重[16]、性别[17]、发育阶段[18]以及农药[19,20]等条件会对昆虫的呼吸代谢和保护酶活性产生影响。研究表明,苦豆草生物碱处理后,分月扇舟蛾(Clostera anastomosis)和柳蓝叶甲(Plagiodera versicolora)体内的保护酶活性先升高后下降[21,22];菜青虫(Pieris rapae)取食川楝素后,其呼吸强度显著减弱,多种酶活性受到抑制[23,24];朱砂叶螨(Tetranychus cinnabarinus)经阿维菌素处理4 h后,其体内保护酶活性明显上升[25];中华稻蝗(Oxya chinensis)若虫受印楝素处理后CO2释放率明显下降[26]。昆虫依靠体内的呼吸及保护酶系统来适应不同杀虫剂的毒性,通过测定昆虫的呼吸代谢和保护酶研究昆虫对农药的抗性机理,对提高杀虫剂的杀虫效率具有重要意义。
本试验研究发现,摄入印楝素后,黄粉虫的CO2释放率迅速升高,6 h达到最大,之后迅速下降,这与侯建虎等[27]研究茚虫威对小菜蛾(Plutella xylostella)呼吸代谢的结果一致。SOD、CAT和POD是昆虫体内最重要的保护酶,其中SOD能够催化超氧化物的阴离子发生歧化反应,产生O2和H2O2[28],CAT和POD能够把SOD催化生成的H2O2分解成O2和H2O[29]。这3种保护酶相互协调,能够清除昆虫体内多余的过氧化物自由基或活性氧,提高生物体对逆境的防御,一旦保护酶系受到破坏,会使生物体内氧自由基过度升高,使细胞受到伤害[10]。本试验结果表明,取食印楝素处理的饲料后,黄粉虫体内的SOD、CAT和POD活性先升高后下降,这与杨振德等[22]报道苦豆草生物碱对柳蓝叶甲(Plagiodera versicolora)保护酶活性变化的结果一致。由于摄入印楝素后,昆虫会产生拒食反应[30]。黄粉虫在取食印楝素后,为维持其体内正常生命活动,必须加强体内的物质分解来提供能量,造成黄粉虫的CO2释放率和保护酶活性短暂升高,但随着拒食时间的延长,黄粉虫无法获得足够的能量,其体内生理平衡受到严重破坏,导致CO2释放率和保护酶活性迅速下降。
随着社会的发展,人们对于农药环境安全和生态问题的关注度不断提高,以印楝素为代表的植物源农药在未来会受到更加广泛的关注。本研究结果表明,印楝素可以干扰黄粉虫的呼吸代谢,降低其体内多种保护酶活性,从而影响其正常的生理代谢而实现杀虫效果。
参考文献:
[1] 张怀江,王 秀,仇贵生,等.印楝素乳油对梨小食心虫的防控效果研究[J].应用昆虫学报,2016,53(5):1012-1017.
[2] MITCHELL P L,GUPTA R,SINGH A K,et al. Behavioural and developmental effects of neem extracts on Clavigralla scutellaris (Hemiptera:Heteroptera:Coreidae) and its egg parasitoid,Gryon Fulviventre(Hymenoptera:Scelionidae)[J].Journal Economic Entomology,2004,97:916-923.
[3] SCHMUTTERER H. Properties and potential of natural pesticides from the neem tree,Azadirachta indica[J].Annual Reviews of Entomology,1990,35:271-297.
[4] 刘玉升,王付彬,崔俊霞,等.黄粉虫资源研究利用现状与进展[J].环境昆虫学报,2010,32(1):106-114.
[5] ZHAO D J. Nutritional component and edible value of Tenebrio molitor L[J].Food and Oil Science and Technology,2000,8(2):41-42.
[6] FENG Y B. Mensuration and research of inorganic elements and vitamins of Tenebrio molitor L[J].Food Research and Development,2002,23(2):57-59.
[7] 代春华.黄粉虫幼虫蛋白酶解制备降血压肽的研究[D].江苏无锡:江南大学,2012.
[8] 汪 璇,张建新,孙长江,等.响应面法优化黄粉虫黄酮提取工艺[J].食品科学,2013,34(4):11-16.
[9] 王学贵,郑晓薇,李晓宇,等.温度对黄粉虫生物学特性的影响[J].中国农学通报,2010,26(8):230-233.
[10] 李周直,沈惠娟,蒋巧根,等.几种昆虫体内保护酶系统活力的研究[J].昆虫学报,1994,37(4):399-403.
[11] BEERS R F,SIZER I W. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase[J].Journal of Biological Chemistry,1952,195(1):133-140.
[12] SIMON DR L M,FATRAI DR Z,JONAS DR D E,et al. Study of peroxide metabolism enzymes during the development of Phaseolus vulgris[J].Biochem Physiol Pflanzen,1974,166:387-392.
[13] 王冬梅,李 娟,李 爽,等.温度对意大利蝗呼吸代谢的影响[J].昆虫学报,2014,57(3):373-378.
[14] 陈爱端,李克斌,尹 姣,等.环境因子对沟金针虫呼吸代谢的影响[J].昆虫学报,2011,54(4):397-403.
[15] 郭春晖,王蕊蕊,杨丙烨,等.温度对绿翅绢野螟4龄幼虫CO2释放率的影响[J].仲恺农业工程学院学报,2017,30(3):57-59.
[16] 戈 峰,陈常铭.褐飞虱和八斑球腹蛛的呼吸代谢及其能量消耗[J].昆虫学报,1990,33(1):35-42.
[17] 吴坤君,龚佩瑜.棉铃虫成虫期的呼吸代谢[J].昆虫学报,1984, 27(2):128-135.
[18] GREENLEE K J,HARRISON J F. Development of respiratory function in the American locust Schistocerca americana[J].The Journal of Experimental Biology,2004,207(3):509-517.
[19] 孙鲁娟,吴孔明,郭予元.棉铃虫幼虫感染白僵菌后呼吸速率和食物利用效率的变化[J].植物保护学报,2000,27(4):322-326.
[20] 侯建虎,周小毛,柏连阳,等.茚虫威对不同抗药性品系小菜蛾呼吸代谢的影响[J].应用昆虫学报,2012,49(2):471-476.
[21] 杨振德,朱 麟,赵博光,等.苦豆草生物碱对分月扇舟蛾体内消化酶和保护酶活性的影响[J].北京林业大学学报,2006, 28(1):80-83.
[22] 杨振德,朱 麟,赵博光,等.苦豆草生物碱对柳蓝叶甲体内消化酶、酯酶和保护酶活性的影响[J].西北林学院学报,2007, 22(1):81-83,86.
[23] 张 兴,赵善欢.川楝素对菜青虫呼吸作用及其它几种生理指标的影响[J].华南农业大学学报,1992,13(2):5-11.
[24] 张 兴,赵善欢.川楝素对菜青虫体内几种酶系活性的影响[J].昆虫学报,1992,35(2):171-177.
[25] 冯宏祖,刘映红,何 林,等.阿维菌素和温度胁迫对朱砂叶螨自由基及保护酶活性的影响[J].植物保护学报,2008,35(6):530-536.
[26] 崔志新,林進添,赵善欢.印楝素对中华稻蝗若虫呼吸作用的影响[J].华中农业大学学报,2001,20(6):544-546.
[27] 侯建虎,周小毛,柏连阳,等.茚虫威对不同抗药性品系小菜蛾呼吸代谢的影响[J].应用昆虫学报,2012,49(2):471-476.
[28] FELTON G W,SUMMERS C B. Antioxidant systems in insects[J].Archives of Insect Biochemistry and Physiology,1995, 29:187-197.
[29] DUBOVSKIY I M,MARTEMYANOV V V,VORONTSOVA Y L,et al. Effect of bacterial infection on antioxidant activity and lipid peroxidation in the midgut of Galleria mellonella L. larvae (Lepidoptera:Pyralidae)[J].Comparative Iochemistry and Physiology,2008,148(1):1-5.
[30] MORGAN E D. Azadirachtin, a scientific gold mine[J].Bioorganic and Medicinal Chemistry,2009,17:4096-4105.
