贝那普利和氨氯地平对自发性高血压大鼠促胰液素、生长抑素表达的影响*
2018-06-08刘志军颜春鲁刘峰林张秋菊徐厚谦胡继宏窦荣海温鑫洋
金 华,刘志军,颜春鲁,刘峰林,陈 丽,张秋菊,徐厚谦,胡继宏,窦荣海,温鑫洋
(1.甘肃中医药大学,兰州730000;2.甘肃省中医方药挖掘与创新转化重点实验室,兰州730000)
高血压病不是单一疾病,而是一组临床综合征,也可以认为它是一个由多种疾病组合的共同体,一个引起心脑血管疾病的症候群。近年来,胃肠激素与血压调控的关系受到人们关注[1,2],而且在临床上日益显示出其重要性。遗传与环境因素是否通过胃肠激素途径影响血压,即胃肠激素变化是否为高血压病的发病机制,亦或胃肠激素变化是高血压病引起的病理生理变化、是高血压病发生靶器官损害前的一个重要的中间环节尚不清楚。本实验通过对自发性高血压大鼠(spontaneously hypertensive rats,SHR)促胰液素(secretin,PZ)、生长抑素(somatostatin,SS)表达的研究,为阐明高血压病的发病机制提供资料。
1 材料与方法
1.1 动物
14周龄雄性 SHR 45只,SPF级,体重(350±20)g;同源雄性 WKY(Wistar Kyoto,WKY)大鼠 15只,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。饲养于甘肃中医药大学SPF级动物实验室,温度(22±2)℃,相对湿度(55±5)%,人工光照明暗各12 h。
1.2 实验分组及干预
45只SHR大鼠常规饲养7日后,随机分为3组(n=15):自发性高血压大鼠(SHR)组、贝那普利组(benazepril)、氨氯地平组(amlodipine);以 WKY大鼠作为正常对照组(WKY组)(n=15),共4组。以蒸馏水为溶剂,配制贝那普利和氨氯地平混悬液,贝那普利组灌服贝那普利 0.90 mg·kg-1·d-1;氨氯地平组灌服氨氯地平 0.45 mg·kg-1·d-1。SHR组及 WKY组每日灌服等体积蒸馏水。共干预8周。
1.3 药物、试剂和仪器
盐酸贝那普利(洛汀新,10 mg,北京诺华制药有限公司,批号:X1936),苯磺酸氨氯地平(络活喜,5 mg,辉瑞制药有限公司,批号:1205120)。促胰液素(PZ)/(secretin)一抗,批号为 GR 80805-1;生长抑素(SS)一抗,批号为 GR 80805-1;山羊抗兔(goat antirabbit)IgG(H+L),批号为 ab6702,上述均购自 Abcam公司。免疫组化染色试剂盒购自武汉博士德生物工程有限公司。RNA提取试剂盒(Qiagene公司,批号74104),反转录试剂盒和荧光染料(Roche公司)、PCR引物(金唯智生物科技有限公司设计合成)。全自动酶标分析仪(Bio-Rad公司,型号 i-Mark)、荧光 PCR仪(Bio-Rad公司,型号 CFX96)、凝胶扫描成像系统(Bio-Rad公司)、电子天平(上海精密科学仪器有限公司,型号FA2004N)、医用低速离心机(金坛市恒丰仪器厂,型号LX-820)等。
1.4 免疫组化法测定十二指肠PZ、胃窦SS的表达
取部分十二指肠(幽门下1.5 cm处)、胃窦部组织,作适当修整后放入4%多聚甲醛中固定。(1)石蜡切片:40℃过夜,60℃烤片 1 h。(2)常规脱蜡至水。(3)抗原修复:枸橼酸缓冲液(pH 6.0)恒温水浴至95℃~98℃,放入玻片,维持60 min;室温放置自然冷却,PBS冲洗5min×3次。(4)滴加内源性过氧化物酶封闭液,避光室温孵育10min;PBS冲洗5min×3次。(5)封闭:滴加正常山羊血清,37℃孵育15 min,甩干不洗。(6)滴加稀释抗5-HT抗体,然后4℃过夜。用PBS替代一抗作为阴性对照,约12~16 h;次日取出,室温放置 10 min,PBS洗 5 min×3次。(7)滴加二抗工作液,37℃孵育30 min;PBS洗5 min×3次。(8)滴加HRP标记的链霉亲和素,37℃孵育15min;PBS洗 5 min×3次。(9)DAB显色:DAB溶液按试剂说明书配制,镜下观察,至目的组织出现阳性颗粒而周围组织无非特异显色时,蒸馏水终止反应。(10)苏木素复染细胞核1~2min,1%盐酸乙醇分化数秒,镜下控制,自来水返蓝10 min;脱水、透明、封片。
1.5 RT-PCR法测定十二指肠PZ、胃窦 SSmRNA表达
(1)总RNA提取:取30mg组织提取总 RNA,液氮速冻后碾磨组织,加入600μl RLT裂解液裂解组织,将所得溶液于离心机4℃、12 000 r/min离心3 min。加入70%乙醇600μl后,立即转移700μl溶液(包括沉淀)至柱子上,4℃、12 000 r/min离心 15 s,完全滤过溶液;分别加入700μl Buffer RW1、500μl Buffer RPE,按上述条件离心,弃滤液;加入500μl Buffer RPE,4℃、12 000 r/min离心 2min,弃滤液。将柱子移至新的2 ml试管中,4℃、12 000 r/min离心1 min,干燥滤膜,将柱子移入的新的1.5 ml试管中加入 30~50μl无酶水,4℃、12 000 r/min离心1min得到RNA。同时取2μl RNA样品,稀释50倍后测定样品在 260 nm和 280 nm处的吸收值,OD260/280在1.8~2.0之间视为提取的总RNA质量纯度较好。(2)逆转录获得第一链cDNA:使用罗氏反转录试剂盒(No 0489686-6001),严格按照说明书反转录总mRNA,合成第一链cDNA文库,反应产物在-20℃冰箱中保存备用。反应条件:25℃、10 min,55℃、30 min,85℃、5 min,4℃保存。引物设计与合成:β-actin:F:AGGGAAATCGTGCGTGAC, R: CGCTCATTGCCGATAGTG; PZ:F: AGCCGCTTGCAGGACAGT, R:CCACGCTGTTCTCTGGAATATTT; SS: F: CCCCAGACTCCGTCAGTTTC, R: GTGGGCTCAGACAGCAGTTC。(3)cDNA的 PCR扩增:使用 Fast-Start Universal SYBR Green MASTER(ROX),实验步骤参照其说明书,反应体系总体积50μl,反应条件:95℃、5 min;95℃、10 s;55℃、20 s;75℃、30 s。使用PCR仪自带软件算出CT值,并用2-△△CT法做相对定量分析。
1.6 统计学处理
计量资料采用均数 ±标准差()表示,用SPSS 17.0统计软件对数据进行分析。组间比较采用方差分析,组间两两比较采用SNK-q检验。
2 结果
2.1 促胰液素(PZ)在十二指肠组织中的表达
免疫组化检测结果显示,PZ在各组大鼠的十二指肠均有表达。与WKY组比较,SHR组PZ的表达水平明显升高(P<0.05);与SHR组比较,贝那普利组和氨氯地平组 PZ的表达水平明显降低(P<0.05);与贝那普利组比较,氨氯地平组PZ的表达水平明显降低(P<0.05)。镜下观察显示,PZ在黏膜下腺体上皮内分泌细胞的胞浆中表达较明显,由S细胞分泌,WKY组PZ在胞浆中表达较弱,SHR组PZ在胞浆中表达增强,贝那普利组和氨氯地平组PZ在胞浆中表达减弱(表1,图1,图1见彩图页Ⅰ)。
Tab.1 The comparison of PZaverage gray value in duodenum between groups()

Tab.1 The comparison of PZaverage gray value in duodenum between groups()
WKY:Wistar-Kyoto;SHR:Spontaneously hypertensive rats;PZ:Secretin*P<0.05 vs WKY group;#P<0.05 vs SHR group;▲P<0.05 vs Benazepril group
Group n Gray value WKY group 9 89.59±5.30 SHR group 9 124.51±1.18*Benazepril group 8 117.60±1.84#Amlodipine group 8 102.63±5.14#▲
2.2 生长抑素(SS)在胃窦组织中的表达
免疫组化检测结果显示,SS在各组大鼠的胃窦中均有表达。与WKY组比较,SHR组SS的表达水平明显升高(P<0.05);与SHR组比较,贝那普利组和氨氯地平组SS的表达水平明显降低(P<0.05);与氨氯地平组比较,贝那普利组SS的表达水平明显降低(P<0.05)。镜下观察显示,SS由粘膜下腺体上皮内分泌细胞(D细胞)分泌,在D细胞胞浆内散在分布;与SHR组比较,贝那普利组和氨氯地平组SS阳性细胞数减少。(表2,图2,图2见彩图页Ⅰ)。
Tab.2 The comparison of SSaverage gray value in gastric antrum between groups()
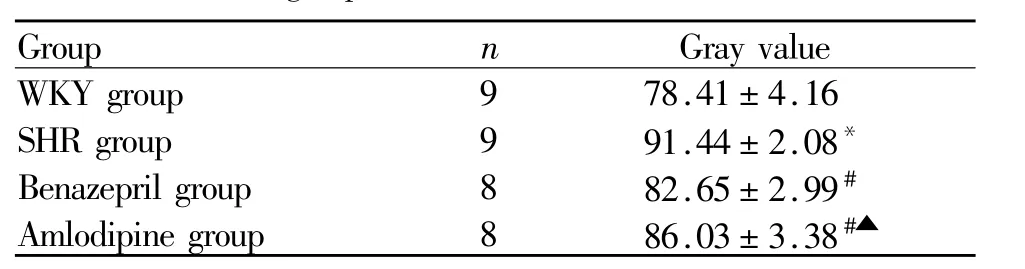
Tab.2 The comparison of SSaverage gray value in gastric antrum between groups()
SS:Somatostatin*P<0.05 vs WKY group;#P<0.05 vs SHR group;▲P<0.05 vs Benazepril group
Group n Gray value WKY group 9 78.41±4.16 SHR group 9 91.44±2.08*Benazepril group 8 82.65±2.99#Amlodipine group 8 86.03±3.38#▲
2.3 促胰液素(PZ)mRNA在十二指肠组织中的表达
各组大鼠十二指肠组织PZmRNA表达分析,与WKY组比较,SHR组PZmRNA在十二指肠的表达明显升高(P<0.05);与SHR组比较,贝那普利组和氨氯地平组PZmRNA在十二指肠中的表达降低(P<0.05);与贝那普利组比较,氨氯地平组 PZmRNA在十二指肠中的表达降低(P<0.05,表3)。
Tab.3 The expression of PZmRNA in duodenum()
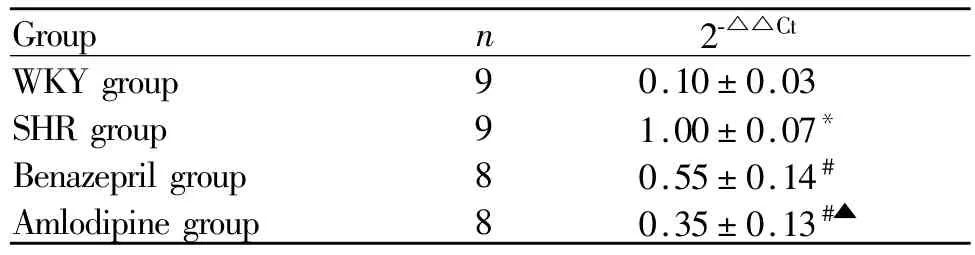
Tab.3 The expression of PZmRNA in duodenum()
PZ:Secretin*P<0.05 vs WKY group;#P<0.05 vs SHR group;▲P<0.05 vs Benazepril group
Group n 2-△△Ct WKY group 9 0.10±0.03 SHR group 9 1.00±0.07*Benazepril group 8 0.55±0.14#Amlodipine group 8 0.35±0.13#▲
2.4 生长抑素(SS)mRNA在胃窦组织中的表达
各组大鼠胃窦组织中SSmRNA表达分析,与WKY组比较,SHR组SSmRNA在胃窦中的表达明显升高(P<0.05);与SHR组比较,贝那普利组和氨氯地平组 SS mRNA在胃窦中的表达降低(P<0.05);与贝那普利组比较,氨氯地平组SSmRNA在胃窦中的表达降低(P<0.05,表 4)。
Tab.4 The expression of SSmRNA in gastric antrum()
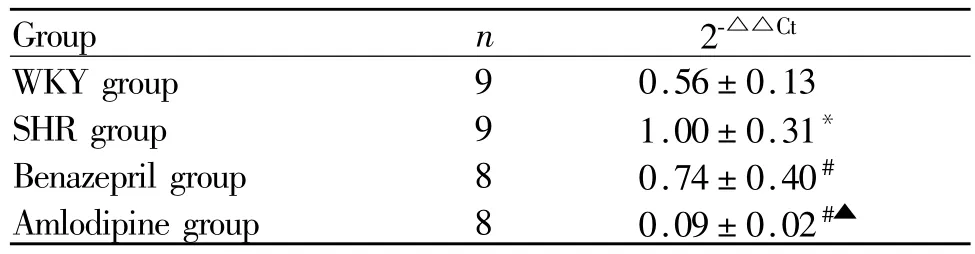
Tab.4 The expression of SSmRNA in gastric antrum()
SS:Somatostatin*P<0.05 vs WKY group;#P<0.05 vs SHR group;▲P<0.05 vs Benazepril group
Group n 2-△△Ct WKY group 9 0.56±0.13 SHR group 9 1.00±0.31*Benazepril group 8 0.74±0.40#Amlodipine group 8 0.09±0.02#▲
在高血压病的发生发展过程中,尽管遗传因素很重要,在很大程度上也与不健康的生活方式相关。仅关注高血压,忽视导致高血压病的诸多代谢性危险因素,也难以在高血压病的病因学研究和临床诊疗方面取得突破,而不健康的生活方式或代谢性危险因素均与胃肠道关系密切。最新研究资料显示,由血液携带的胃肠激素是胃肠道向脑内传递的重要化学信号,这些信号物质可以通过脑干的最后区(area postrema,AP)直接入脑[3],打破了传统的“血脑屏障”概念。胃肠激素可能通过信号传导至下丘脑弓状核,进而参与食物摄取和能量消耗的调节[4,5]。下丘脑是压力反射的重要整合中枢,其下行纤维投射到延髓头端腹外侧区和脊髓中间外侧
3 讨论
柱,影响交感传出神经活动,从而调节压力反射功能[6]。研究认为[7],某些感受器受到刺激后将激活迷走传入神经,信号通过脑干的孤束核最终传至下丘脑。而部分胃肠激素通过上述信号传导通路将信号传至下丘脑[8],这可能与机体的应激反应密切相关。研究发现,GAS、CCK和 SS均为应激敏感激素[9],而促胰液素可能也是一种应激激素[10]。
促胰液素是一种脑肠肽,在外周是由位于十二指肠和空肠上段粘膜中的S细胞分泌,由27个氨基酸残基组成的具有螺旋结构的碱性多肽,具有调节胰腺外分泌、抑制胃酸分泌和胃运动等多种生理功能。胃窦、胃泌酸粘膜层和下丘脑也存在能分泌促胰液素的细胞,并发现促胰液素广泛分布于大脑皮质和神经核团,参与胃肠运动、语言表达和行为控制等多种功能调节[11-13]。Welch MG[13]等发现促胰液素及其受体广泛分布于大脑皮质和各种神经核团,参与中枢中各种神经元活动的调节,因而认为中枢的促胰液素充当了神经调质的作用。研究显示[14,15],促胰液素还可以调节下丘脑、垂体和肾脏的渗透压。胃肠道功能紊乱必然引起胃肠激素的调节异常,这与脑肠轴功能受阻密切相关。作为一种脑肠肽,促胰液素及其受体广泛分布于中枢神经系统和胃肠道中,具有极其复杂的病理生理功能和作用途径,而在高血压病的发生中,促胰液素可能参与了其各个病理生理环节。本实验选取自发性高血压大鼠十二指肠促胰液素的表达作为切入点,探索高血压病与胃肠激素的关系,进一步通过免疫组化及RT-PCR对各组大鼠促胰液素蛋白与mRNA的表达进行检测。结果显示,SHR组十二指肠促胰液素mRNA表达水平较WKY组明显增高。给予贝那普利和氨氯地平干预8周后,SHR组十二指肠促胰液素mRNA的表达水平明显降低,而氨氯地平组降低更明显。这一结果提示,贝那普利和氨氯地平均能使自发性高血压大鼠十二指肠促胰液素mRNA的表达水平降低。从免疫组化角度看,贝那普利和氨氯地平均能抑制S细胞的分泌功能,使黏膜下腺体上皮内分泌细胞胞浆中促胰液素表达减弱,进而降低十二指肠组织促胰液素的表达。由此推测,贝那普利和氨氯地平的降压作用很有可能是通过调节胃肠激素——促胰液素mRNA的表达,最终降低血压。
生长抑素(SS)是一种由14肽组成的环状脑肠肽,广泛分布于中枢神经系统和外周组织中。研究证明[16],SS具有调节神经递质和多种激素的双重作用。黄卫[17]等证实,SS存在于下丘脑视前区第三脑室腹侧壁上。Liddle[18]研究发现,SS除参与认知、痛觉、行为、胃肠运动等外,还参与血压的调节。本实验采用RT-PCR技术检测各组大鼠生长抑素mRNA的表达,结果显示,SHR组胃窦生长抑素mRNA表达水平较WKY组明显增高;灌服贝那普利或氨氯地平干预8周后,SHR组胃窦生长抑素mRNA表达明显降低,而氨氯地平组降低更明显。这一结果提示,贝那普利和氨氯地平均能使自发性高血压大鼠胃窦生长抑素mRNA的表达降低。从免疫组化角度看,SS由粘膜下腺体上皮内分泌细胞(D细胞)分泌,在D细胞胞浆内散在分布;贝那普利组和氨氯地平组SS阳性的细胞数较SHR组减少。由此推测,贝那普利和氨氯地平的降压作用很有可能是通过调节生长抑素mRNA的表达,最终降低血压。本次实验中氨氯地平组胃窦生长抑素的表达明显低于模型组,这一结果尚需深入研究。
高血压病的发病机制很复杂。有研究认为,肾素-血管紧张素系统(RAS)是高血压病体液调节机制中的重要组成部分,RAS的成员ACE基因多态性与高血压病关系密切[19]。本实验通过促胰液素和生长抑素这两项指标研究,初步揭示高血压病与胃肠激素具有相关性,尚不能完全解释胃肠激素变化是否为高血压病发病机制亦或是高血压病引起的病理生理变化,尚需逐步深入探讨胃肠激素通过哪种方式和(或)环节(一定是血液吗?)参与或影响高血压病的发病或靶器官损伤,包括RAS的变化是否与胃肠激素的释放有关,从而为阐明高血压病的发病机制增添新的内容。
[1] 金 华,金 钊,张蕾蕾.基于胃肠激素观点的高血压发病机制思考[J].医学与哲学,2011,32(12):33-34.
[2] 祝之明,熊诗强.胃肠道——代谢性高血压发病的始动器官?见:胡大一,马长生.心脏病学实践2015[M].北京:人民卫生出版社,2015:93-98.
[3] Wang J,Zhou L,Tian R.Role of the area postrema of medulla oblongata in the regulation of canine interdigestive migratingmotor complex[J].Chin Med J,2002,115(3):384-388.
[4] Simpson KA,Martin NM,Bloom SR.Hypothalamic regulation of food intake and clinical therapeutic applications[J].Arq Bras EndocrinolMetabol,2009,53(2):120-128.
[5] Sainsbury A,Zhang L.Role of the arcuate nucleus of the hypothalamus in regulation of body weight during energy deficit[J].Mol Cell Endocrinol,2010,316(2):109-119.
[6] 党 娜,潘燕霞.中枢氧化应激抑制高血压大鼠压力感受性反射功能[J].中国应用生理学杂志,2012,28(5):445-448.
[7] SchwartzMW,Woods SC,Porte D Jr,etal.Centralnervous system control of food intake[J].Nature,2000,404(6778):661-671.
[8] Jobst EE,Enriori PJ,Cowley MA.The electrophysiology of feeding circuits[J].Trends Endocrinol Metab,2004,15(10):488-499.
[9] Jonsson BH,Uvnas-Moberg K,Theorell T,et al.Gastrin,cholecystokinin,and somatostatin in a laboratory experiment of patients with functional dyspepsia[J].Psychosom Med,1998,60(3):331-337.
[10]Oektedalen O,Opstad PK,Schaffalitzky de Muckadell OB.Secretin—a new stress hormone[J]?Regul Pept,1982,4(4):213-219.
[11]CheyWY,Chang TM.Secretin,100 years later[J].JGastroenterol,2003,38(11):1025-1035.
[12] Chey WY,Chang CH,Pan HJ,et al.Evidence on the presence of secretin cells in the gastric antraland oxynticmucosa[J].Regul Pept,2003,111(1-3):183-190.
[13]Welch MG,Keune JD,Welch Horan TB,et al.Secretin:hypothalamic distribution and hypothesized neuroregulatory role in autism[J].Cell Mol Neurobiol,2004,24(2):219-241.
[14]Chu JY,Chung SC,Lam AK,et al.Phenotypes developed in secretin receptor-nullmice indicated a role for secretin in regulating renalwater reabsorption[J].Mol Cell Biol,2007,27(7):2499-2511.
[15] Chu JY,Lee LT,Lai CH,et al.Secretin as a neurohypophysial factor regulating body water homeostasis[J].Proc Natl Acad SciUSA,2009,106(37):15961-15966.
[16] Sandkuhler J,Helmachen CO.Spinal somatostatin superfusion in vivo affects activity of catnociceptive dorsal horn neurons:comparison with spinal morphine[J].Neuroscience,1990,34:565.
[17]黄 卫,李海标,卢光启.生长抑素在大鼠脑室管膜中定位分布的免疫组织化学和原位杂交的研究[J].解剖学报,1996,27(4):383-385.
[18]Liddle RA.Cholecystokinin:its role in health and disease[J].Curr Opin Endocrinol Diabetes obes 2003,10(1):50-54.
[19]李鹏飞,张 伟,马 畅,等.自发性高血压大鼠心脏中 ACE,AT1R,ACE2和 MasR表达变化的研究[J].中国应用生理学杂志,2011,27(2):153-154.
