右美托咪定对A549细胞缺氧/复氧损伤时细胞凋亡及CHOP的影响*
2018-06-08罗梓垠项冰倩邱晓晓戴雍月王万铁
罗梓垠,高 慧,项冰倩,邱晓晓,戴雍月△,王万铁△
(1.温州医科大学缺血-再灌注损伤研究所,浙江 温州325035;2.湖北省中西医结合医院病理科,武汉430015)
肺缺血/再灌注损伤(lung ischemia/reperfusion injury,LIRI)是个复杂的病理生理过程,主要表现为再灌注后肺血管阻力增加、肺水肿、肺泡损伤及微血管通透性增加,严重影响患者预后[1-2]。CCAAT/增强子结合蛋白同源蛋白(CHOP)是C/EBP转录因子的家族成员之一,是内质网应激(endoplasmic reticulum stress,ERS)的一个特异转录因子。CHOP主要分布于细胞质中,正常情况下含量很低。但当ERS发生时,CHOP会大量表达,过量表达的CHOP会诱导细胞凋亡[3]。本实验室前期研究发现,LIRI能激活ERS,活化CHOP凋亡通路,导致小鼠肺组织细胞凋亡。通过RNA干扰使CHOP进行基因沉默,LIRI程度减轻,提示抑制ERS相关通路是治疗LIRI的有效作用靶点之一[4]。右美托咪定(dexmedetomidine,Dex)是一种新型的麻醉类辅助用药,能与α2肾上腺素受体结合发挥镇静、镇痛作用,有研究表明Dex能减轻多种器官的缺血/再灌注损伤[5]。本研究体外模拟LIRI方法建立A549(起源于肺泡II型上皮细胞系)细胞的缺氧/复氧(hypoxia/reoxygenation,H/R)损伤模型,旨在观察Dex对A549细胞H/R损伤时细胞凋亡和CHOP表达的影响及可能机制,以期为Dex临床治疗LIRI提供充分的实验依据。
1 材料与方法
1.1 主要试剂与仪器
F12K培养基和胎牛血清(Gibco),右美托咪定(江苏恒瑞医药股份有限公司),CCK-8试剂盒(日本同仁),TUNEL检测试剂盒(Roche),DAB显色试剂盒(北京中杉金桥生物科技有限公司),Trizol(Invitrogen),逆转录试剂盒、PCR试剂盒(Fermentas Life Science),BCA蛋白浓度测定试剂盒(碧云天生物技术研究所),一抗:兔抗GAPDH多克隆IgG抗体(杭州贤至生物科技有限公司),CHOP、caspase-3、Grp78(Cell Signaling Technology),二抗:HRP偶联山羊抗兔IgG二抗(Cell Signaling Technology)。其余试剂均为市售分析纯。
常氧培养箱和低氧培养箱(Thermo),倒置相差显微镜(Olympus),超净工作台(苏净安泰),低温高速离心机(Eppendorf),酶标仪(Biotek),摇床(Thermo),荧光化学发光成像系统(上海勤翔科学仪器有限公司),超低温冰箱(Thermo),梯度 PCR仪(Bio-Rad)。
1.2 A549细胞的培养
在人肺泡Ⅱ型上皮细胞系A549细胞(购于中国科学院细胞库)中加入新配制的含10%胎牛血清的F12K培养液(含糖)。F12K培养液中含100 U/ml青霉素和 100μg/ml链霉素。A549细胞常规置于37℃、5%CO2常氧培养箱中培养。待细胞贴壁达80%以上进行传代,每2 d按1∶3传代,待传代3~4次后用于实验。
1.3 细胞模型的建立
采用随机数字表法,将A549细胞分成4组(n=10):常氧培养组(N组),Dex常氧组(D组),缺氧/复氧组(H组),缺氧/复氧+Dex组(HD组)。依据参考文献建立A549细胞H/R损伤模型[6]:将生长至对数生长期的A549细胞的完全培养基更换成无血清的F12K培养基,在常氧培养箱中预处理1 h。然后,将细胞培养液换为无糖的OGD液[7],并置于低氧培养箱内孵育6 h。之后将OGD液再次更换为无血清的F12K培养基,于常氧培养箱内复氧处理24 h。D组和HD组在造模开始时加入Dex至终浓度 1 nmol/L[8]。
1.4 细胞形态学观察
造模结束后,将A549细胞置于倒置显微镜下观察其生长状况及形态学变化。
1.5 CCK-8法检测细胞活力
用胰酶消化,将A549细胞吹打成细胞悬液,按104cells/well将其接种于96孔板中。每组设6个复孔,且加设空白对照组。接种细胞后,周围一圈加PBS,防止培养液蒸发。置细胞培养箱中培养,待贴壁生长良好后开始造模。从培养箱中取出96孔板,弃去旧培养基,按每孔110μl将CCK-8混合液加入96孔板,避光、37℃孵育30 min,用酶标仪在450 nm波长处测定吸光度值。
1.6 TUNEL法检测细胞凋亡
取处于对数生长期的A549细胞,消化后置6孔板内进行细胞爬片,细胞生长良好后进行造模。造模结束后,按TUNEL检测试剂盒说明书进行操作,在光学显微镜下(×100)观察细胞形态,胞核呈棕褐色者为凋亡细胞,每张片至少观察500个细胞,计数每100个细胞中的凋亡细胞数,再取其平均值,得出凋亡指数(apoptotic index,AI)。
1.7 Western blot法检测 A549细胞 CHOP、Grp78、caspase-3蛋白的表达水平
用细胞刮刀收集A549细胞,加入预冷的裂解液100μl(PMSF:RAPI=1∶100),反复吹打。置于冰上40 min,使其充分裂解。低温离心,取上清液,用BCA法测定蛋白质浓度,绘制标准曲线,样品蛋白配制成2μg/ml,继之将其煮沸变性。配制琼脂糖凝胶进行电泳,转膜至PVDF膜。再将用TBS浸湿的膜放至5%脱脂奶粉中,室温下封闭2 h。TBST漂洗,加入一抗(抗 CHOP/Grp78/caspase-3/GAPDH抗体,CHOP/caspase-3 1∶500稀释,Grp78/GAPDH 1∶1 000稀释),4℃孵育过夜。TBST洗涤7 min×3次,再加入HRP标记的二抗(测定CHOP/Grp78/caspase-3/GAPDH时二抗均以1∶8 000稀释),室温孵育 1 h。TBST洗涤 7 min/次、×3次,滴加发光液,反应 2 min,用荧光化学发光成像系统进行曝光,再用凝胶分析软件分析内参蛋白与目的蛋白吸光度值。
1.8 RT-PCR检测 A549细胞 CHOP、Grp78 mRNA的表达水平
在每组细胞皿里加Trizol充分匀浆,使细胞完全裂解。提取总RNA并测定RNA浓度,按照逆转录试剂盒说明书逆转录合成cDNA。引物由上海捷瑞生物工程有 限公司合成,CHOP:Left:5’-CCACTCTTGACCCTGCTTCTC-3’,Right:5’-CTAGCTGTGCCACTTTCCTTT-3’,扩 增 片 段 长 度 246 bp。Grp78: Left:5’-GTCCTATGTCGCCTTCACTCC-3’,Right:5’-AAATGTCTTTGTTTGCCCACC-3’,扩增片段长 度 232 bp。GAPDH: Left:5’-ATCCCATCACCATCTTCCAG-3’, Right: 5’-TTGAGGCTGTTGTCATACTTCT-3’,扩增片段长度220 bp。采用荧光实时PCR仪进行扩增。PCR参数:94℃,3 min;94℃,30 s;CHOP,52℃/Grp78 59℃/GAPDH 54℃,30 s;72℃,1min;共 33个循环,72℃,5min终止延伸。配制1.5%琼脂糖凝胶,每孔加入5μl PCR产物,电泳条件为100 V,40min,紫外线照射扫描结果并保存。Quantity One软件分析电泳条带灰度值,以目的基因扩增产物密度与GAPDH基因扩增产物密度之比表示目的基因表达水平。
1.9 统计学处理
所有计量数据以均数±标准差()表示,采用SPSS 17.0统计软件进行分析,并进行正态性检验。多组样本均数间的比较进行方差齐性检验,组间两两比较应用单因素方差分析(one-way ANOVA)。方差齐性者两两比较采用LSD-t法,方差不齐者两两比较进行Dunnet’t3检验。
2 结果
2.1 Dex对A549细胞形态学的影响
倒置显微镜下观察发现,N组和D组未见悬浮细胞,A549细胞生长良好,胞体透亮,胞核完整。H/R损伤后,H组A549细胞呈不规则多边形生长,细胞发生融合现象,核固缩,胞体变暗;细胞间隙增大,贴壁细胞数减少。与H组比较,HD组A549细胞数增多,细胞形态变化不明显(图1)。
2.2 Dex对A549细胞活力的影响
常氧培养条件下,N组和D组细胞活力的吸光度值分别为 1.358±0.104,1.371±0.046,二者无统计学差异(P>0.05)。经 H/R损伤后,H组吸光度值为0.752±0.096,与N组比较,吸光度值明显下降(P<0.01)。经 Dex处理后,与 H组相比,HD组吸光度值上调,为 1.057±0.045,差异有统计学意义(P<0.01),表明 Dex能增加 A549细胞 H/R损伤后的细胞活力(图2)。
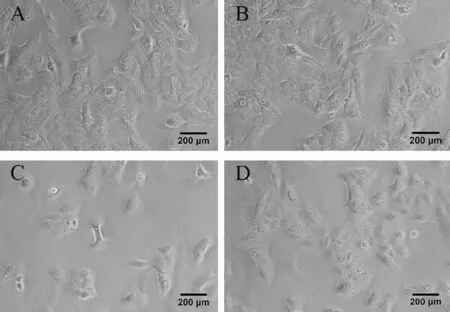
Fig.1 The historical changes of A549 cells in each group under the invertedmicroscope(×100)

Fig.2 The changes of expression of absorbance value and AIvalue in all groups
2.3 Dex对A549细胞凋亡率的影响
在常氧培养条件下,N组和D组AI值分别为3.500±1.080和 4.300±1.494,两者比较无统计学差异(P>0.05)。经 H/R损伤后,H组 AI值为35.400±3.534,与 N组比较,H组 AI值升高显著(P<0.01)。经 Dex处理后,HD组 AI值下降为 17.900±3.071,与 H组比较,差异有统计学意义(P<0.01),这表明Dex能降低H/R损伤A549细胞的AI值,减少细胞凋亡(图 2,3)。
2.4 Dex对 CHOP、Grp78和 caspase-3蛋白表达的影响
Western blot结果显示,与 N组相比,D组CHOP、Grp78和caspase-3蛋白表达水平无明显统计学差异(P>0.05)。经 H/R损伤后,与 N组相比,H组中CHOP、Grp78和caspase-3蛋白表达水平均明显升高(P<0.01)。经 Dex处理后,HD组 CHOP、caspase-3蛋白水平显著下降,与H组比较差异有统计学意义(P<0.01,图 4)。
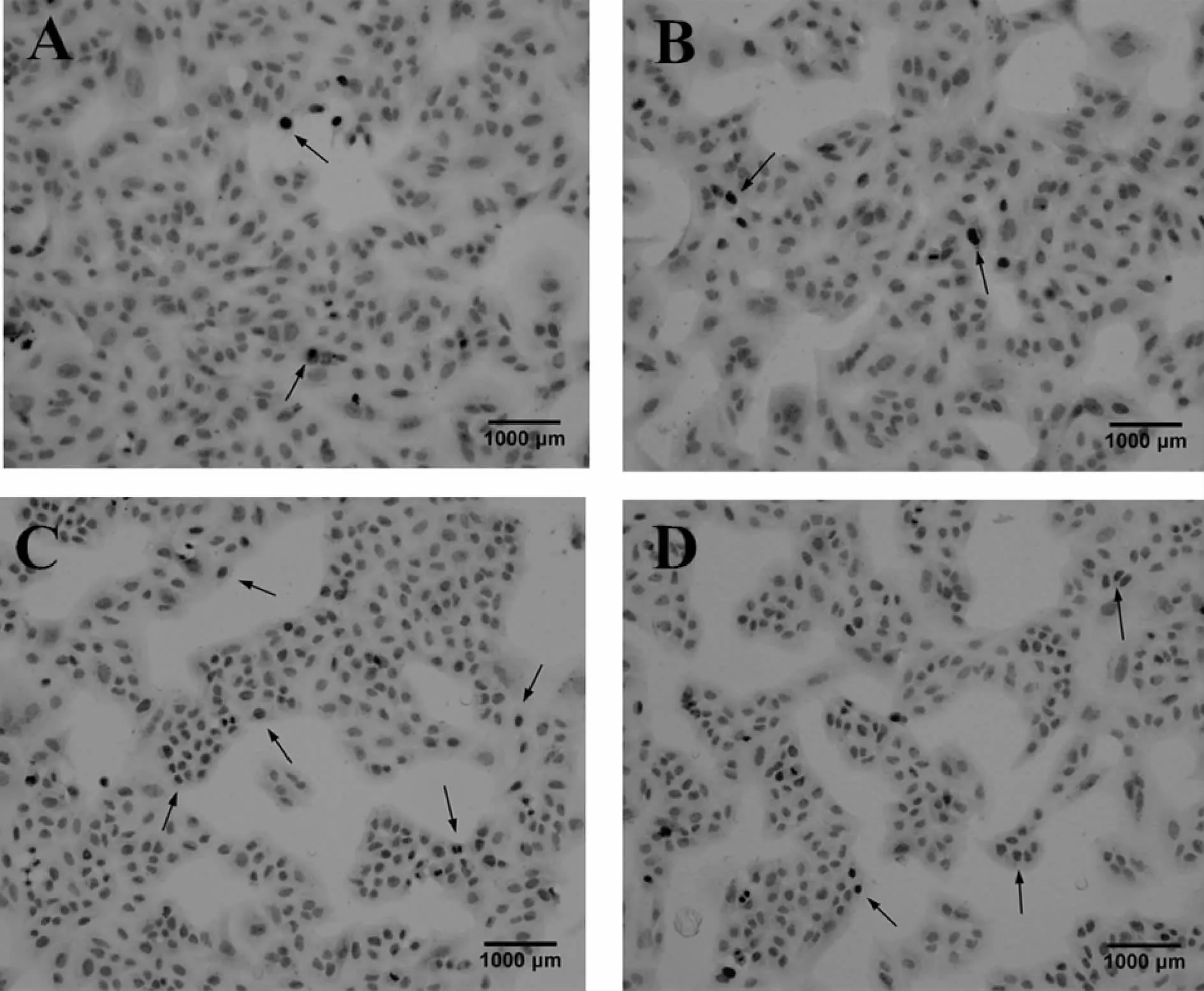
Fig.3 The apoptosis index detected by TUNEL in each group(×100)
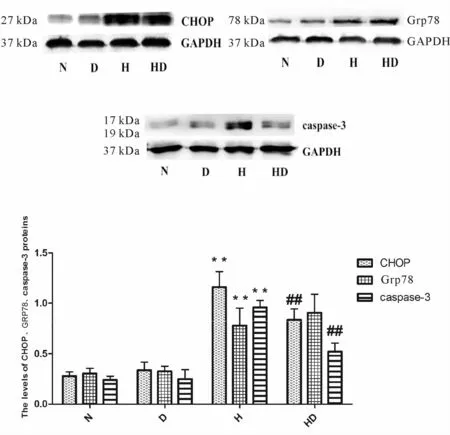
Fig.4 The expression levels of CHOP、Grp78、caspase-3 proteins in various groups
2.5 Dex对CHOP和Grp78mRNA表达的影响
RT-PCR结果显示,与 N组相比,D组 Grp78、CHOPmRNA表达水平无明显统计学差异(P>0.05)。经 H/R损伤后,H组中 Grp78、CHOPmRNA表达水平均明显升高(P<0.01)。经Dex处理后,与H组相比,HD组 Grp78 mRNA表达上升(P<0.01),CHOPmRNA表达显著下降,差异有统计学意义(P<0.01,图 5)。

Fig.5 The expression levels of Grp78、CHOPmRNA in various groups
3 讨论
肺泡II型上皮细胞是肺泡的重要组成部分,尽管仅占肺泡表面积的5%,但对维持肺泡结构和功能具有重要作用。肺泡II型上皮细胞的凋亡和坏死数量直接决定LIRI的严重程度及预后。由于肺泡II型上皮细胞体外培养较为困难,其性状不稳容易向肺泡I型上皮细胞转化,故很多体外实验研究采用A549细胞来替代肺泡 II型上皮细胞[9]。H/R损伤模型的建立是先对A549细胞进行一定时间的氧糖剥夺,低氧造模时,A549细胞培养液被更换成OGD液,并置于低氧培养箱中进行低氧处理以模拟在体肺组织缺血损伤;随后将OGD液更换成细胞培养液,将培养皿放回常氧培养箱中模拟在体的再灌注损伤,这是国内外研究常用的离体组织器官缺血/再灌注损伤的造模方法之一[8,10]。本研究观察到,造模后H组细胞数量减少、细胞形态发生改变。采用CCK-8法检测细胞活力,与N组相比,H组细胞吸光度值显著下降,细胞活力降低。TUNEL结果显示,与N组比较,H组凋亡细胞数明显增多,AI值升高,提示H/R损伤造模成功。
引起细胞凋亡的因素有很多,如氧化应激、炎症反应、细胞内钙稳态失衡等。有研究发现,细胞凋亡与LIRI有密切联系,且细胞凋亡在LIRI中起到重要作用[11]。ERS是细胞凋亡的途径之一。葡萄糖调节蛋白 78(glucose-regulated protein 78,Grp78)是内质网上3种伴侣蛋白之一,在非应激状态下处于无活性状态。当ERS发生时,Grp78会与3种内质网跨膜蛋白 PERK(protein kinase R like ER kinase)、IRE1(inositol-requiring protein-1)和 ATF6(activating transcription factor 6)解离,使其活化,介导发生未折叠蛋白反应(unfolded protein response,UPR),与未折叠或错误折叠蛋白结合,维持内环境的稳态[12]。PERK、ATF6及IRE1都能诱导CHOP转录,使细胞内CHOP大量表达,促使细胞凋亡[13]。caspase-3是 Caspase家族中重要的凋亡执行者,是多个凋亡信号通路的一个共同的下游效应酶,其活化是凋亡进入不可逆阶段的标志[14]。本研究表明,N组 CHOP、Grp78、caspase-3蛋白和 CHOP、Grp78mRNA表达均处于较低水平。经 H/R干预后,H组 AI值上调,CHOP、Grp78、caspase-3蛋白和 CHOP、Grp78mRNA的表达水平急速增加,提示H/R损伤会诱发 ERS,导致细胞凋亡。
右美托咪定(Dex)通过多种途径对重要器官发挥一定的保护作用,主要途径有抑制炎症反应、抑制血管收缩、减轻氧化应激水平、增强机体免疫力等[15],具有广阔的应用前景。袁培根等[16]研究证实,Dex能通过α2受体上调Nrf2核内表达,启动有利基因以对抗氧化作用,从而达到缓解肢体I/R损伤的作用。葛东建等[17]研究发现,Dex预处理能激活p-Akt信号通路减轻急性肺损伤,发挥对肺的保护作用。本研究显示,经Dex干预后,HD组A549细胞Grp78蛋白与mRNA表达增加,其机制可能与Grp78活性增加以促进蛋白折叠,试图恢复内质网功能,抑制内质网应激,发挥保护细胞作用。这亦与调控内质网相关凋亡通路等有密切关系。CHOP信号通路是内质网应激重要途径之一,与H组比较,HD组CHOP、caspase-3蛋白,CHOPmRNA表达水平明显下降,细胞活力增加,细胞损伤程度减轻、凋亡细胞数明显减少。提示Dex能抑制ERS,对抗细胞凋亡,减轻H/R损伤。
综上所述,Dex对H/R损伤A549细胞具有一定的保护作用,其机制可能与减少过度ERS时CHOP表达所引起的细胞凋亡有关。本研究在离体实验中证实Dex对LIRI的保护作用,进一步阐明肺组织细胞凋亡的分子机制,为Dex治疗LIRI提供理论依据。
[1] Razi SS,LatifMJ,Li X,et al.Dietary flaxseed protects against lung ischemia reperfusion injury via inhibition of apoptosis and inflammation in amurine model[J].J Surg Res,2011,171(1):e113-121.
[2] 罗梓垠,郭长满,项冰倩,等.右美托咪定对肺缺血/再灌注损伤小鼠内质网应激相关分子caspase-12表达的影响[J].中国应用生理学杂志,2016,32(2):164-168.
[3] 陈 丹,宋 冬,叶玉柱,等.右美托咪定通过影响CHOP凋亡通路减轻缺血/再灌注肺损伤[J].中国病理生理杂志,2015,31(6):1093-1098.
[4] 周俊辉,王良荣,郝卯林,等.靶向小干扰RNA对小鼠肺缺血/再灌注损伤时细胞凋亡及CCAAT/增强子结合蛋白同源蛋白的作用[J].中华实验外科杂志,2013,30(8):1608-1611.
[5] Kucuk A,Yaylak F,Cavunt-Bayraktar A,etal.The protective effects of dexmedetomidine on hepatic ischemia reperfusion injury[J].Bratisl Lek Listy,2014,115(11):680-684.
[6] Wang W,Jia L,Wang TK,et al.Endogenous calcitonin gene-related peptide protects human alveolar epithelial cells through protein kinase c and heat shock protein[J].J Biol Chem,2005,280(21):20325-20330.
[7] Gu JT,Sun P,Zhao HL,et al.Dexmedetomidine provides renoprotection against ischemia-reperfusion injury inmice[J].Crit Care,2011,15(3):R153.
[8] Cui J,Zhao HL,Wang CY,etal.Dexmedetomidine attenuates oxidative stress induced lung alveolarepithelial cellapoptosis in vitro[J].Oxid Med Cell Longev,2015,358396.
[9] Foster KA,Oster CG,MayerMM,etal.Characterization of the A549 cell line as a type IIpulmonary epithelial cellmodel for drugmetabolism[J].Exp Cell Res,1998,243(2):359-366.
[10]周子懿,唐宇平,高俊鹏,等.罗布麻提取物对神经元缺氧复氧损伤的保护作用[J].上海中医药杂志,2010,44(8):63-67.
[11]Luo ZY,Zhou JH,Xiang BQ,et al.Effects of curcumin on cell apoptosis in pulmonary ischemia/reperfusion injury in mice[J].Int JClin Exp Pathol,2016,9(7):6633-6644.
[12]Zhang XY,Zhang TT,Song DD,etal.Endoplasmic reticulum chaperone GRP78 is involved in autophagy activation induced by ischemic preconditioning in neural cells[J].Mol Brain,2015,8(1):20.
[13]夏元平,王立花,樊燕蓉.细胞凋亡与内质网应激机制[J].药学与临床研究,2010,18(3):291-293.
[14]岳原亦,张 扬,张一奇.Caspase家族与细胞凋亡[J].中国医疗前沿,2011,6(6):25-26.
[15]刘先保,张春芳,詹 鸿.右美托咪定器官保护作用研究进展[J].中国现代应用药学,2013,30(10):1148-1151.
[16]袁培根,薛彬彬,林 碧,等.Nrf2/ARE通路介导右美托咪定减轻肢体缺血/再灌注损伤中的作用[J].中国应用生理学杂志,2016,32(3):250-254.
[17]葛东建,祁 宾,李金玉,等.右美托咪定预处理对急性肺损伤大鼠的保护作用[J].重庆医学,2013,42(28):3405-3407.
