炉渣与生物炭施加对稻田土壤产甲烷菌群落结构的影响
2018-06-07王妙莹许旭萍王维奇王广磊苏程举
王妙莹,许旭萍,王维奇,王广磊,苏程举
1 福建师范大学生命科学学院, 福州 350108 2 福建师范大学地理研究所, 福州 350007 3 湿润亚热带生态地理过程教育部重点实验室, 福州 350007
甲烷(CH4)是仅次于二氧化碳(CO2)的重要温室气体,对温室效应的贡献约为18%[1],其单分子增温潜势是CO2的28—36倍[2]。农业活动是大气中温室气体的主要来源,其中稻田是CH4最重要的农业源。研究表明,稻田每年的CH4排放量约占全球CH4排放总量的10%[3]。水稻田在发展粮食生产的同时也加剧了温室气体CH4的排放量,这将会加速全球气候变暖。因此,如何协调粮食增产与温室气体减排,具有重要的理论和现实意义[4]。稻田CH4减排是当今的研究热点,近年来,稻田施加工农业废弃物的研究已日益增多,其中研究较多的废弃物种类主要有秸秆、生物炭和炉渣[5- 8]。由于生物炭来源于农业生产、生活木质物质废弃物,含有丰富的钾、钙、镁元素,可改良土壤[9- 10],国内外研究学者开展生物炭施加改善土壤理化性质、增加粮食产量、温室气体减排的相关研究已取得一定成效[11- 14]。当前,国际上一些学者发现,在温带稻田施加炉渣可提高水稻产量并减少CH4排放[6],Ali等[4]认为炉渣的增产减排作用与炉渣中含有氧化铁和硅、钙、镁等营养元素密切相关[15]。然而,废弃物施加减少稻田CH4排放的微生物学机制的研究还较薄弱。
产甲烷菌是一类严格厌氧的微生物,影响着稻田CH4的产生。近年来,靶标特定微生物16S rRNA基因和功能基因已广泛应用于稻田土壤产甲烷菌多样性的检测[16- 18],采用此分子生物学技术,人们发现稻田土壤产甲烷菌的主要类群包括有甲烷八叠球菌目(Methanosarcinales)、甲烷微菌目(Methanomicrobiales)和甲烷杆菌目(Methanobacteriales)等几个目[19- 21]。其中,甲烷杆菌目(Methanobacteriales)的甲烷杆菌属(Methanobacterium)以及甲烷八叠球菌目(Methanosarcinales)的甲烷八叠球菌属(Methanosarcina)和甲烷鬃菌属(Methanosaeta)的相对丰度与CH4产生关系密切[14,22- 23]。研究表明,土壤环境、水肥管理以及水稻生育时期均会使稻田产甲烷菌群落结构发生变化进而影响稻田CH4的排放[22,24- 26];Dubey等[25]研究发现变性土产甲烷菌的主要类群为甲烷八叠球菌科(Methanosarcinaceae),与土壤富含乙酸、有机碳含量较高有关;Bao等[22]研究指出,由于较高的钾含量、接近中性的pH值以及较少粘土性质,使得粉砂壤土样地的CH4产生高于粉砂粘土样地;底物类型是影响产甲烷菌群落结构的关键因素。然而,关于废弃物施加对稻田土壤产甲烷菌群落组成及其结构影响的研究鲜有报道。董达等[27]研究发现生物炭输入可通过提高土壤pH、通气性和土壤养分含量,降低土壤容重和溶解性有机碳(DOC),抑制乙酸型产甲烷菌Methanosarcina和Methanosaeta的生长,实现稻田CH4的减排。与此同时,也有研究表明,生物炭施加的减排效应与生物炭抑制产甲烷菌活性或提高甲烷氧化活性有关[28- 30],还有一些学者认为生物炭是通过提高甲烷氧化菌丰度或降低mcrA/pmoA比值来减少稻田CH4排放[30- 31]。由此可见,多数学者认为施加生物炭有减少CH4排放作用,但其微生物学机制还有待进一步研究。另一方面,多位研究者认为炉渣减少CH4排放的主要原因是炉渣中富含的氧化铁作为电子受体抑制产甲烷菌的活性[6,32- 33],然而炉渣施加是否还可能通过影响稻田土壤产甲烷菌多样性及其群落结构来减少稻田CH4产生量,尚不清楚。
本课题组研究发现水稻拔节期的CH4排放通量高于乳熟期[34]。基于此,本研究以福州平原红壤稻田为研究对象,对稻田进行炉渣、生物炭单一施加和混合施加处理,分析不同施加处理条件下水稻拔节期(淹水阶段)土壤理化性质的差异,并以产甲烷菌功能基因(mcrA)为分子标记,利用限制性片段长度多态性聚合酶链反应(PCR-RFLP)结合克隆测序对早、晚稻拔节期的稻田土壤产甲烷菌群落组成及其结构进行分析,了解废弃物施加对稻田土壤产甲烷菌组成结构的影响、减排的微生物学机制;正确评估废弃物施加对稻田土壤理化性质的影响及其与产甲烷菌多样性和群落结构与稻田CH4排放通量之间的关系,为废弃物施加减少CH4排放通量提供理论依据。
1 材料与方法
1.1 试验地概况
研究区位于闽江河口区福州平原的南分支—乌龙江北岸,海拔3—5m,属亚热带季风气候。实验区位于福建省农科院水稻所吴凤综合试验基地(25°59′44.12″N, 119°38′35.50″E,图1)内,试验地点概况参见文献[34- 35]。

图1 采样点位置图Fig.1 Location of sampling site
1.2 施加物
炉渣主要含有SiO2(27.7%)、CaO(35.7%)、SO3(1.3%)、Fe2O3(6.2%)、P2O5(0.1%)、MgO(4.3%)和K2O(2.7%)。
生物炭主要含有N(1.4%)、P(1.0%)、K(1.8%)、C(56.6%)、S(0.6%)、Mg(1.0%)、Ca(0.5%)和Fe(0.2%)。
炉渣、生物炭在使前先用孔径为2mm的筛子过筛处理[32]。
1.3 水稻品种
早稻品种为江西省农科院研发的禾盛10号;晚稻品种为福建省农科院研发的沁香优212号。
1.4 施加处理方法
本实验分别于2015年早稻和晚稻种植期间各进行一次施加处理(早、晚稻在相同试验区内)。其中早稻生长期为2015年4月16日到2015年7月16日,晚稻生长期为2015年7月25日到2015年11月6日。本实验设置炉渣、生物炭、炉渣和生物炭混施3种施加处理,以不施加处理作为对照组(早稻收获后种植晚稻,晚稻试验小区的前季早稻并未有添加试验,仅在晚稻种植时添加)。在水稻移栽前一次性施加到犁耕层土壤中(0—15cm)。炉渣、生物炭的施加量均为8t/hm2,混施处理的施加量为炉渣、生物炭各施8t/hm2。每个处理设置3个重复,共12个小区,每个小区面积10m2,随机区组排列。各小区之间用0.5cm厚、30cm高的PVC板隔离小区,防止水体和物质交换。样地施肥情况参见文献[34- 35]。
1.5 土壤样品采集
分别于早稻、晚稻拔节期(淹水阶段),在每个重复样地,用采土器采集每个试验小区0—15cm土柱,装入自封袋带回实验室,采集的每份土样分为两部分,一部分用于土壤理化指标测定,另一部分置于-20℃冰柜保存用于后续的DNA提取及产甲烷菌测定。
1.6 土壤样品理化指标测定
土壤pH值采用IQ150便捷式pH计(IQ Scientific Instruments, USA),土壤电导率采用2265FS便捷式电导计(Spectrum Technologies Inc., USA)测定,并以此表征土壤盐度。土壤容重采用环刀法测定,含水量采用铝盒烘干法测定[36]。土壤有机碳(SOC)和全氮(TN)采用碳氮元素分析仪测定(Elementar Vario MAX CN, Germany)。
1.7 产甲烷菌群落结构多样性分析
1.7.1 土壤总DNA提取
将每个处理的3个重复土样混合成1份样品,称取新鲜土壤0.5g,用E.Z.N.ATMSoil DNA Kit(OMEGA, USA)进行土壤总DNA的提取和纯化。以1.0%琼脂糖凝胶电泳检测,DNA纯度和浓度通过超微量紫外分光光度计(NanoDrop, USA)检测。收集的DNA存于-20℃保存备用。
1.7.2 产甲烷菌(mcrA基因)扩增和纯化
利用产甲烷菌mcrA基因的特异性引物ME1和ME2[37](GCMATGCARATHGGWATGTC)/(TCATKGCRTAGTTDGGRTAGT),以土壤总DNA为模板进行PCR扩增。PCR扩增反应体系(25μL):10×PCR缓冲液2.5μL,dNTP 2μL,引物ME1/ME2各0.5μL,DNA模板0.5μL,ExTaq酶0.25μL,加入ddH2O至25μL。
PCR反应程序为:94℃预变性5min,30个循环:94℃变性45s,48℃退火1min,72℃延伸90s;72℃延伸10min。扩增得到的mcrA基因经过浓度为1%的琼脂糖凝胶电泳检测。在紫外灯切下含目的DNA片段的凝胶条带,用SanPrep柱式DNA胶回收试剂盒(Sangon,China) 回收纯化。
1.7.3 产甲烷菌(mcrA基因)克隆文库的构建
mcrA基因与pMDTM18-Tvector(TaKaRa)载体连接后,转入E.coliDH5α感受态细胞,转化产物涂布到含有氨苄青霉素的LB固体培养基上,待菌液吸收后37℃倒置培养12—16h;挑选白色克隆子构建克隆文库。在构建的文库中挑取100个阳性克隆进行菌落PCR验证,根据扩增条带的大小鉴定重组子。菌落PCR扩增采用PMDTM18—Tvector载体的通用引物M13-47/RV-M(CGCCAGGGTTTTCCCAGTCACGAC)/(GAGCGGATAAT TTCACACAGG)。
菌落PCR扩增体系(25μL):10×PCR缓冲液2.5μL,dNTP 2μL,上下游引物各0.5μL,DNA模板(单菌落)适量,ExTaq酶0.2μL,加入ddH2O 至25μL。PCR反应程序:94℃预变性5min,30个循环:94℃变性45s,48℃退火1min,72℃延伸90s;72℃延伸10min。
1.7.4 产甲烷菌(mcrA基因)克隆文库的RFLP分析和测序
选取含有正确插入片段的阳性克隆并对其PCR产物进行MspI(TaKaRa, Japan)酶切。酶切反应体系(10μL)[38]:10×T缓冲液 1μL,0.1%BSA 1μL,菌落PCR产物5μL,限制性内切酶MspI 0.5μL,ddH2O 2.5μL。将上述酶切体系放置37℃水浴酶切3h。经2%的琼脂糖凝胶电泳分离酶切片段并用凝胶成像系统采集照片。酶切图谱完全一样的作为一个操作分类单位(operational taxonomic unit, OTU)。将具有不同谱型的克隆子进行测序。
1.7.5 稻田土壤产甲烷菌系统发育树的构建
将所获得的基因序列提交GenBank,通过BLAST程序搜索相似序列,从数据库中检索最匹配的序列,利用Clustal X软件进行相似性分析。采用MEGA4.0软件中的邻位相连法构建系统发育树,并用Bootstrap 检验(替代率为l 000)系统发育树。
1.7.6 稻田土壤产甲烷菌多样性分析
根据克隆文库酶切图谱结果进行多样性分析并计算克隆文库的库容C。多样性指数包括酶切类型数、单一酶切类型数、香农-威纳多样性指数(H′)和辛普森多样性指数(D)。库容C计算公式如下[39]:
C=(l-nl/N)×100%
式中,N代表克隆文库总克隆数,nl代表在文库仅出现1次的OTU的数量。香农-威纳多样性指数(H′)和辛普森多样性指数(D)采用Bio-dap软件进行计算分析。
1.8 数据处理
应用Excel 2003和SPSS 17.0统计分析软件对测定数据进行整理。采用Excel 2003计算原始数据的平均值及标准差,采用SPSS 17.0中的单因素方差分析对同一生长季不同处理间的土壤理化性质进行差异显著性检验。
2 结果与分析
2.1 稻田土壤理化性质
不同施加处理条件下早、晚稻拔节期的土壤理化性质如表1所示。早稻拔节期,对照、炉渣、生物炭和混施处理的土壤盐度变化范围为0.20—0.57mS/cm,其中混施处理显著提高土壤盐度(P<0.05),提高比例为185.00%;不同施加处理的pH值变化范围为6.33—7.41,混施处理显著提高土壤pH(P<0.05),提高比例为17.06%。与对照相比,施加处理的土壤容重、含水量和全氮无显著差异(P>0.05);与对照相比,炉渣、生物炭和混施处理的土壤有机碳含量分别提高了2.89%、5.60%和33.96%;与对照相比,炉渣、生物炭和混施处理的碳氮比值分别提高了1.07%、5.82%和27.80%。
晚稻拔节期,混施处理显著提高土壤盐度(P<0.05),提高比例为104.35%;炉渣和混施处理显著提高土壤pH(P<0.05),提高比例分别为13.49%和18.59%。与对照相比,施加处理的土壤容重、含水量和全氮无显著差异(P>0.05),与对照相比,炉渣、生物炭和混施处理的土壤有机碳含量分别提高了2.80%、33.38%和37.64%;与对照相比,炉渣、生物炭和混施处理的碳氮比值分别提高了0.62%、21.03%和24.48%。综合早、晚稻土壤理化性质可知,与对照相比,施加处理对早、晚稻拔节期土壤理化性质的影响基本一致。即施加处理提高土壤盐度,其中混施处理最为明显,且炉渣、生物炭和混施处理也提高土壤pH,其中炉渣和混施处理对土壤pH影响较大;此外,生物炭和混施处理还提高了土壤有机碳含量和碳氮比值。
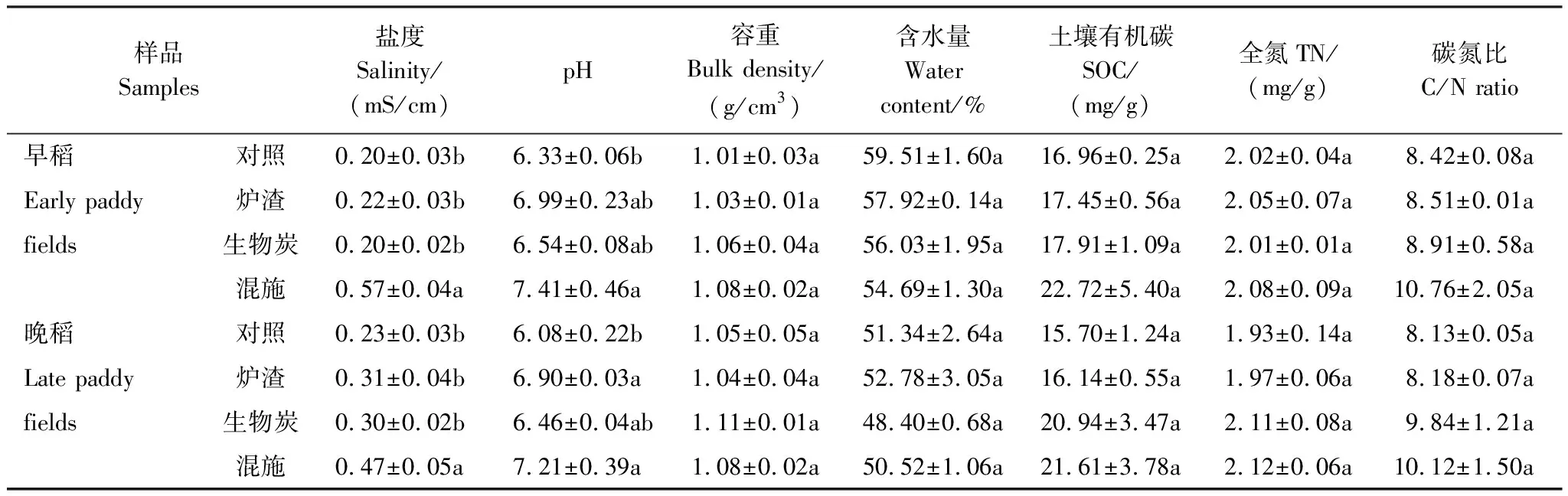
表1 施加处理稻田土壤的理化性质
不同字母表示同一生长季不同处理样地之间具有显著差异,P<0.05
2.2 土壤总DNA提取及产甲烷菌(mcrA基因)的扩增
利用土壤提取试剂盒对早、晚稻不同施加处理共8个土壤样品进行总DNA提取,其A260/A280值均在1.80以上(表2),表明提取的DNA纯度较高,满足下一步PCR对于模板的要求。以提取的DNA为模板可扩增出约为760bp的目的片段,与预期的mcrA基因的分子大小相符(图2)。
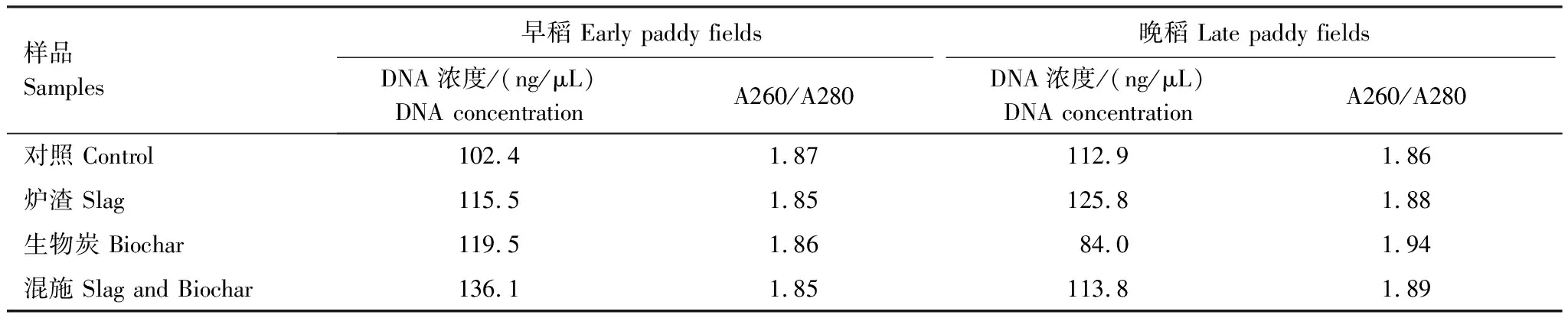
表2 施加处理稻田土壤总DNA的提取结果
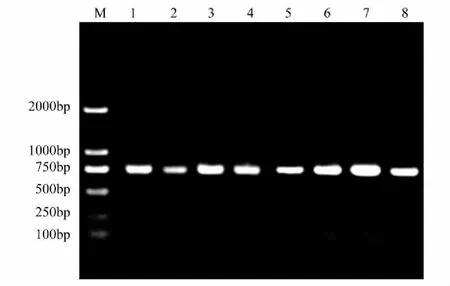
图2 稻田土壤mcrA基因扩增Fig.2 PCR amplification of mcrA gene in paddy fields 1—4泳道分别表示早稻对照、炉渣、生物炭和混施处理的样品;5—8泳道分别表示晚稻对照、炉渣、生物炭和混施处理的样品
2.3 产甲烷菌(mcrA基因)克隆文库的构建及PCR-RFLP分析
将不同施加处理稻田土壤产甲烷菌阳性克隆的菌落PCR产物经MspI酶切,酶切产物经2%的琼脂糖凝胶电泳分离,酶切电泳图谱(部分)如图3所示。分析酶切谱型,将酶切图谱完全一样的谱型归为一个OTU,对照、炉渣、生物炭和混施处理的早稻土壤产甲烷菌的酶切图谱分别得到19、18、20和22个OTU,4种处理的晚稻土壤产甲烷菌的酶切图谱分别得到22、18、19和27个OTU,将不同谱型的克隆子进行测序后经Bio-dap分析多样性指数,结果见表3。
稻田土壤产甲烷菌多样性分析结果显示,早、晚稻不同施加处理共8个样品的产甲烷菌(mcrA基因)构建的克隆文库覆盖率均在87.50% 以上,说明覆盖程度较高,文库比较真实代表该稻田土壤中产甲烷菌的群落结构多样性。对照、炉渣、生物炭和混施处理的早稻土壤产甲烷菌的香农-威纳指数(H′)分别为2.55、2.56、2.60和2.79;4种处理的晚稻土壤产甲烷菌的香农-威纳指数(H′)分别为2.31、2.36、2.69和2.98。由此可知,施加处理的稻田土壤产甲烷菌多样性高于对照,尤生物炭和混施处理为明显。
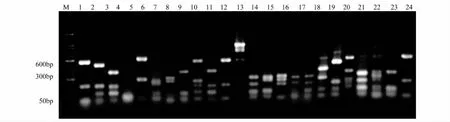
图3 mcrA基因阳性克隆子的MspⅠ酶切图谱(部分)Fig.3 mcrA genes of positive clones digested by MspⅠ(partial)
比较不同处理的辛普森指数(D)可知(表3),对照、炉渣、生物炭和混施处理的早稻土壤产甲烷菌的辛普森指数(D)分别为0.096、0.082、0.093和0.063;4种处理的晚稻土壤产甲烷菌的辛普森指数(D)分别为0.165、0.153、0.076和0.061。施加处理的早、晚稻土壤产甲烷菌辛普森指数(D)均低于对照,说明施加处理降低了产甲烷菌物种的均匀度。综合香农-威纳指数(H′)和辛普森指数(D)可知,施加处理提高了稻田土壤产甲烷菌的多样性,并降低了产甲烷菌物种的均匀度。
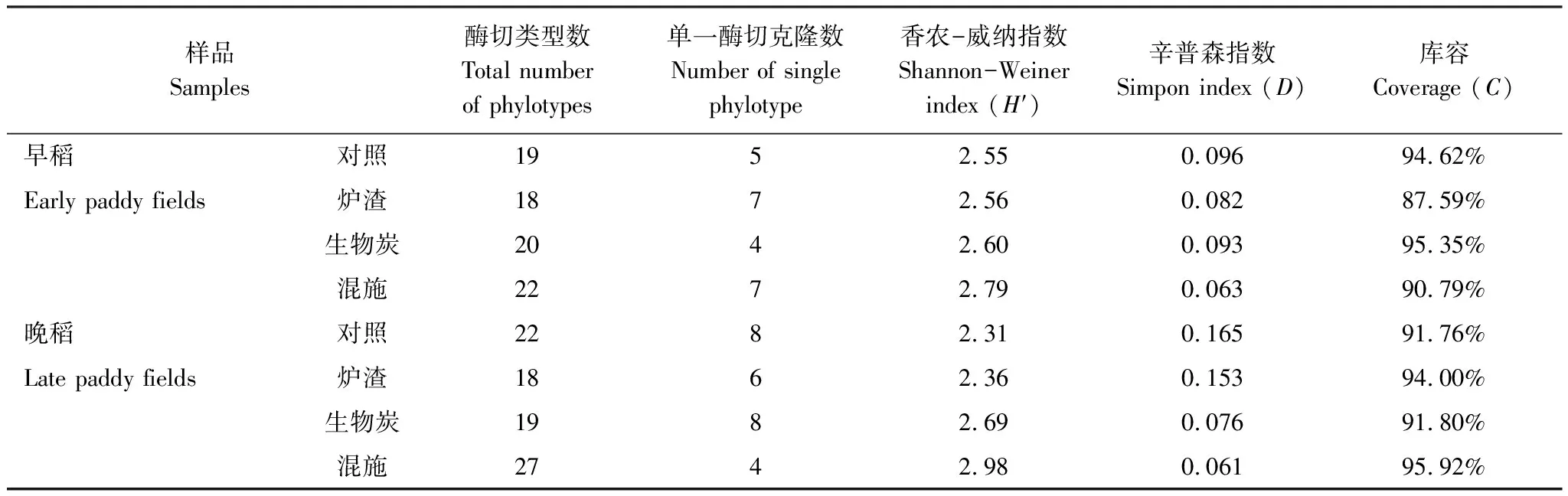
表3 施加处理稻田土壤克隆文库的多样性分析
2.4 产甲烷菌(mcrA基因)测序和系统发育分析
根据酶切分类结果,分别将早稻样品79个OTUs和晚稻样品86个OTUs的克隆子接入LB液体培养基,将单克隆菌液送上海生工生物工程股份有限公司(Sangon)测序分析,将测定所得的序列与GenBank中已知序列进行相似性比对。比对结果显示,不同酶切图谱类型的克隆子可能代表同一个属,克隆子与GenBank数据中产甲烷菌mcrA序列相似性范围在87%—99%之间,并且90%以上是不可培养的产甲烷古菌。将早稻、晚稻各4个处理的测序结果用MEGA4.0构建系统发育树。由图4、图5可知,早稻土壤产甲烷菌(mcrA基因)共鉴定出6个菌属,晚稻土壤产甲烷菌(mcrA基因)共鉴定出8个菌属,归属于甲烷微菌目(Methanomicrobiales)、甲烷杆菌目(Methanobacteriales)、甲烷球菌目(Methanococcales)、甲烷八叠球菌目(Methanosarcinales)、甲烷胞菌目(Methanocellales)和Methanomassiliicoccales等6个类群。其中甲烷微菌目是优势类群,包括Methanoregula、甲烷囊菌属(Methanoculleus)、甲烷螺菌属(Methanospirillum)和产甲烷菌属(Methanogenium)等4个菌属。此外,本研究检测到的甲烷短杆菌属(Methanobrevibacter)和甲烷杆菌属(Methanobacterium)属于甲烷杆菌目,甲烷球菌属(Methanococcus)属于甲烷球菌目,甲烷八叠球菌属(Methanosarcina)属于甲烷八叠球菌目,Methanocella属于甲烷胞菌目,Methanomassiliicoccus属于Methanomassiliicoccales。

图4 施加处理早稻土壤产甲烷菌系统发育树Fig.4 Phylogenetic tree of methanogens under different amendments in early paddy fieldsE:早稻Early paddy fields,L:晚稻 Late paddy fields,C:对照Control,S:炉渣Slag,B:生物炭 Biochar,SB:混施 Slag and Biochar;图中编号表示克隆子编号
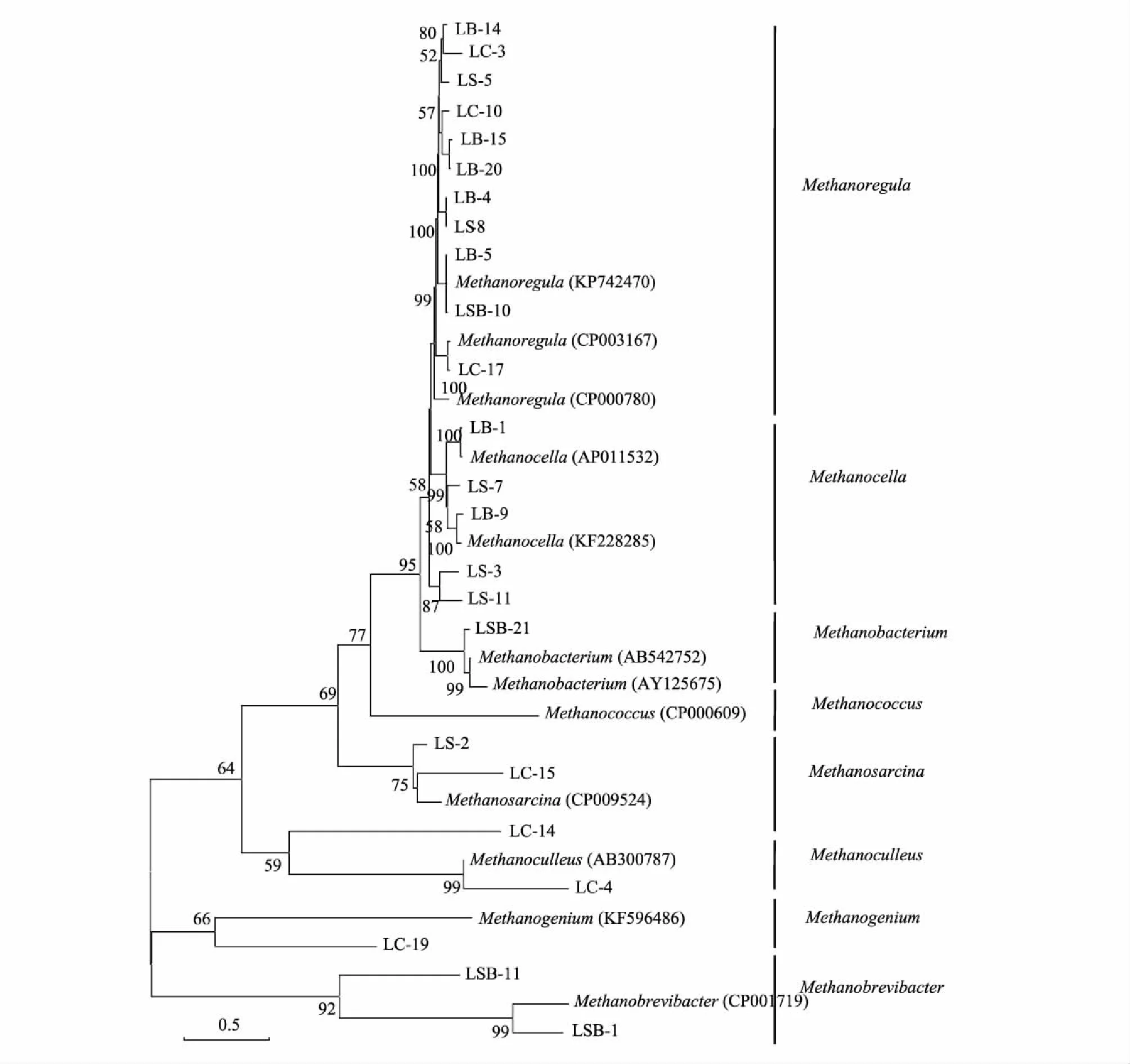
图5 施加处理晚稻土壤产甲烷菌系统发育树Fig.5 Phylogenetic tree of methanogens under different amendments in late paddy fields
2.5 施加处理稻田土壤产甲烷菌(mcrA基因)群落组成
用堆积图表示相对丰度在1.00%以上的产甲烷菌菌属,早、晚稻不同施加处理下稻田土壤产甲烷菌的群落组成如图6和图7所示。由图6可知,早稻土壤产甲烷菌群落组成的6个菌属中,Methanoregula为优势菌属,其相对丰度在对照、炉渣、生物炭和混施处理稻田土壤样品中:分别占52.69%、50.00%、72.09%和57.89%。晚稻土壤产甲烷菌群落组成的8个菌属中(图7),Methanoregula菌属在4种处理的土壤样品中其相对丰度分别占38.73%、38.68%、47.61%和30.47%。结合图6和图7可知,本研究稻田土壤检测到的产甲烷菌菌属有Methanoregula、甲烷囊菌属(Methanoculleus)、甲烷螺菌属(Methanospirillum)、产甲烷菌属(Methanogenium)、Methanomassiliicoccus、甲烷短杆菌属(Methanobrevibacter)、甲烷杆菌属(Methanobacterium)、甲烷球菌属(Methanococcus)、甲烷八叠球菌属(Methanosarcina)和Methanocella等10个菌属。
3 讨论
3.1 稻田土壤产甲烷菌类群
近年来,产甲烷菌被分为4纲、7目、14科、35属[40]。本研究在稻田土壤中检测到6个目,包括甲烷微菌目(Methanomicrobiales)、甲烷杆菌目(Methanobacteriales)、甲烷球菌目(Methanococcales)、甲烷八叠球菌目(Methanosarcinales)、甲烷胞菌目(Methanocellales)和Methanomassiliicoccales。其中占优势的类群是Methanomicrobiales(49.57%—79.06%),其次是Methanocellales(10.32%—33.63%)和Methanobacteriales(2.32%—25.00%)。该研究结果与前人报道基本一致[23,41- 42]。甲烷火菌目(Methanopyrales)是甲烷嗜高热菌[43],研究学者在高纬度北极冻土区土壤和深海热液中发现存在少部分该类群[44- 45],本研究在稻田土壤中没有检测到。从属水平的群落结构来看,本研究结果显示稻田土壤中产甲烷优势菌属主要有Methanoregula(30.47%—72.30%)、Methanocella(10.32%—33.63%)和Methanobacterium(0.85%—25.00%),这与先前在其他稻田土壤检出的产甲烷菌类群基本一致[19,22,25,46]。由于生态环境各异,可能导致土壤中产甲烷菌群落的类群不尽相同,例如Lee等[24]在美国稻田土壤中还检测到Methanosphaerula和Methanohalobium,Liu等[47]在中国稻田土壤中还检测到Methanolinea和Methanomethylovorans。另一方面,产甲烷菌的群落结构在水稻不同生育时期也会发生变化,Lee等[24]研究发现Methanocella、Methanosarcina和Methanobacterium是稻田土壤的优势类群,其在扬花期和抽穗期(60d和90d)相对丰度最大;Methanococcus和Candidatus_Methanoregula在移栽120d后的相对丰度最大,但在移栽150d后没有检测到这两种类群。Ke等[17]研究发现稻田土壤中产甲烷菌优势类群主要是Methanosarcinaceae(相对丰度约占60%),而在移栽50d后检测到稻田土壤的主要类群为Methanomicrobiales。比较早、晚稻拔节期土壤产甲烷菌群落组成可知(图6和图7),氢营养型的甲烷囊菌属(Methanoculleus)是晚稻土壤的特有菌属。氢营养型的Methanoculleus通常利用 H2/CO2、甲酸盐生成CH4,而不利用乙酸和甲基胺生成CH4。由于早、晚稻生长季期间的气候差异使得早稻土壤的甲烷囊菌属(Methanoculleus)相对丰度较小,因此该类群在早稻土壤中尚未被检测到。
3.2 施加处理条件下土壤理化性质对稻田土壤产甲烷菌多样性的影响
由早稻、晚稻拔节期土壤理化性质可知(表1),炉渣、生物炭和混施处理提高了土壤pH,主要是因为生物炭含有碱性基团,能够中和土壤中的质子[48],炉渣含有Ca2+等碱性阳离子施入土壤后可提高土壤 pH[49]。有研究指出,较低pH值不适宜涉及CH4代谢的微生物菌群生长[50],CH4产生环境中对产甲烷菌适宜的pH值范围是6.9—7.2[51]。因此土壤环境因素如pH、土壤温度和底物供应等均会影响产甲烷活性或产甲烷菌群落多样性,直接或间接影响CH4产生。从对照组产甲烷菌多样性指数来看(表3),晚稻土壤产甲烷菌的群落结构复杂性要低于早稻,此结果与前人研究结果一致[52]。由表1可知,对照组早稻土壤的pH和含水量分别为6.33、59.51%,而晚稻土壤的pH和含水量分别为6.08、51.34%。由此可见,经历了早稻生长季之后,土壤pH降低,植物体生长和微生物代谢消耗了部分土壤碳源、氮源(对照组的土壤有机碳含量从16.96mg/g下降到15.70mg/g,全氮含量从2.02mg/g 下降到1.93mg/g)。因此土壤微生物可利用底物下降,使得产甲烷菌可能受碳源供应不足的限制而形成明显的种间竞争,导致多样性有所下降。
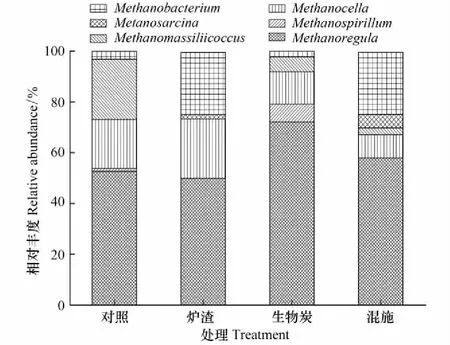
图6 施加处理早稻土壤产甲烷菌群落组成 Fig.6 Methanogenic community composition under different amendments in early paddy fields
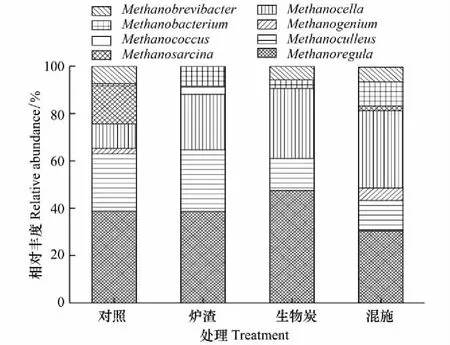
图7 施加处理晚稻土壤产甲烷菌群落组成 Fig.7 Methanogenic community composition under different amendments in late paddy fields
由表1可知,生物炭和混施处理均提高了稻田土壤有机碳含量和碳氮比值,许欣等[53]也发现施加生物炭能提高土壤有机碳含量和碳氮比值。由于生物炭中的碳大多以稳定芳香环不规则叠层堆积存在,具有高度的化学和微生物惰性,施进土壤后难以被土壤微生物利用[54],本课题组研究发现生物炭和混施处理会减少稻田土壤细菌数量、增加土壤真菌/细菌比值[34]。因此生物炭和混施处理可通过影响土壤微生物活动从而刺激土壤碳循环,影响产甲烷菌的多样性。比较施加处理香农-威纳指数(H′)可知(表3),早、晚稻生长季,3种施加处理的稻田土壤产甲烷菌多样性在不同程度上高于对照组,生物炭、混施较为明显。由此可见,生物炭和混施处理提高了土壤有机碳含量和碳氮比值,通过影响细菌、真菌等微生物生长繁殖进而影响土壤碳、氮循环,改变土壤原有产甲烷菌群落组成,引起土壤产甲烷菌种群结构发生变化,改变主要类群甲烷微菌目(Methanomicrobiales)和甲烷杆菌目(Methanobacteriales)的相对丰度,从而增加产甲烷菌的多样性。
3.3 施加处理条件下土壤理化性质对稻田产甲烷菌群落结构组成的影响
由图6和图7的稻田土壤产甲烷菌群落组成可知,炉渣施加提高了Methanococcus的相对丰度、降低了Methanomassiliicoccus的相对丰度;生物炭处理提高了Methanoregula的相对丰度、降低了Methanosarina的相对丰度。由此可见,不同的废弃物及其施用量对稻田产甲烷菌群落结构的影响并不相同。一方面施加物通过影响土壤理化性质从而改变土壤微生物菌群,另一方面,施加物的自身性质(如生物炭的稳定性、炉渣的氧化铁等成分)影响了稻田土壤产甲烷菌的群落组成。由表1的土壤理化性质可知,施加处理在不同程度上提高了土壤盐度,这主要是因为生物炭和炉渣含有钾、钙、镁、铁等元素;炉渣还含有大量活性氧化铁,这些物质施加后将提高了土壤盐度。研究指出盐度的增加会抑制产甲烷菌Methanocellaceae的活性[21],盐度的增大还可能影响厌氧发酵过程中电子受体的供应,导致产甲烷菌可利用底物发生变化从而影响产甲烷菌群落结构[55]。因此施加生物炭、炉渣等废弃物,可通过提高土壤盐度,使产甲烷菌的群落结构发生改变。与对照相比,3种施加处理均降低了早稻土壤Methanomassiliicoccus的相对丰度。Methanomassiliicoccus属于甲基型产甲烷古菌,缺少将CO2还原为甲基辅酶M的完整路径[56]。有研究发现Fe3+可直接抑制CH4的生成,影响产甲烷菌产CH4的作用[57]。炉渣含有的氧化铁作为电子受体,竞争H2或甲醇、甲胺类物质底物,因此不利于Methanomassiliicoccus的生长。本课题组研究发现施加处理能降低稻田CH4的排放通量[34],由此可见,施加处理可通过提高土壤盐度、改变产甲烷菌可利用底物,降低Methanomassiliicoccus的相对丰度从而引起CH4产生量的减少。此外我们还发现生物炭施加降低了Methanosarcina的相对丰度。Methanosarcina和Methanosaeta是两种乙酸营养途径的产甲烷菌,有研究发现,理论上67%的CH4由乙酸的脱甲基途径产生[58]。由于生物炭高度稳定,不易被微生物降解产生乙酸等产CH4的前体物质,因此不利于乙酸营养型产甲烷菌的生长。研究指出Methanosarcina的甲烷产生潜力极大[25- 26,59],Bao等[22]还发现Methanosarcinaceae的相对丰度与CH4产生呈正相关;由此可见Methanosarcina占土壤产CH4微生物的比例下降对稻田CH4排放的影响较大。因此施加生物炭可通过影响土壤碳氮含量、降低产甲烷菌Methanosarcina的相对丰度,从而达到减少稻田CH4排放的效果。
3.4 炉渣与生物炭单施与配施效应比较
本文不仅研究了单一施加处理的作用,还进一步探讨了炉渣与生物炭二者配施的效应,结果显示将生物炭与炉渣混合施加,CH4的减排效果优于单一施加[34],说明混合施加具有明显的增强作用。由表1土壤理化性质可知,与炉渣或生物炭单一施加处理相比,混施处理的土壤盐度、pH、土壤有机碳含量、全氮含量以及碳氮比值最高,说明混合施加对土壤理化性质影响较大。而且,混施处理产甲烷菌多样性也高于单一施加处理(表3)。混合施加处理表现出较好的减排效果,分析原因认为与生物炭和炉渣配合施加综合了2种材料的特性有关,也可能与施加量有关,因为混合施加处理的施加量是单一施加的2倍(炉渣和生物炭各8t/hm2,总计16t/hm2)。施加量不同是否产生影响还需要进一步的研究,目前本课题组正在进行此项工作。
4 结论
(1) 早稻拔节期,混施处理显著提高土壤盐度、pH;晚稻拔节期,混施处理显著提高土壤盐度,炉渣和混施处理显著提高pH。早、晚稻拔节期,生物炭和混施处理提高土壤有机碳含量、碳氮比值。
(2) 与对照相比,生物炭、炉渣和混合施加这3种处理均提高了稻田土壤产甲烷菌的多样性,并降低了产甲烷菌物种的均匀度。
(3) 本研究的稻田土壤产甲烷菌主要有6大类群:甲烷微菌目(Methanomicrobiales)、甲烷杆菌目(Methanobacteriales)、甲烷八叠球菌目(Methanosarcinales)、甲烷球菌目(Methanococcales)、甲烷胞菌目(Methanocellales)和Methanomassiliicoccales;其中优势类群为甲烷微菌目(Methanomicrobiales)。优势菌属主要是Methanoregula、Methanocella和Methanobacterium。
(4) 与对照相比,炉渣、生物炭和混施处理均降低了早稻土壤Methanomassiliicoccus相对丰度;生物炭处理还降低了Methanosarcina相对丰度;施加处理影响土壤理化性质如提高土壤盐度、土壤有机碳含量和碳氮比值,使得产甲烷菌群落组成发生改变,可能是其降低CH4排放通量的原因之一。
参考文献(References):
[1] Bridgham S D, Cadillo-Quiroz H, Keller J K, Zhuang Q L. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Global Change Biology, 2013, 19(5): 1325- 1346.
[2] IPCC. Climate Change 2013: the Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, United Kingdom and New York, NY, USA: Cambridge University Press, 2013: 1535.
[3] Conrad R. The global methane cycle: recent advances in understanding the microbial processes involved. Environmental Microbiology Reports, 2009, 1(5): 285- 292.
[4] Ali M A, Sattar M A, Islam M N, Inubushi K. Integrated effects of organic, inorganic and biological amendments on methane emission, soil quality and rice productivity in irrigated paddy ecosystem of Bangladesh: field study of two consecutive rice growing seasons. Plant and Soil, 2014, 378(1/2): 239- 252.
[5] Turmel M S, Speratti A, Baudron F, Verhulst N, Govaerts B. Crop residue management and soil health: a systems analysis. Agricultural Systems, 2015, 134: 6- 16.
[6] Susilawati H L, Setyanto P, Makarim A K, Ariani M, Ito K, Inubushi K. Effects of steel slag applications on CH4, N2O and the yields of Indonesian rice fields: a case study during two consecutive rice-growing seasons at two sites. Soil Science and Plant Nutrition, 2015, 61(4): 704- 718.
[7] Hu N J, Wang B J, Gu Z H, Tao B R, Zhang Z W, Hu S J, Zhu L Q, Meng Y L. Effects of different straw returning modes on greenhouse gas emissions and crop yields in a rice-wheat rotation system. Agriculture, Ecosystems & Environment, 2016, 223: 115- 122.
[8] Wu M X, Han X G, Zhong T, Yuan M D, Wu W X. Soil organic carbon content affects the stability of biochar in paddy soil. Agriculture, Ecosystems & Environment, 2016, 223: 59- 66.
[9] Wang J Y, Pan X J, Liu Y L, Zhang X L, Xiong Z Q. Effects of biochar amendment in two soils on greenhouse gas emissions and crop production. Plant and Soil, 2012, 360(1/2): 287- 298.
[10] Zheng J F, Chen J H, Pan G X, Liu X Y, Zhang X F, Li L Q, Bian R J, Cheng K, Zheng J W. Biochar decreased microbial metabolic quotient and shifted community composition four years after a single incorporation in a slightly acid rice paddy from southwest China. Science of the Total Environment, 2016, 571: 206- 217.
[11] Zhang A F, Bian R J, Pan G X, Cui L Q, Hussain Q, Li L Q, Zheng J W, Zheng J F, Zhang X H, Han X J, Yu X Y. Effects of biochar amendment on soil quality, crop yield and greenhouse gas emission in a Chinese rice paddy: a field study of 2 consecutive rice growing cycles. Field Crops Research, 2012, 127: 153- 160.
[12] Tong H, Hu M, Li F B, Chen M J. Biochar enhances the microbial and chemical transformation of pentachlorophenol in paddy soil. Soil Biology and Biochemistry, 2014, 70: 142- 150.
[13] Qian L, Chen L, Joseph S, Pan G X, Li L Q, Zheng J W, Zhang X H, Zheng J F, Yu X Y, Wang J F. Biochar compound fertilizer as an option to reach high productivity but low carbon intensity in rice agriculture of China. Carbon Management, 2014, 5(2): 145- 154.
[14] Wang N, Chang Z Z, Xue X M, Yu J G, Shi X X, Ma L Q, Li H B. Biochar decreases nitrogen oxide and enhances methane emissions via altering microbial community composition of anaerobic paddy soil. Science of the Total Environment, 2017, 581- 582: 689- 696.
[15] Wang W Q, Lai D Y F, Li S C, Kim P J, Zeng C S, Li P F, Liang Y C. Steel slag amendment reduces methane emission and increases rice productivity in subtropical paddy fields in China. Wetlands Ecology and Management, 2014, 22(6): 683- 691.
[16] Scavino A F, Ji Y, Pump J, Klose M, Claus P, Conrad R. Structure and function of the methanogenic microbial communities in Uruguayan soils shifted between pasture and irrigated rice fields. Environmental Microbiology, 2013, 15(9): 2588- 2602.
[17] Ke X B, Lu Y H, Conrad R. Different behaviour of methanogenic archaea andThaumarchaeotain rice field microcosms. FEMS Microbiology Ecology, 2014, 87(1): 18- 29.
[18] Seo J, Jang I, Gebauer G, Kang H. Abundance of methanogens, methanotrophic bacteria, and denitrifiers in rice paddy soils. Wetlands, 2014, 34(2): 213- 223.
[19] Liu D Y, Ishikawa H, Nishida M, Tsuchiya K, Takahashi T, Kimura M, Asakawa S. Effect of paddy-upland rotation on methanogenic archaeal community structure in paddy field soil. Microbial Ecology, 2015, 69(1): 160- 168.
[20] Liu Y, Liu X Y, Cheng K, Li L Q, Zhang X H, Zheng J F, Zheng J W, Pan G X. Responses of methanogenic and methanotrophic communities to elevated atmospheric CO2and temperature in a paddy field. Frontiers in Microbiology, 2016, 7: 1895.
[21] Peng J J, Wegner C E, Liesack W. Short-term exposure of paddy soil microbial communities to salt stress triggers different transcriptional responses of key taxonomic groups. Frontiers in Microbiology, 2017, 8: 400.
[22] Bao Q L, Xiao K Q, Chen Z, Yao H Y, Zhu Y G. Methane production and methanogenic archaeal communities in two types of paddy soil amended with different amounts of rice straw. FEMS Microbiology Ecology, 2014, 88(2): 372- 385.
[23] Zhou B B, Wang Y M, Feng Y Z, Liu X G. The application of rapidly composted manure decreases paddy CH4emission by adversely influencing methanogenic archaeal community: a greenhouse study. Journal of Soils and Sediments, 2016, 16(7): 1889- 1900.
[24] Lee H J, Kim S Y, Kim P J, Madsen E L, Jeon C O. Methane emission and dynamics of methanotrophic and methanogenic communities in a flooded rice field ecosystem. FEMS Microbiology Ecology, 2014, 88(1): 195- 212.
[25] Dubey S K, Singh A, Watanabe T, Asakawa S, Singla A, Arai H, Inubushi K. Methane production potential and methanogenic archaeal community structure in tropical irrigated Indian paddy soils. Biology and Fertility of Soils, 2014, 50(2): 369- 379.
[26] Nguyen S G, Guevarra R B, Kim J, Ho C T, Trinh M V, Unno T. Impacts of initial fertilizers and irrigation systems on paddy methanogens and methane emission. Water, Air, & Soil Pollution, 2015, 226: 309.
[27] 董达. 生物质炭对水稻生长与稻田甲烷排放效应的影响及其机理研究. 杭州: 浙江大学, 2015: 15- 23.
[28] Liu Y X, Yang M, Wu Y M, Wang H L, Chen Y X, Wu W X. Reducing CH4and CO2emissions from waterlogged paddy soil with biochar. Journal of Soils and Sediments, 2011, 11(6): 930- 939.
[29] Dong D, Yang M, Wang C, Wang H L, Li Y, Luo J F, Wu W X. Responses of methane emissions and rice yield to applications of biochar and straw in a paddy field. Journal of Soils and Sediments, 2013, 13(8): 1450- 1460.
[30] Han X G, Xue S, Wang C, Wu M X, Dong D, Zhong T, Thies J E, Wu W X. Mitigating methane emission from paddy soil with rice-straw biochar amendment under projected climate change. Scientific Reports, 2016, 6: 24731.
[31] Feng Y Z, Xu Y P, Yu Y C, Xie Z B, Lin X G. Mechanisms of biochar decreasing methane emission from Chinese paddy soils. Soil Biology and Biochemistry, 2012, 46: 80- 88.
[32] Wang W, Sardans J, Lai D Y F, Wang C, Zeng C, Tong C, Liang Y, Peuelas J. Effects of steel slag application on greenhouse gas emissions and crop yield over multiple growing seasons in a subtropical paddy field in China. Field Crops Research, 2015, 171: 146- 156.
[33] Singla A, Inubushi K. Effect of slag-type fertilizers on N2O flux from komatsuna vegetated soil and CH4flux from paddy vegetated soil. Paddy and Water Environment, 2015, 13(1): 43- 50.
[34] 王妙莹, 许旭萍, 王维奇, 王广磊, 苏程举, 安婉丽. 炉渣与生物炭施加对稻田温室气体排放及其相关微生物影响. 环境科学学报, 2017, 37(3): 1046- 1056.
[35] 马永跃, 仝川, 王维奇, 曾从盛. 浮萍对福州平原稻田CH4和N2O排放的影响分析. 中国生态农业学报, 2012, 20(6): 723- 727.
[36] 乌英嗄. 生物质炭施用对华北潮土土壤理化性质及微生物多样性的影响. 呼和浩特: 内蒙古师范大学, 2014: 5- 6.
[37] 佘晨兴, 仝川. 闽江口芦苇沼泽湿地土壤产甲烷菌群落结构的垂直分布. 生态学报, 2012, 32(17): 5299- 5308.
[38] 曾志华, 杨民和, 佘晨兴, 仝川. 闽江河口区淡水和半咸水潮汐沼泽湿地土壤产甲烷菌多样性. 生态学报, 2014, 34(10): 2674- 2681.
[39] Hill T C J, Walsh K A, Harris J A, Moffett B F. Using ecological diversity measures with bacterial communities. FEMS Microbiology Ecology, 2003, 43(1): 1- 11.
[40] 王保玉, 刘建民, 韩作颖, 刘健, 胡斌. 产甲烷菌的分类及研究进展. 基因组学与应用生物学, 2014, 33(2): 418- 425.
[41] Lu Y, Fu L, Lu Y H, Hugenholtz F, Ma K. Effect of temperature on the structure and activity of a methanogenic archaeal community during rice straw decomposition. Soil Biology and Biochemistry, 2015, 81: 17- 27.
[42] Liu H F, Wu X, Li Z S, Wang Q, Liu D, Liu G H. Responses of soil methanogens, methanotrophs, and methane fluxes to land-use conversion and fertilization in a hilly red soil region of southern China. Environmental Science and Pollution Research, 2017, 24(9): 8731- 8743.
[43] 傅霖, 辛明秀. 产甲烷菌的生态多样性及工业应用. 应用与环境生物学报, 2009, 15(4): 574- 578.
[44] Roussel E G, Konn C, Charlou J L, Donval J P, Fouquet Y, Querellou J, Prieur D, Bonavita M A C. Comparison of microbial communities associated with three Atlantic ultramafic hydrothermal systems. FEMS Microbiology Ecology, 2011, 77(3): 647- 665.
[45] Allan J, Ronholm J, Mykytczuk N C S, Greer C W, Onstott T C, Whyte L G. Methanogen community composition and rates of methane consumption in Canadian High Arctic permafrost soils. Environmental Microbiology Reports, 2014, 6(2): 136- 144.
[46] Xu J L, Zhuang L, Yang G Q, Yuan Y, Zhou S G. Extracellular Quinones affecting methane production and methanogenic community in paddy soil. Microbial Ecology, 2013, 66(4): 950- 960.
[47] Liu J N, Xu H S, Jiang Y, Zhang K, Hu Y G, Zeng Z H. Methane emissions and microbial communities as influenced by dual cropping ofAzollaalong with early rice. Scientific Reports, 2017, 7: 40635.
[48] Mazej D, Falnoga I, Veber M, Stibilj V. Determination of selenium species in plant leaves by HPLC-UV-HG-AFS. Talanta, 2006, 68(3): 558- 568.
[49] Ali M A, Lee C H, Kim P J. Effect of silicate fertilizer on reducing methane emission during rice cultivation. Biology and Fertility of Soils, 2008, 44(4): 597- 604.
[50] Dunfield P, Knowles R, Dumont R, Moore T R. Methane production and consumption in temperate and subarctic peat soils: response to temperature and pH. Soil Biology and Biochemistry, 1993, 25(3): 321- 326.
[51] Wang Z P, Lindau C W, Delaune R D, Jr P W H. Methane emission and entrapment in flooded rice soils as affected by soil properties. Biology and Fertility of Soils, 1993, 16(3): 163- 168.
[52] 李大明, 成艳红, 刘满强, 秦江涛, 焦加国, 李辉信, 胡锋. 双季稻田甲烷排放与土壤产甲烷菌群落结构和数量关系研究. 农业环境科学学报, 2013, 32(4): 866- 873.
[53] 许欣, 陈晨, 熊正琴. 生物炭与氮肥对稻田甲烷产生与氧化菌数量和潜在活性的影响. 土壤学报, 2016, 53(6): 1517- 1527.
[54] Pan F X, Li Y Y, Chapman S J, Khan S, Yao H Y. Microbial utilization of rice straw and its derived biochar in a paddy soil. Science of the Total Environment, 2016, 559: 15- 23.
[55] 康晏, 王万春, 任军虎. 生物气生成的地球化学因素分析. 矿物岩石地球化学通报, 2004, 23(4):350- 354.
[56] 张坚超, 徐镱钦, 陆雅海. 陆地生态系统甲烷产生和氧化过程的微生物机理. 生态学报, 2015, 35(20): 6592- 6603.
[57] Van Bodegom P M, Scholten J C M, Stams A J M. Direct inhibition of methanogenesis by ferric iron. FEMS Microbiology Ecology, 2004, 49(2): 261- 268.
[58] Conrad R. Microbial ecology of methanogens and methanotrophs. Advances in Agronomy, 2007, 96: 1- 63.
[59] De Vrieze J, Hennebel T, Boon N, Verstraete W.Methanosarcina: the rediscovered methanogen for heavy duty biomethanation. Bioresource Technology, 2012, 112: 1- 9.
