伴有多种突变基因的初治原发AML的临床特征分析
2018-06-07焦扬
焦 扬
(郑州大学附属肿瘤医院检验科,郑州 450008)
急性髓细胞白血病(acute myeloid leukemia,AML)是一类由于造血祖细胞增殖异常且伴分化受阻而导致的血液系统恶性肿瘤。由基因突变而导致细胞增殖、分化和细胞凋亡途径的异常是AML发病的基础,现普遍认为基因突变导致白血病发病的机制与“二次打击模式”有关,多种基因最终突变导致白血病的发生、发展。有学者提出两类突变的学说,认为AML的发生至少需要Ⅰ、Ⅱ型突变。Ⅰ型突变的主要作用是异常激活信号转导通路和诱导细胞增殖失控,Ⅱ型突变主要作用是影响转录因子功能和抑制细胞正常分化[1]。本研究依据“两类突变学说”的思路,把初治原发AML患者按基因突变数量(GMN)的不同分组,对比分析他们之间的临床差异,为AML的诊断分型、治疗选择、随访监测、预后估计及发病机制的探讨提供参考数据,现报道如下。
1 资料与方法
1.1一般资料 收集2015年1月至2016年12月本院血液科所有初治AML住院患者232例,AML的诊断标准参照WHO(2016)造血和淋巴组织肿瘤分类标准[2],除骨髓增生异常综合征转化型AML、治疗相关AML及其他类型非原发AML,最终选出144例资料完整的患者纳入本研究,其中男76例,女68例,依据“两类突变学说”的思路,把初治原发AML患者按GMN的不同分为GMN<2个和GMN≥2个,根据(美国)西南肿瘤协作组(SWOG)和(美国)东部肿瘤协作组(ECOG)制订的细胞遗传学预后分层标准,将患者分为预后良好组、预后中等组和预后不良组,其中预后不良组又分为复杂核型组和非复杂核型组,以及根据单体核型有无分为单体核型组和非单体核型组。本研究均获得患者知情同意,并经医院医学伦理委员会批准。
1.2方法
1.2.1细胞形态学检查 抽取骨髓液制涂片,快速干燥后进行瑞氏染色,根据需要进行特殊细胞化学染色,进行形态学分型。
1.2.2细胞遗传学检查 通过骨髓细胞直接法和(或)24 h培养法,按照常规制备染色体,正常核型至少要分析20个分裂象,异常核型至少要分析10个分裂象。核型异常描述依据《人类细胞遗传学国际命名体制(ISCN 2013)》[3]的规定进行。
1.2.3分子生物学检查 通过荧光定量PCR检测融合基因,采用一代和二代测序方法检测基因突变。

2 结 果
2.1一般临床特征分析 144例初治AML患者,男76例,女68例,中位年龄41.50岁,年龄四分位间距为25.25~53.75岁,GMN<2个105例(72.92%),GMN≥2个39例(27.08%),正常核型59例(40.97%),异常核型85例(59.03%)。不同年龄组间比较,差异有统计学意义(P<0.05);性别、既往病史和常见临床症状等一般资料比较,差异无统计意义(P>0.05),见表1。
2.2血细胞常规和骨髓细胞形态分析 骨髓中原始细胞,外周血白细胞(WBC)水平比较,差异有统计意义(P<0.05),红细胞(RBC)、血红蛋白(Hb)和血小板(PLT)水平比较,差异无统计意义(P>0.05),见表2。
2.3FAB分型分析 按FAB分型,纳入研究的144例患者可分为M1、M2a、M2b、M3、M4、M5和M6组,组间比较差异均无统计学意义(P>0.05),见表3。
2.4细胞遗传学分析 染色体核型按对预后影响进行分组,分为预后良好、预后中等和预后不良组,预后不良组按复杂核型的有无分组和按单体核型有无分组,组间比较差异均无统计学意义(P>0.05),见表4。

表1 GMN不同初治原发AML一般临床特征[n(%)]
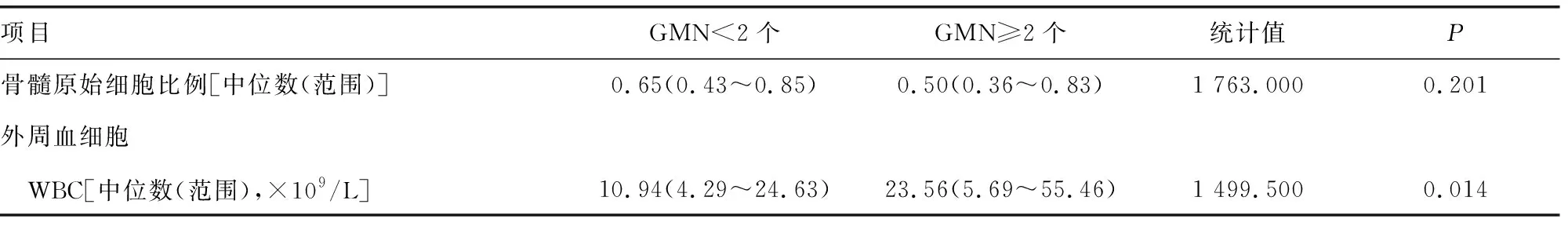
表2 GMN不同初治原发AML血细胞常规和骨髓细胞形态分析

续表2 GMN不同初治原发AML血细胞常规和骨髓细胞形态分析
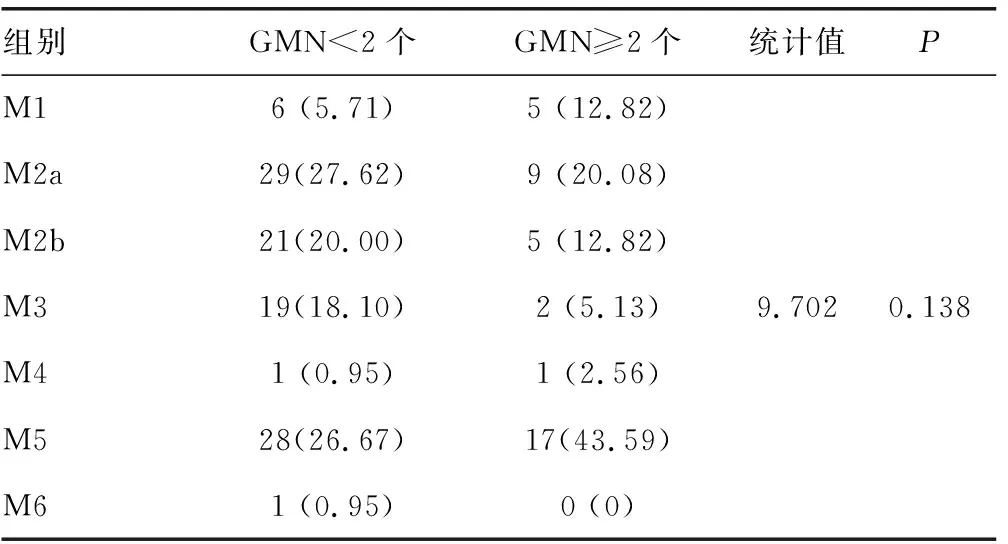
表3 GMN不同初治原发AML的FAB分型分析[n(%)]
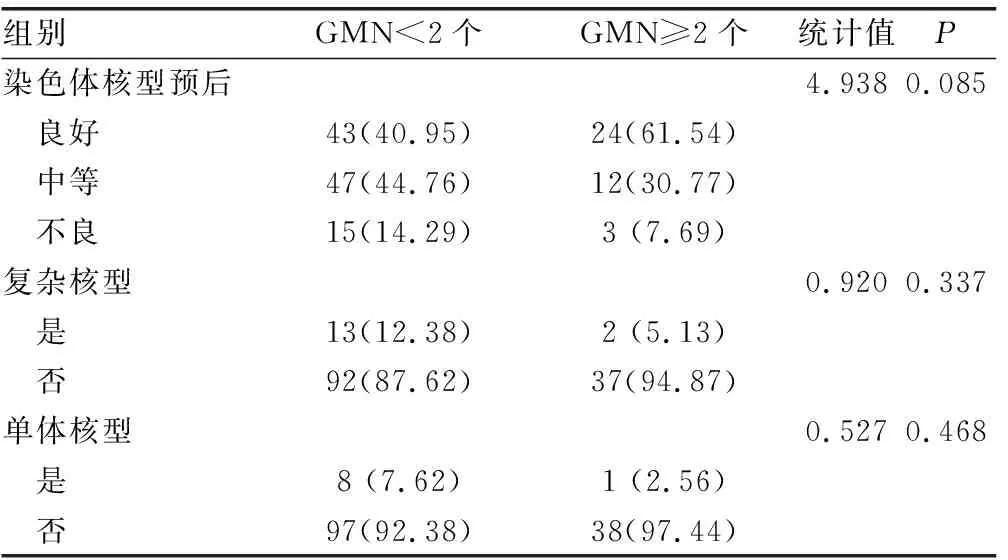
表4 GMN不同初治原发AML细胞遗传学分析[n(%)]
2.5融合基因分析 检测到的常见融合基因有AML-ETO、PML-RARA、CBFβ-MYH11和MLL-ELL,组间比较差异均无统计学意义(P>0.05),见表5。

表5 GMN不同初治原发AML融合基因分析[n(%)]
-:采用确切概率法
2.6基因突变分析 对入选患者进行基因突变检测,共检测到33种基因突变,其中11种组间比较差异均有统计学意义(P<0.05),其余22种基因突变组间比较差异均无统计学意义(P>0.05),见表6。
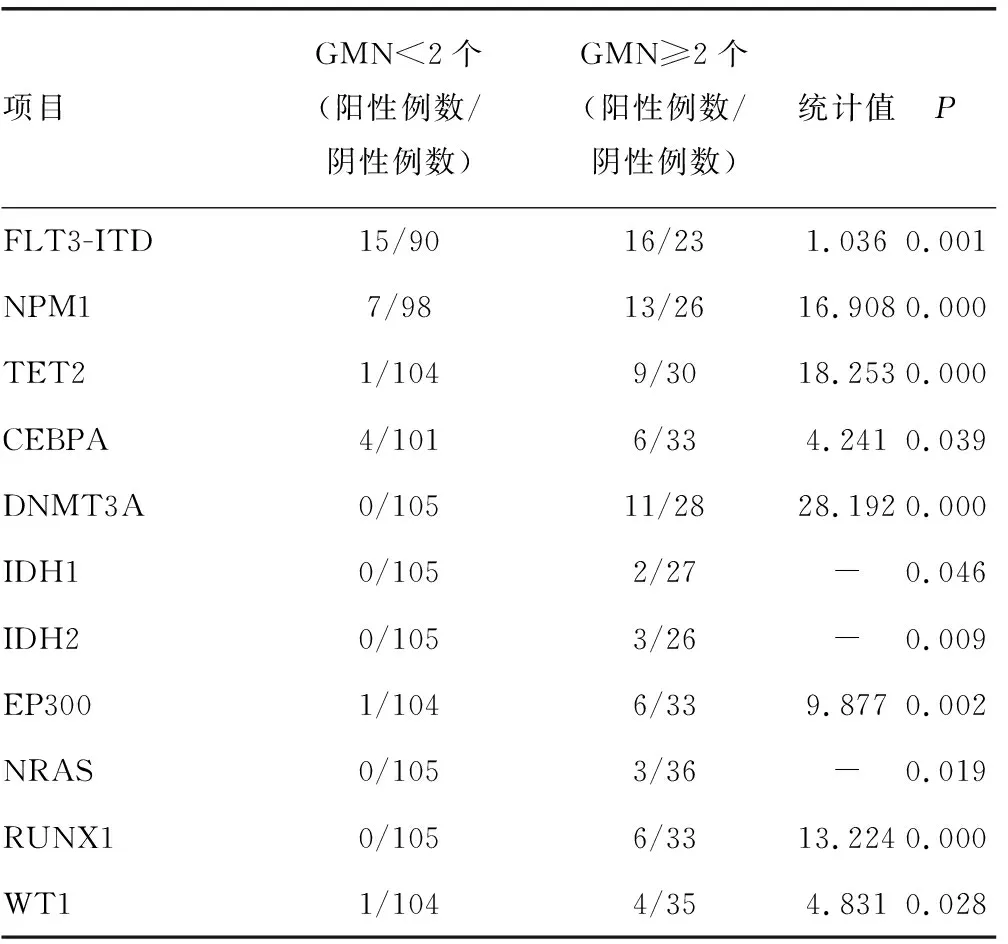
表6 GMN不同初治原发AML基因突变分析(n/n)
-:采用确切概率法
3 讨 论
到目前为止,已有大量关于AML相关突变基因的研究,但关于不同GMN对AML的研究少见。本研究把具有不同GMN的AML患者按GMN<2个和GMN≥2个分组,通过对其临床特征差异的对比分析,为AML的诊断分型、治疗选择、随访监测、预后估计及发病机制的探讨提供参考数据。
纳入本研究的144例初治原发AML患者,其中正常核型占40.97%,异常核型占59.03%,符合相关研究报道的正常核型的AML占40%~45%[4]。患者一般临床特点中,性别、既往病史和常见临床症状组间比较差异无统计学意义(P>0.05),而年龄比较差异有统计学意义(P<0.05)。从整体趋势可以看出,在GMN<2个中,AML患者所占比例由60岁以下的77.78% (91/117)降低至60岁以上的51.85% (14/27),而GMN≥2个中,AML患者所占比例由60岁以下的 22.22% (26/117)升高至60岁以上的48.15%(13/27)。可见,随着年龄增长,体细胞突变的概率有增大趋势,这可能是年龄越大,与外界致突变因素接触的机会越多所致。
对所有患者血细胞常规和骨髓细胞形态检查结果进行分析发现,骨髓中原始细胞,外周血中RBC、Hb和PLT水平组间比较,差异均无统计意义(P>0.05)。而GMN<2个外周血WBC低于GMN≥2个(P<0.05),这与本研究基因突变分析中的GMN≥2个中NPM1、FLT3-ITD、CEBPA和DNMT3A的突变明显高于GMN<2个患者的结果一致。有文献报道,NPMl基因突变阳性AML患者的临床表现多为初诊时外周血WBC升高[5],FLT3-ITD 突变后患者外周血WBC增高[6],CEBPA基因突变阳性患者往往表现为外周血WBC水平高的特点[7],DNMT3A与高白细胞、高血小板等检测指标密切相关[8]。
白血病中常见的基因突变按功能可以分为3类[9]:Ⅰ类是激酶通路信号转导分子突变,为细胞提供增殖优势;Ⅱ类是转录因子突变,导致细胞的分化和凋亡异常;Ⅲ类是表观遗传调控分子突变,可导致多种基因表达调控异常。本研究采用二代测序的方法对144例患者进行基因突变检测,共检测到33种基因突变,其中11种突变基因在GMN<2个患者中突变的比例明显高于GMN≥2个(P<0.05),根据以上的基因突变功能分类,这11种突变基因属于Ⅰ类的有FLT3-ITD和NRAS;Ⅱ类的有WT1、CEBPA、NPM1、RUNX1和EP300;Ⅲ类的有DNMT3A、IDH1、IDH2和TET2。
Ⅰ类是激酶通路信号转导分子突变,为细胞提供增殖优势。本研究GMN≥2个中共有16例发生了FLT3-ITD突变。NRAS基因突变在inv(16)/t(16;16)和inv(3)/t(3;3)的AML中多见[10],然而本研究GMN≥2个中有3例发生NRAS突变,但无1例有上述染色体异常,究其原因可能是病例收集的时间和地域跨度小,所以病例覆盖面较窄,导致NRAS突变基本特征没有呈现出来。
Ⅱ类是转录因子突变,导致细胞的分化和凋亡异常。NPM1突变蛋白能够通过多种分子机制来调控白血病细胞恶性表型,且已经被认定为AML中最常见的突变基因,本研究GMN≥2个中13例发生NPM1突变。NPM1突变是预后较好分子标志,但其经常伴有FLT3-ITD突变,这使NPM1突变阳性患者的预后降低。CEBPA在造血细胞分化过程中起重要的调控作用,过高表达可见于急性淋巴细胞白血病,而失活突变常见于AML,本研究GMN≥2个中有6例发生CEBPA突变。WT1在AML中发挥癌基因样作用,被认为是一种“泛白血病”基因标志,能够调控细胞的增殖和分化,在AML中表现尤其明显,WT1 过表达可在确诊的大多数AML患者中观察到[11]。本研究144例患者中,发生WT1突变5例(3.47%);仅1例为正常核型,与上述文献差异较大,分析其原因,可能是本研究病例数太少,或是种族和地域差异。本研究GMN≥2个中4例发生WT1突变,这与SOLARY等[12]研究结果一致。RUNX1突变可发生于编码区全长,突变类型可为基因缺失,也可为点突变或短片段的插入/缺失突变,RUNX1突变在多种血液肿瘤中都是预后不良的指标。本研究GMN≥2个中6例发生RUNX1突变,对于RUNX1基因,会想到AML-M2b,因RUNX1-RUNX1T1融合基因很常见。通过本研究分析发现RUNX1突变常合并的其他基因突变,可对AML的临床诊治有所帮助。在血液系统肿瘤中,EP300的失活突变,导致基因组整体乙酰化水平的降低,基因调控的异常,潜在地促进了肿瘤发生,也成为这类肿瘤患者一个治疗靶点。本研究纳入的144例患者,GMN≥2个中6例患者发生EP300突变,EP300突变易合并TET2和IDH2突变,而TET2和IDH2突变则导致基因高甲基化,乙酰化提高基因的空间位阻,使基因沉默,而甲基化则降低空间位阻,使基因活化,可见EP300突变与ET2和IDH2突变会加剧基因活化异常,从而导致AML的发生、发展。
Ⅲ类是表观遗传调控分子突变,可导致多种基因表达调控异常,本研究GMN≥2个中11例发生DNMT3A突变。DNMT3A和FLT3-ITD、NPM1突变在AML患者中多是共同出现的,且这3种突变分别属于不同功能的3类突变,这与AML发病的多重打击理论是一致的。TET2基因参与调控造血干细胞的增殖和分化[13],其表达水平还与血液肿瘤存在相关性。本研究GMN≥2个中9例发生TET2突变,而TET2突变导致的甲基化异常与EP300突变导致的乙酰化异常经常同时存在,这与本研究关于EP300突变的分析是一致的。IDH包括IDH1和IDH2,在本研究中2例IDH1突变和3例IDH2突变患者分别发现于不同个体,这与同类突变的互斥理论是一致的。
通过以上分析可发现,与伴有1种和不伴有突变基因初治原发AML患者相比,伴有多种基因突变的初治原发AML<60岁患者比例降低,≥60岁患者比例增高,且多伴有外周血高WBC,这些经常同时出现的突变基因为:Ⅰ类突变FLT3-ITD和NRAS,Ⅱ类突变WT1、CEBPA、NPM1、RUNX1和EP300,Ⅲ类突变DNMT3A、IDH1、IDH2和TET2,且导致乙酰化异常与甲基化异常的突变基因常常共存。
[1]MARCUCCI G,HAFERLACH T,DÖHNER H.Molecular genetics of adult acute myeloid leukemia:prognostic and therapeutic implications[J].J Clin Oncol,2011,29(5):475-486.
[2]ARBER D A,ORAZI A,HASSERJIAN R,et al.The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J].Blood,2016,127(20):2391-2405.
[3]SHAFFER L G,MCGOWAN-JORDAN J,SCHMID M.ISCN(2013):an international system 9 for human cytogenetic nomenclature[M].Basel,Switzerland:Karger,2013:16-31.
[4]苏龙,李薇,崔久巍,等.正常核型急性髓系白血病NPM1、FLT3-ITD突变与外周血白细胞数及骨髓原始细胞百分比相关性研究[J].中国实验血液学杂志,2013,21(3):571-575.
[5]DUFOUR A,SCHNEIDER F,HOSTER E,et al.Monoallelic CEBPA mutations in normal karyotype acute myeloid leukemia:independent favorable prognostic factor within NPM1 mutated patients[J].Ann Hematol,2012,91(7):1051-1063.
[6]HOU H A,KUO Y Y,LIU C Y,et al.DNMT3A mutations in acute myeloid leukemia:stability during disease evolution and clinical implications[J].Blood,2012,119(2):559-568.
[7]NAOE T,KIYOI H.Gene mutations of acute myeloid leukemia in the genome era[J].Int J Hematol,2013,97(2):165-174.
[8]叶丽,纪濛濛,孙自敏.急性髓系白血病FLT3基因突变的研究[J].中国实验血液学杂志,2015,23(2):322-327.
[9]CHAUHAN P S,IHSAN R,SINGH L C,et al.Mutation of NPM1 and FLT3 genes in acute myeloid leukemia and their association with clinical and immunophenotypic features[J].Dis Markers,2013,35(5):581-588.
[10]FRÖHLING S,SCHLENK R F,STOLZE I,et al.CEBPA mutations in younger adults with acute myeloid leukemia and normal cytogenetics:prognostic relevance and analysis of cooperating mutations[J].J Clin Oncol,2004,22(4):624-633.
[11]SCATTONE A,SERIO G,MARZULLO A,et al.High Wilms′ tumour gene (WT1) expression and low mitotic count are independent predictors of survival in diffuse peritoneal mesothelioma[J].Histopathology,2012,60(3):472-481.
[12]SOLARY E,BERNARD O A,TEFFERI A,et al.The ten-eleven translocation-2 (TET2) gene in hematopoiesis and hematopoietic diseases[J].Leukemia,2014,28(3):485.
[13]商臻,王迪,肖敏,等.205例急性髓系白血病患者IDH1基因突变的检测及其临床意义分析[J].中国实验血液学杂志,2012,20(6):1307-1311.
