α-硫辛酸对高盐诱导的大鼠高血压反应过程的抑制作用*
2018-06-07刘东亮朱蜀侠
胥 艳,袁 丹,刘东亮,王 宇,朱蜀侠,苟 伟
(1.四川省成都市363医院泌尿外科 610000;2.西南医科大学附属医院神经内科,四川泸州 646000)
高盐摄入作为一个重要的环境因素,在高血压的发生、发展中起着重要的作用[1]。据报道,活性氧(reactive oxygen species,ROS)在头端延髓腹外侧区(rostral ventrolateral medulla,RVLM)中的过量产生与高盐诱发的高血压的发生明显相关[2]。相关研究显示,它可在体内代谢产生抑制ROS的抗氧化物质[3-4]。最新研究提示,α硫辛酸能够降低血压,并通过抵制过氧化物损伤而保护机体减轻心血管疾病所带来的危害[5]。因此,本研究旨在探讨补充α硫辛酸能否抑制RVLM中的ROS的产生从而对高盐诱导的高血压产生抑制作用。
1 材料与方法
1.1材料来源 成年雄性大鼠,清洁级,120~150 g,由南京模型动物研究所提供。
1.2试剂与仪器 胎牛血清购自美国Santa Cruz公司;还原型烟酰胺腺嘌呤二核苷酸磷酸[NAD(P)H]氧化酶2(NOX2)、NOX4、铜/锌超氧化物歧化酶(Cu/Zn-SOD)及β-actin多克隆抗体购自美国Santa Cruz公司;鼠二抗购自美国Abacm公司;α硫辛酸(规格300 mg∶12 mL) 购自武汉天翼有限公司;电化学发光试剂盒购自美国Abcam公司。
1.3大鼠高血压模型的建立和实验分组[6]将雄性大鼠32只随机分配到两组:两组分别给予正常盐饮食(0.3% NaCl)8周(n=16)和高盐饮食8周(8% NaCl)(诱导高血压模型)(n=16)。之后将正常盐饮食大鼠及高盐饮食大鼠各自再分别分为两组,每两组分别给予溶于0.9%生理盐水的α硫辛酸 (60 mg/kg)或单独给予生理盐水灌胃饲养9周。由此共4组,即:实验组(n=8,高血压模型样本喂养α硫辛酸)、模型组(n=8,高血压模型样本喂养生理盐水)、对照组(n=8,正常盐饮食样本喂养α硫辛酸)和空白对照组(n=8,正常盐饮食样本喂养生理盐水)。
1.4方法
1.4.1血压监测 所有大鼠动脉压通过尾套仪器测量及系统记录。血压测量从实验第7周开始,每天测量3次。取平均值,直至实验结束。
1.4.2实验标本制作 将氯胺酮(90 mg/kg)和甲苯噻嗪(10 mg/kg)混合麻醉大鼠。取标本。用Palkovits′s显微解剖技术收集RVLM组织[7]。-80 ℃冻存。
1.4.3NOX2、NOX4及Cu/Zn-SOD的测定 大鼠面颌神经核尾端周围 500~700 μm的区域被确认为 RVLM。解剖大鼠获得标本后切片装载固定,-80 ℃储存。免疫组织化学和免疫荧光标记在流动截面上进行,一抗分别为NOX2 (sc-20782,Santa Cruz,1∶200)、NOX4 (sc-5827,Santa Cruz,1∶200)及(Cu/Zn-SOD,sc-11407,Santa Cruz,1∶200)。用来做免疫组织化学的脑组织用羊抗兔二抗(HistostainTM-Plus IHC Kit,SP-9001,Zsgb-Bio,China)孵育。用二氨基联苯胺(3,3-diaminobenzidine,DAB) 试剂盒(AR 1002,Boster,China)染色。一抗NOX2(sc-20782,Santa Cruz,1∶400)、NOX4 (sc-5827,Santa Cruz,1∶400)及Cu/Zn-SOD(sc-11407,Santa Cruz,1∶200)。
1.4.4ELISA测定丙二醛(MDA)、超氧化物歧化酶(SOD)及谷胱甘肽(GSH) 用ELISA试剂盒(Invitrogen Corporation,CA,USA)对上述指标进行定量检测。
1.4.5高效液相色谱法检测血清去甲肾上腺素(NE)水平 用高效液相色谱法检测血清NE水平。全心质量/体质量(whole heart weight/body weight,WHW/BW),全心质量/胫骨长度(whole heart weight/tibia length,WHW/TL)及左心室重量/胫骨长度(left-ventricular weight/tibia length,LVW/TL)作为心肌肥厚的指标被检测。

2 结 果
2.1给药后各组平均动脉压(MAP)的变化 给药后第8周,模型组平均动脉压为(162.4±11.3)mm Hg、空白对照组为(106.2±10.1)mm Hg,差异有统计学意义(P<0.05)。对照组平均动脉压为(129.1±8.9)、实验组为(159.4±9.2)mm Hg,差异有统计学意义(P<0.05)。见图1。
2.2免疫荧光显示给药后RVLM中NOX2、NOX4阳性神经元的表达情况 免疫荧光结果显示,模型组较空白对照组中表达NOX2和NOX4的阳性神经元要高。给药后9周,实验组和模型组RVLM中表达NOX2 和NOX4的阳性神经实验组较模型组中表达NOX2和NOX4的阳性神经元要低,见图2。

*:P<0.05,与对照组比较;#:P<0.05,与模型组比较
图1各组MAP的变化
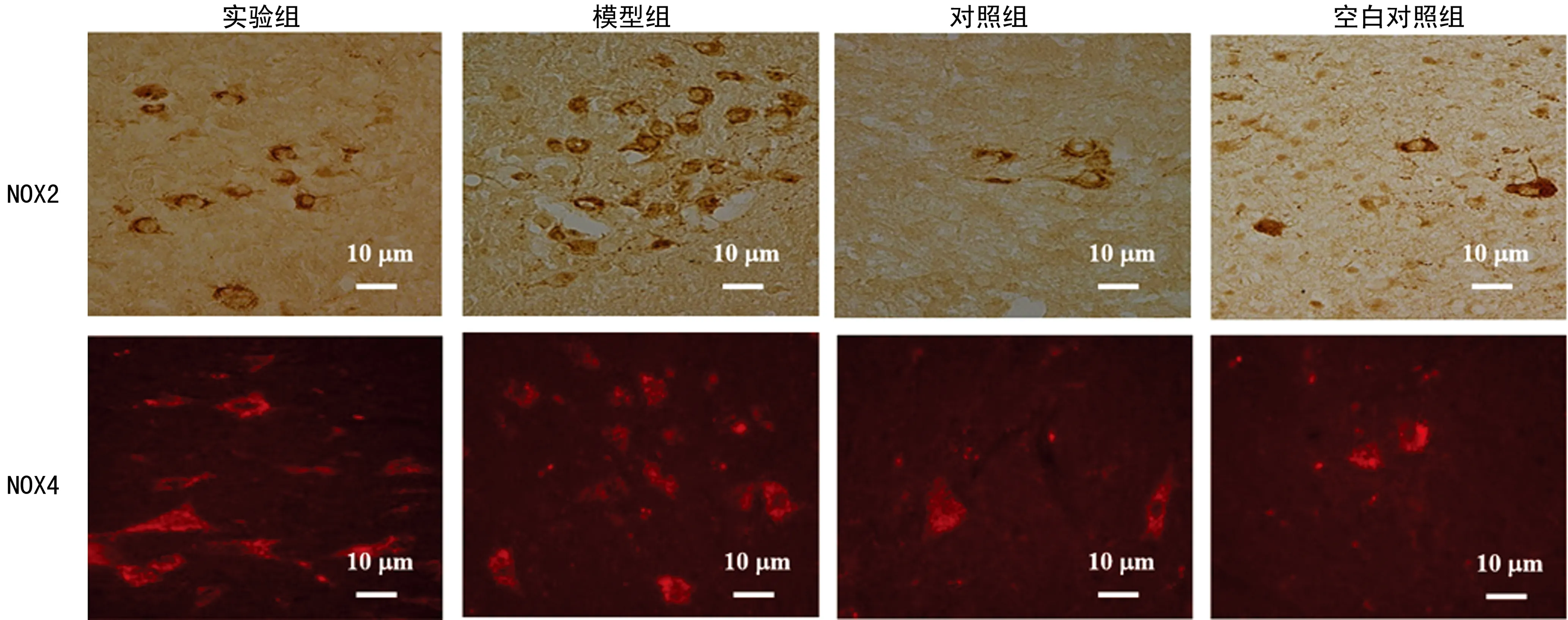
图2 免疫荧光显示给药后RVLM中NOX2、NOX4阳性神经元的表达情况(×40)
2.3模型建立后和给药后9周各组RVLM中二氢乙啶(DHE)荧光强度和Cu/Zn-SOD阳性神经元的表达情况 模型建立后,免疫荧光结果显示模型组和空白对照组RVLM中Cu/Zn-SOD的阳性神经元数量分别为(9.2±2.1)、(32.4±4.6)个,空白对照组明显高于模型组(P<0.05),二氢乙啶(DHE)荧光强度别为86.5±3.4和 22.3±1.7,模型组明显高于空白对照组(P<0.05);给药后,实验组与模型组RVLM中Cu/Zn-SOD水平分别为19.7±1.6、10.3±1.2,差异均有统计学意义(P<0.05);实验组和模型组二氢乙啶(DHE)荧光强度分别为63.4±2.9和101.3±4.1,实验组明显低于模型组(P<0.05)。
2.4模型建立后及给药后9周各组RVLM中NOX2、NOX4表达情况 模型建立后,Western blot结果显示,模型组和空白对照组RVLM中NOX2 和NOX4 蛋白表达(OD值)分别为模型组NOX2:103.6±4.1,NOX4:114.5±3.2;空白对照组NOX2:24.6±1.9,NOX4:32.1±3.0,模型组和空白对照组表达差异有统计学意义(P<0.05);给药后9周, 实验组和模型组NOX2 和NOX4蛋白表达分别为实验组NOX2:80.2±1.7,NOX4:65.1±2.4;模型组NOX2:112.7±3.8,NOX4:99.4±1.7,实验组明显低于模型组(P<0.05) 。
2.5模型建立后及给药后9周各组RVLM线粒体中MDA、SOD及GSH表达情况 模型建立后,用ELISA检测模型组和空白对照组RVLM线粒体中 MDA水平分别为(10.2±2.9)、(5.1±2.0)μmol/g,空白对照组明显低于模型组(P<0.05)。模型组和空白对照组RVLM线粒体中GSH和SOD水平分别为GSH:(2.1±0.3)、(5.7±1.2)μmol/g, SOD:(17.4±1.6)、(32.3±2.5)U/mg,模型组明显低于空白对照组(P<0.05)。给药后9周,实验组和模型组MDA分别为(5.4±1.2)、(9.8±3.2)μmol/g,实验组明显低于模型组(P<0.05);实验组和模型组RVLM线粒体中SOD水平分别为(35.2±3.1)、(16.2±1.3)U/mg,实验组较模型组明显增高(P<0.05),实验组和模型组GSH水平分别为(5.6±0.4)、(2.0±0.4)μmol/g,实验组较模型组明显增高(P<0.05)。
2.6模型建立后和给药后9周各组心肌肥厚相关指标和血清去甲肾上腺素(NE)水平的变化 模型建立后,模型组WHW/BW、WHW/TL及LVW/TL分别为4.6±0.7、46.9±0.3、31.6±2.4,空白对照组WHW/BW、WHW/TL及LVW/TL分别为2.0±0.5、31.4±0.1、18.2±1.1,模型组明显高于空白对照组(P<0.05);给药9周后,实验组WHW/BW、WHW/TL及LVW/TL分别为3.0±0.5、35.7±0.6、21.3±2.1,模型组WHW/BW、WHW/TL及LVW/TL分别为4.6±0.7、46.9±0.3、31.6±2.4,实验组明显低于模型组(P<0.05)。模型建立后,用高效液相色谱法检测模型组和空白对照组血清NE水平分别为(465.9±7.2)、(301.5±3.6)pg/mL,模型组明显高于空白对照组(P<0.05);给药9周后,实验组和模型组血清NE水平分别为(332.8±6.5)、(512.3±7.9)pg/mL,实验组明显低于模型组(P<0.05)。
3 讨 论
本研究结果显示,补充α硫辛酸9 周可通过降低MAP 和代表交感神经系统活性的血清NE水平从而显著缓解高盐诱导的高血压反应。此外,补充α硫辛酸还可降低RVLM中NOX2和NOX4的表达,减少线粒体 RVLM中 ROS 的过量产生,而且高盐诱导高血压大鼠WHW/BW、WHW/TL和LVW/TL比值的增加提示其可以提高抗氧化能力、延缓心肌肥厚。因此,本研究观点可归纳为长期给予α硫辛酸可通过降低NOX2和 NOX4的表达、增强线粒体的生物能量、提高高血压发展中的RVLM中细胞内抗氧化能力从而降低高盐诱导的高血压大鼠的MAP、交感神经活性及机体氧化应激损伤。
众所周知,高盐饮食可上调大脑区域如海马和大脑皮层的氧化应激,在高血压的病理机制中发挥重要作用[7-8]。RVLM 可决定心血管中心交感神经基本功能,且与交感神经系统活性密切相关[9]。本研究亦证实高盐饮食可增加RVLM中超氧化物的产生进而激活交感神经系统,与前期研究结果一致[10-11]。
α硫辛酸被公认为强效生物抗氧化物及线粒体生物能量酶的必要辅助因子,可恢复细胞内还原型谷光甘肽(GSH)的表达[12-13],亦是抗氧化物中惟一一个脂水兼容的物质。因此,α硫辛酸可进入大脑底部清除自由基、修复 ROS 的过度损伤。本研究结果显示长期补充α硫辛酸可降低高盐诱导的大鼠模型中的MAP、延缓心肌肥厚的产生、降低NOX2和NOX4的表达及RVLM线粒体中过氧化物。因此笔者推测,补充α硫辛酸通过下调NOX2和NOX4的表达从而降低RVLM中的氧化应激、增强线粒体的生物能量、提高RVLM在细胞内的抗氧化能力,最终降低血压和高盐诱导高血压产生的心肌肥厚 。
综上所述,长期高盐饮食可增加高血压的风险并诱导NAD(P)H和RVLM内线粒体中的ROS过量产生,在高血压的发生、发展中起到了重要作用;长期α硫辛酸补充可通过多种途径缓解高血压反应和延缓心肌肥厚产生。
[1]WU K L,CHAN S H,CHAN J Y.Neuroinflammation and oxidative stress in rostral ventrolateral medulla contribute to neurogenic hypertension induced by systemic inflammation[J].J Neuroinflammation,2012,9(1):212.
[2]OGAWA K,HIROOKA Y,SHINOHARA K,et al.Inhibition of oxidative stress in rostral ventrolateral medulla improves impaired baroreflex sensitivity in stroke-prone spontaneously hypertensive rats[J].Int Heart J,2012,53(3):193-198.
[3]谭颖颖,王亚运,张琪.电针“曲池”穴对中枢血管紧张素Ⅱ诱发的动脉血压升高大鼠异常交感神经活性的影响[J].针刺研究,2016,41(2):144-149.
[4]赵冉冉,徐晓臣,徐飞,等.天然抗氧化剂α-硫辛酸对血管性痴呆大鼠线粒体的保护作用[J].山西医科大学学报,2014,45(12):1136-1139.
[5]SU Q,LIU J J,CUI W,et al.Alpha lipoic acid supplementation attenuates reactive Oxygen species in hypothalamic paraventricular nucleus and sympathoexcitation in high salt-induced hypertension[J].Toxicol Lett,2016,241(241):152-158.
[6]刘美丽,宋海旭,邵晓平,等.趋化因子配体16在高盐诱导的盐敏感性高血压大鼠心肌重构中的作用[J].解放军医学杂志,2015,40(11):873-879.
[7]HE F J,CAMPBELL N R,MACGREGOR G A.Reducing salt intake to prevent hypertension and cardiovascular disease[J].Rev Panam Salud Publica,2012,32(4):293-300.
[8]PARK J,CHANG K K.Sodium intake and prevalence of hypertension,coronary heart disease,and stroke in Korean adults[J].J Ethnic Foods,2015,2(3):92-96.
[9]王英,郭曲练,鄢建勤,等.DNA甲基转移酶类在大鼠神经病理性疼痛发病机制中的作用[J].中南大学学报(医学版),2016,41(6):578-585.
[10]WU K L,HUNG C Y,CHAN J Y,et al.An increase in adenosine-5′-triphosphate (ATP) content in rostral ventrolateral medulla is engaged in the high fructose diet-induced hypertension[J].J Biomed Sci,2014,21(1):8.
[11]GUDJONCIK A,GUENANCIA C,ZELLER M,et al.Iron,oxidative stress,and redox signaling in the cardiovascular system[J].Mol Nutr Food Res,2014,58(8):1721-1738.
[12]吴敏,袁刚,管晓峰,等.α-硫辛酸治疗糖尿病周围神经病变的疗效观察[J].中华全科医学,2011,9(4):517-519.
[13]张晶晶,邓后亮,季爱民.α-硫辛酸预处理对人脐静脉内皮细胞缺氧复氧损伤的保护作用[J].实用医学杂志,2014,30(7):1053-1056.
