LEPR及LEP基因表达量对FecB不同基因型小尾寒羊产羔数的影响
2018-06-07于嘉瑞王翔宇郭晓飞贺小云文禹粱刘秋月胡文萍张效生张金龙储明星
于嘉瑞,王翔宇,郭晓飞,贺小云,孙 庆,文禹粱,狄 冉,刘秋月,胡文萍,张效生,张金龙,孙 伟*,储明星*
(1.扬州大学动物科学与技术学院,扬州 225009;2.中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193;3.甘肃农业大学动物科学技术学院,兰州 730070;4.天津市畜牧兽医研究所,天津 300381)
中国除小尾寒羊和湖羊等少数绵羊品种产多羔外,其余绝大部分绵羊品种均产单羔,这极大地制约了养羊业的发展。绵羊产羔数是由多个基因控制的复杂性状,且遗传力较低,通过传统表型选择很难获得较大遗传进展。因此,对影响绵羊产羔数相关基因进行研究,对于提高绵羊繁殖效率、加快绵羊育种进程、提高绵羊产业的经济效益均非常重要。FecB基因是最早定位的控制绵羊产羔数的主效基因。20世纪80年代初期, G.H.Davis等[1]和L.R.Piper等[2]在对Booroola羊高繁殖力研究时发现,一个常染色体的突变位点显著影响绵羊排卵数。1989年,该突变基因被绵、山羊遗传命名委员会正式命名为FecB基因。2001年,3个研究团队发现绵羊FecB的影响是由于骨形态发生蛋白受体1B(Bone morphogenetic protein receptor-IB,BMPR1B)基因编码区发生了A746G突变,从而引起第249位氨基酸由谷氨酰胺变为精氨酸(Q249R)。FecB基因存在3种基因型,其中BB型羊产羔数>B+型>++型,BB型为突变型,++型为野生型[3-5]。随着对产羔性状研究的逐渐深入,多个控制绵羊产羔数的主效基因被陆续发现。GDF9、BMP15等TGFB超家族通路中的基因也是增加绵羊产羔数的主效基因[6]。对罗姆尼羊Davisdale品系的研究中发现,LEPR突变除了可以提早该品系羊的初情期,还影响绵羊的排卵数[7-9],然而LEPR基因不是TGFB超家族通路中的成员。因此,该基因对排卵数的调控方式可能与以上影响排卵数的主效基因调控方式不同。
A.M.Ingalls等[10]通过研究一种近交繁殖的小鼠,发现其中一个基因的隐性突变可导致小鼠的肥胖,于是将该基因定名为肥胖基因(Obese,ob)。G.C.Kennedy[11]发现脂肪组织分泌某种调节体重的激素,称为“饱感因子”。它能通过下丘脑调控中枢,调节机体摄食及能量消耗,保持体重相对平衡。直到1994年,Y.Y.Zhang 等[12]利用基因定位克隆技术成功克隆小鼠的ob基因,将其编码蛋白定名为瘦素(Leptin),之后就将ob基因表示为LEP。在20世纪90年代末期,K.P.Hummel 等[13]发现,在患有糖尿病的近交系小鼠中,鉴定了另外一个隐性肥胖突变基因(Diabetes,db),表型与(ob/ob)小鼠相似。随后,L.A.Tartaglia 等[14]证明,db基因是LEP的受体,并从小鼠脉络丛中成功克隆LEPR。
在哺乳动物中,LEPR和LEP协同作用的leptin信号通路是维持机体能量平衡的关键因素。LEP作用于下丘脑的LEPR,提高交感神经的活性,使去甲肾上腺素的释放增加,进而激活脂肪细胞膜上的β-3受体,使脂肪细胞内解偶联蛋白的表达增加,于是能量转化成热能而释放[15]。瘦素促进能量消耗的作用是通过提高促甲状腺素的分泌而实现的[16]。
LEPR以及LEP影响机体神经内分泌功能,促进生殖系统功能和获得并维持生殖能力[17]。在动物机体中,促性腺激素释放激素(Gonadotropin-releasing hormone, GnRH)由下丘脑分泌,刺激或抑制垂体促性腺激素的分泌。尽管在下丘脑促性腺激素释放激素神经元尚未发现有LEPR表达,但是LEP可能通过通路刺激大鼠和猪的下丘脑进而释放GnRH[18]。缺少功能性瘦素受体以及瘦素基因的小鼠不育并且发现生殖器官萎缩,经过体外注射瘦素治疗,从而刺激GnRH,进一步刺激促卵泡素(FSH)、促黄体生成素(LH)和雌激素的释放,不仅能够恢复小鼠的生殖系统,还能促进萎缩的生殖器得到生长[19-21]。
瘦素及瘦素受体对卵泡发育及卵母细胞成熟有重要作用。在小鼠中,LEPR和LEP中任何一个基因的突变都可能造成leptin信号通路的失活,出现繁殖性能的下降,瘦素受体突变的小鼠卵巢在繁殖周期没有成熟卵泡产生[22]。在小鼠的卵泡细胞和卵母细胞中均有瘦素受体的表达,且从初级卵泡~成熟卵泡这一生理过程中,LEPR的表达量呈现上升的趋势,说明瘦素受体可能在卵泡发育过程中起到了较为重要的作用[23]。经过瘦素受体及瘦素处理的雌性大鼠,其卵巢功能的活性增强,伴随着大量卵泡发育[24]。
绵羊产羔数是一个复杂性状,在同一品种的高产绵羊中,可能会存在多个主效基因同时控制产羔数[25]。法国的Lacaune绵羊中有两个主效基因BMP15和FecL同时控制产羔数[26]。小尾寒羊是中国著名的高繁殖力绵羊品种,FecB突变等位基因B在小尾寒羊中频率较高,且与小尾寒羊的高产羔数相关联[27]。小尾寒羊产羔数可能也受到除了FecB外其它基因的影响。本研究选取FecB野生型纯合子和突变型纯合子的小尾寒羊为研究对象,分别采集卵泡期的不同组织以及卵泡期和黄体期的下丘脑、垂体、卵巢3个性腺轴组织,采用实时荧光定量PCR方法检测LEPR和LEP在各组织中以及不同时期性腺轴的表达特征,初步分析FecB突变后LEPR和LEP对小尾寒羊排卵数的影响,为进一步揭示小尾寒羊多羔的分子机理奠定基础。
1 材料与方法
1.1 样品采集
选择山东省郓城县2~3岁健康小尾寒羊母羊21只,统计其当年的产羔数数据。然后在天津市畜牧兽医研究所种羊场饲养,采用TaqMan法进行多羔主效基因FecB分型,其中BB型12只、++型9只。由于需要获得小尾寒羊发情期的排卵数据,并采集黄体期和卵泡期多个组织样品,所以对试验羊进行两次同期发情。第1次同期发情时,对空怀小尾寒羊放置阴道孕酮栓(CIDR),同时注5 mL维生素AD用以保护小尾寒羊母羊阴道内膜。12 d后撤栓,撤栓当天记1 d,撤栓时刻记为0 h。撤栓后第7天使用腹腔镜观察排卵情况,并记录排卵数。间隔14 d后,对羊群进行第2次同期发情,试验方法与第1次同期发情相同,并在撤栓后45 h(卵泡期)和10 d(黄体期)屠宰,每组各3只(n=3)。屠宰后,立即取心、肝、脾、肺、肾、肾上腺、输卵管、子宫体、垂体、下丘脑、卵巢11个组织样品,用冻存管保存后迅速投入液氮速冻,带回实验室,-80 ℃保存备用。
1.2 组织总RNA的提取和检测及cDNA第一链的合成
采用Trizol(Invitrogen,USA)和动物组织总RNA提取试剂盒(天根,北京)提取各组织总RNA,并用Nanodrop2000微量分光光度计(Nano Drop Technologies,USA)检测提取RNA浓度,用1.5%的琼脂糖凝胶电泳,利用凝胶成像系统(ChemiDocTMXRS+,BIO-RAD,USA)检测RNA完整性。
利用反转录试剂盒(PrimeScriptTMRT Reagent Kit,TaKaRa,Japan)反转录合成cDNA,反转录体系为20 μL:PrimeScript RT Enzyme Mix 1.0 μL,Oligo dT Primer 1.0 μL,Random 6 mers 1.0 μL,5×PrimeScript Buffer (for Real Time) 4.0 μL,RNA 1.0 μL,再用RNase-Free ddH2O将总体积补至20 μL。反应条件:37 ℃ 15 min,85 ℃ 5 s,获得cDNA第一链。全程操作在冰上进行。将反转录产物进行5倍稀释,用持家基因ACTB进行PCR检测。将符合标准的cDNA置于-20 ℃保存,以用于检测目的基因的表达。
1.3 荧光定量引物设计及目的基因表达量检测
根据绵羊LEPR基因mRNA序列(GenBank登录号:NM_001009763.1)信息,用Primer3.0在线软件(http://bioinfo.ut.ee/primer3-0.4.0/)设计引物,以核糖体蛋白L19基因(Ribosomal protein L19,RPL19)(其mRNA序列GenBank登录号:XM_004012836.2)作为内参基因;对于绵羊LEP基因(GenBank登录号:XM_004008038.3),由于其只有3个外显子,并且3个外显子之间的距离较长,因此未能成功设计出用于SYBR Green定量PCR跨外显子引物,且不进行其表达量与LEPR基因比较,所以LEP基因用了TaqMan探针法进行相对定量。利用TaqMan探针法并由泰兴市宏润吉康生物科技研究所合成TaqMan探针,配合此方法以绵羊肌动蛋白β基因(Actin beta,ACTB)(其mRNA序列GenBank登录号:NM_001009784)作为内参基因。引物序列和产物大小以及用途见表1。LEPR采用SYBR Green染色法,严格按照TaKaRa荧光定量染料(SYBR®Premix ExTaqTMⅡ,TaKaRa,Japan)使用说明进行操作;LEP采用TaqMan探针法,按照Roche(LightCycler®480 Probes Master,Roche,USA)试剂使用说明书进行试验。LEPR及LEP按照Roche LightCycler®480II荧光定量PCR仪使用说明书(Roche Light Cycler®480 II real-time PCR system,Roche,USA)进行荧光定量分析。

表1 绵羊4个基因的引物序列和产物大小Table 1 Primer sequence and product size of ovine 4 genes
1.3.1 TaqMan探针法 反应体系为20 μL,其中LightCycler®480 Probes Master 10 μL,上下游引物各0.8 μL,MGB探针0.5 μL,cDNA 模板浓度200 ng·μL-12.0 μL,ddH2O 5.9 μL。反应程序:95 ℃预变性10 min;95 ℃变性10 s、60 ℃退火10 s,40个循环;熔解曲线获取10 min,降温结束。
1.3.2 SYBR Green法 反应体系为20 μL,其中SYBR Premix Ex TaqⅡ 10 μL,上下游引物各0.8 μL,cDNA 模板浓度200 ng·μL-12.0 μL,ddH2O 6.4 μL。PCR程序:95 ℃预变性5 s;95 ℃变性5 s,60 ℃ 30 s,40个循环;熔解曲线获取10 min,降温结束。
1.4 数据分析
数据用“平均数±标准误”表示。对产羔数和排卵数进行不同基因型间t检验。对基因的表达量数据采用Excel(Microsoft Excel,USA)进行分析,利用2-ΔΔCt法计算基因相对表达量[28],使用SPSS Statistics 24(IBM,USA)软件按照下述模型进行分析。
yij=μ+Gi+Tj+eij
其中,y为表达量;μ为平均数;G为基因型(BB型、++型)效应,i=1,2;T为卵巢的不同时期(卵泡期、黄体期)效应,j=1,2;e为随机残差效应。
2 结 果
2.1 不同FecB基因型小尾寒羊的排卵数和产羔数
对21只小尾寒羊进行同期发情,利用腹腔镜观察黄体,获得不同FecB基因型小尾寒羊的排卵数,如表2所示。对++型9只小尾寒羊、BB型12只小尾寒羊的排卵数和产羔数进行t检验,发现BB型小尾寒羊的排卵数(P=0.003 5)和产羔数(P=0.004 0)均极显著高于++型。
表2不同FecB基因型小尾寒羊排卵数和产羔数
Table2OvulationnumberandlittersizeofSmallTailHaneweswithdifferentFecBgenotypes
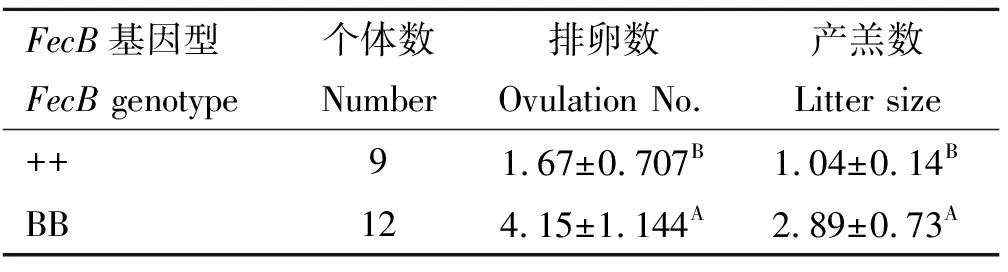
FecB基因型FecB genotype个体数Number排卵数Ovulation No.产羔数Litter size++91.67±0.707B1.04±0.14BBB124.15±1.144A2.89±0.73A
同列上标不同大写字母表示组间差异极显著(P<0.01),字母相同或未标注字母表示差异不显著(P>0.05)。下同
Different superscripts capital letters in the same column mean highly significant difference between groups (P<0.01) the same letter or without letter mean no significant difference between groups(P>0.05).The same as below
2.2 实时定量PCR的熔解曲线以及标准曲线
本研究以RPL19和ACTB为内参基因,LEPR和LEP为目的基因,各样品的模板在反应后可获得LEPR、LEP、RPL19、ACTB的标准曲线(图略),适用于2-ΔΔCt法计算,并得到单峰,且峰型锐利的熔解曲线(图略),说明引物特异性良好,符合荧光定量PCR数据分析的要求。
2.3 LEPR和LEP基因在卵泡期BB型小尾寒羊不同组织之间的表达模式
采用实时定量PCR检测了LEPR和LEP在BB型小尾寒羊卵泡期各个组织中的表达量,对两个基因在不同组织中表达量分布只进行了定性描述,而未进行显著性检验,结果如图1所示。LEPR在BB型小尾寒羊各个组织中均有表达,其中在下丘脑、心、肝中表达量较低,在卵巢、子宫体中表达量较高。LEP在小尾寒羊各个组织中也均有表达,其中在心、脾、肺、输卵管、肾上腺中表达量较低,在下丘脑、垂体、卵巢性腺轴中表达量较高。
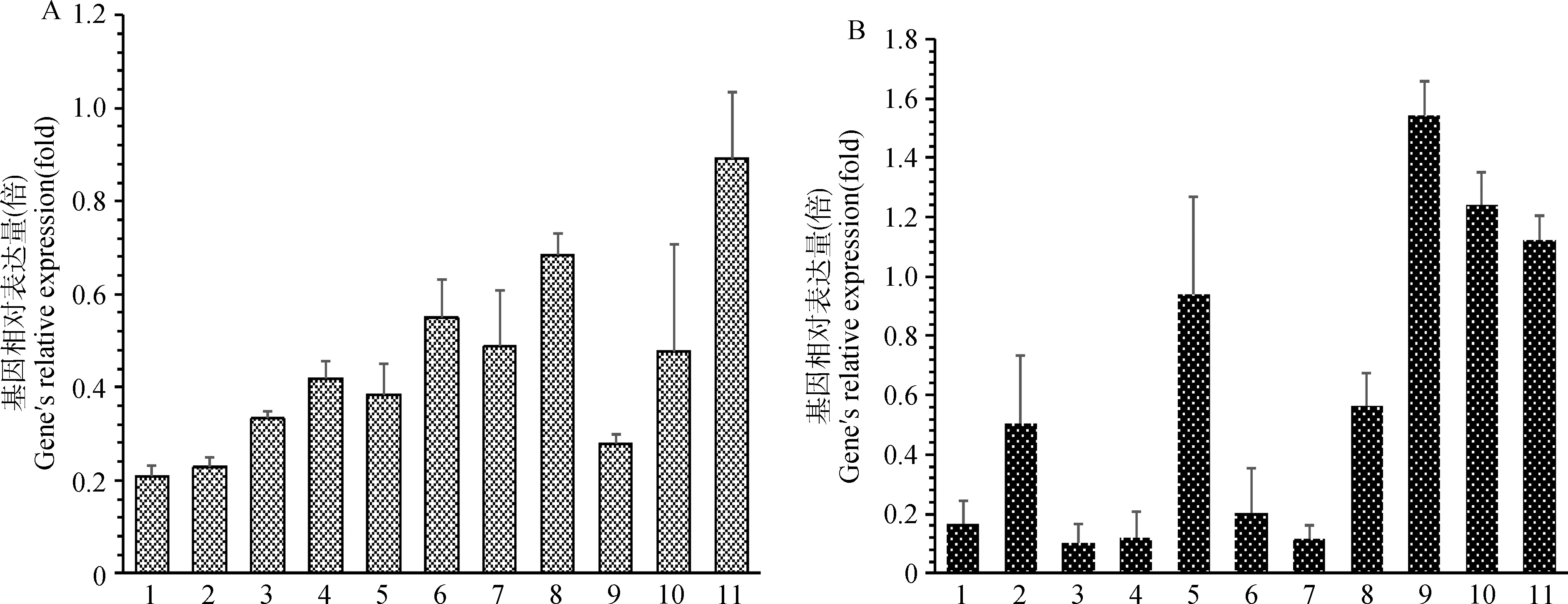
1~11.心、肝、脾、肺、肾、肾上腺、输卵管、子宫体、下丘脑、垂体和卵巢1-11.Heart,liver,spleen,lung,kidney,adrenal gland,fallopian tube,uterus,hypothalamus,pituitary and ovary图1 LEPR(A)和LEP(B)在BB型小尾寒羊卵泡期各个组织中的表达Fig.1 Relative expression of LEPR(A) and LEP(B)genes in various tissues of Small Tail Han sheep with BB genotype in follicular phase
2.4 LEPR和LEP在小尾寒羊不同情期和FecB不同基因型中性腺轴的表达量
本试验对不同情期(卵泡期和黄体期)、不同FecB基因型(BB型和++型)小尾寒羊的下丘脑-垂体-卵巢性腺轴组织进行了定量分析,结果如表3所示。LEP在不同情期、不同基因型的下丘脑、垂体、卵巢组织的表达都没有显著差异(P>0.05)。LEPR在不同情期、不同基因型的下丘脑和垂体组织中的表达都没有显著差异(P>0.05)。在卵巢中,卵泡期++型LEPR基因表达量高于黄体期++型,但差异不显著(P>0.05);卵泡期BB型LEPR基因表达量极显著高于卵泡期++型(P=0.007)、黄体期BB型(P=0.003)和黄体期++型(P=0.003)。
3 讨 论
本试验使用实时荧光定量PCR技术检测了LEPR及LEP基因在卵泡期小尾寒羊11个组织中的表达,分析发现,LEPR及LEP的表达具有广泛性,但存在组织差异。其中LEP在下丘脑、垂体、卵巢呈现出极高的表达水平,而在心、脾、肺等组织中呈现较低的表达水平。刘宝凤[29]研究发现,LEPR与LEP的表达水平呈负相关,LEP和LEPR存在着反向调控机制。所以也解释了在本试验中,当小尾寒羊处于同一情期时,LEP在肾上腺、输卵管、子宫体组织中的表达较低,而LEPR在肾上腺、输卵管、子宫体表达相对较高。下丘脑、垂体、卵巢组织中LEP和LEPR也存在着反向调控。在猪中实时荧光定量PCR结果显示,LEPR在猪的22个组织中均有表达,并且相对丰度存在显著差异(P<0.05)[30]。在这些组织中,子宫内膜附着部位的表达量相对丰度最大(P<0.01),其次是下丘脑和大部分生殖组织(P<0.05),垂体组织LEPR的表达相对丰度较低,本试验结果与其相符。卢守亮等[31]检测了LEPR在中国美利奴和多浪羊的下丘脑、卵巢、子宫性腺轴组织中的表达,发现LEPR在卵巢、子宫体、输卵管组织中都有较高的表达。有研究表明,LEPR在贵州白山羊广谱表达,繁殖系统表达较高[32]。本试验结果同样与其相符。在牛[33]、小鼠[34]中,LEPR在卵巢、子宫等繁殖相关组织中表达并影响牛、小鼠的繁殖性状。
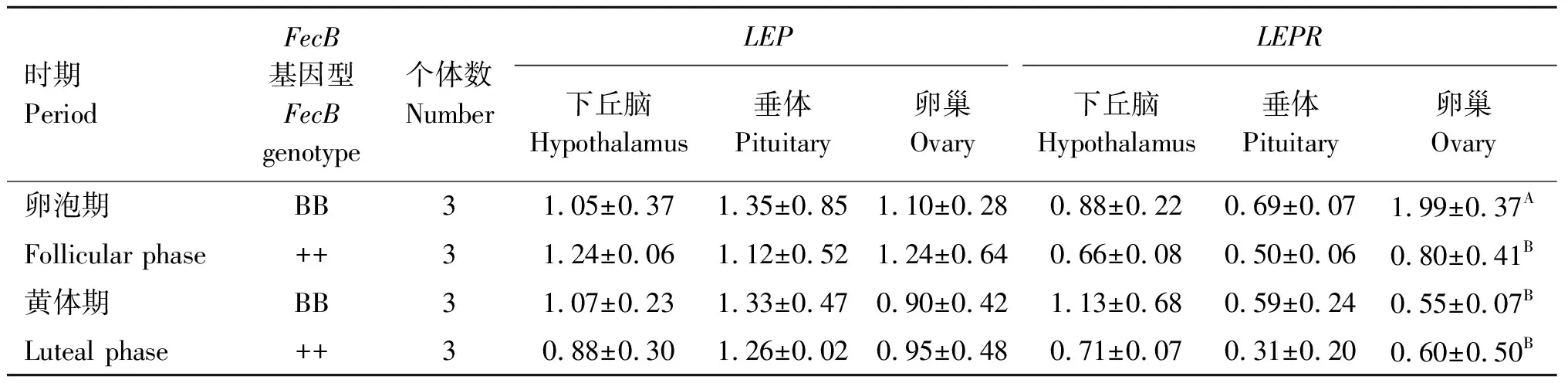
表3 LEP和LEPR在小尾寒羊下丘脑、垂体、卵巢中的表达量Table 3 Expression of LEP and LEPR genes in hypothalamus, pituitary, ovary of Small Tail Han sheep
本试验对不同情期(卵泡期和黄体期)、不同FecB基因型(BB型和++型)小尾寒羊的下丘脑-垂体-卵巢性腺轴组织进行了定量分析。结果显示,LEPR和LEP在下丘脑和垂体的表达在不同情期(卵泡期和黄体期)和不同FecB基因型之间都没有显著差异,推测LEPR及LEP发挥主要作用的组织不是下丘脑和垂体。但在卵巢中,两种基因型卵泡期LEPR和LEP表达量都高于黄体期,卵泡期BB型LEPR表达量均极显著高于卵泡期++型、黄体期BB型、黄体期++型。肥胖雌性小鼠经LEP治疗后其卵巢重量增加,卵巢上的原始卵泡、初级卵母细胞、次级卵泡、成熟卵泡数目明显增加,并观察到卵巢的纵切面上总的卵泡数增加,提示LEP及LEPR在一定程度上提高了卵巢的生理功能[35]。邓艳幔等[23]发现,在小鼠中,卵巢间质有LEPR蛋白表达,揭示LEP与LEPR结合,通过JAK-STAT通路对卵泡发育和成熟产生积极作用。N.Smolinska等[36]通过原位杂交和半定量PCR研究显示,在猪的黄体和卵巢中均有LEPR的表达,卵泡期的LEPR和其蛋白质的表达增加,伴随着黄体的退化而降低。有研究表明[37],LEPR通过直接作用于卵巢和间接作用于中枢神经系统而参与对女性生殖功能的控制。在卵泡期对母羊禁食,导致LEPR浓度降低,也导致排卵率降低[38]。综上表明,LEPR基因在卵巢上发挥了重要的生理功能。
4 结 论
小尾寒羊BB型的排卵数和产羔数都极显著高于++型。LEPR基因在卵泡期小尾寒羊卵巢中表达量最高。卵泡期BB型小尾寒羊卵巢中LEPR表达量均极显著高于卵泡期++型、黄体期BB型、黄体期++型。本研究结果表明,卵泡期LEPR基因高表达与小尾寒羊产羔数增加存在一定程度的正相关,为小尾寒羊产羔性状选育提供了新的线索。
参考文献(References):
[1] DAVIS G H,MONTGOMERY G W,ALLISON A J,et al.Segregation of a major gene influencing fecundity in progeny of Booroola sheep[J].NZJAgricRes,1982,25(4):525-529.
[2] PIPER L R,BINDON B M.The Booroola Merino and the performance of medium Non-Peppin crosses at Armidale[J].WoolTechnolSheepBreed,1983,31(1):14-19,33.
[3] MULSANT P,LECERF F,FABRE S,et al.Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Mérino ewes[J].ProcNatlAcadSciUSA,2001,98(9):5104-5111.
[4] SOUZA C J,MACDOUGALL C,CAMPBELL C,et al.The Booroola (FecB) phenotype is associated with a mutation in the bone morphogenetic receptor type 1 B (BMPR1B) gene[J].JEndocrinol,2001,169(2):R1-R6.
[5] WILSON T,WU X Y,JUENGEL J L,et al.Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic protein IB receptor (ALK-6) that is expressed in both oocytes and granulosa cells[J].BiolReprod,2001,64(4):1225-1235.
[6] JUENGEL J L,DAVIS G H,MCNATTY K P.Using sheep lines with mutations in single genes to better understand ovarian function[J].Reproduction,2013,146(4):R111-R123.
[7] JUENGEL J L,O’CONNELL A R,FRENCH M C,et al.Identification of a line of sheep carrying a putative autosomal gene increasing ovulation rate in sheep that does not appear to interact with mutations in the transforming growth factor beta superfamily[J].BiolReprod,2011,85(1):113-120.
[8] HALDAR A,FRENCH M C,BRAUNING R,et al.Single-nucleotide polymorphisms in theLEPRgene are associated with divergent phenotypes for age at onset of puberty in Davisdale ewes[J].BiolReprod,2014,90(2):33.
[9] JUENGEL J L,FRENCH M C,O’CONNELL A R,et al.Mutations in the leptin receptor gene associated with delayed onset of puberty are also associated with decreased ovulation and lambing rates in prolific Davisdale sheep[J].ReprodFertilDev,2016,28(9):1318-1325.
[10] INGALLS A M,DICKIE M M,SNELL G D.OBESE,a new mutation in the house mouse[J].ObesRes,1996,4(1):101.
[11] KENNEDY G C.The role of depot fat in the hypothalamic control of food intake in the rat[J].ProcRSocLondBBiolSci,1953,140(901):578-592.
[12] ZHANG Y Y,PROENCA R,MAFFEI M,et al.Positional cloning of the mouseobesegene and its human homologue[J].Nature,1994,372(6505):425-432.
[13] HUMMEL K P,DICKIE M M,COLEMAN D L.Diabetes,a new mutafton in the mouse[J].Science,1966,153(3740):1127-1128.
[14] TARTAGLIA L A,DEMBSKI M,WENG X,et al.Identification and expression cloning of a leptin receptor,OB-R[J].Cell,1995,83(7):1263-1271.
[15] COLLINS S,KUHN C M,PETRO A E,et al.Role of leptin in fat regulation[J].Nature,1996,380(6576):677.
[16] FAROOQI I S,O’RAHILLY S.Leptin:A pivotal regulator of human energy homeostasis[J].AmJClinNutr,2009,89(3):980S-984S.
[17] LEBRETHON M C,VANDERSMISSEN E,GEÉRARD A,et al.Invitrostimulation of the prepubertal rat gonadotropin-releasing hormone pulse generator by leptin and neuropeptide Y through distinct mechanisms[J].Endocrinology,2000,141(4):1464-1469.
[18] ZIEBA D A,AMSTALDEN M,WILLIAMS G L.Regulatory roles of leptin in reproduction and metabolism:A comparative review[J].DomestAnimEndocrinol,2005,29(1):166-185.
[19] CHEHAB F F,LIM M E,LU R H.Correction of the sterility defect in homozygous obese female mice by treatment with the human recombinant leptin[J].NatGenet,1996,12(3):318-320.
[20] SWERDLOFF R S,PETERSON M,VERA A,et al.The hypothalamic-pituitary axis in genetically obese (ob/ob) mice:Response to luteinizing hormone-releasing hormone[J].Endocrinology,1978,103(2):542-547.
[21] SWERDLOFF R S,BATT R A,BRAY G A.Reproductive hormonal function in the genetically obese (ob/ob) mouse[J].Endocrinology,1976,98(6):1359-1364.
[22] DONATO J Jr,CRAVO R M,FRAZO R,et al.Hypothalamic sites of leptin action linking metabolism and reproduction[J].Neuroendocrinology,2011,93(1):9-18.
[23] 邓艳幔,崔亚利,胡 满,等.瘦素及其长型瘦素受体在雌性小鼠体内的表达[J].中国兽医学报,2010,30(3):414-418.
DENG Y M,CUI Y L,HU M,et al.Expression of leptin and long-leptin receptor in the female mouse[J].ChineseJournalofVeterinaryScience,2010,30(3):414-418. (in Chinese)
[24] 张 谊.瘦素与哺乳动物繁殖活动关系的研究进展[J].中国畜牧兽医,2015,42(7):1836-1841.
ZHANG Y.Research advance on the relationship between leptin and reproduction activities of mammal[J].ChinaAnimalHusbandry&VeterinaryMedicine,2015,42(7):1836-1841. (in Chinese)
[25] MCNATTY K P,HEATH D A,CLARK Z,et al.Ovarian characteristics in sheep with multiple fecundity genes[J].Reproduction(Cambridge,England),2017,153(2):233-240.
[26] DROUILHET L,MANSANET C,SARRY J,et al.The highly prolific phenotype of Lacaune sheep is associated with an ectopic expression of theB4GALNT2 gene within the ovary[J].PLoSGenet,2013,9(9):e1003809.
[27] CHU M X,LIU Z H,JIAO C L,et al.Mutations inBMPR-IBandBMP-15 genes are associated with litter size in Small Tailed Han sheep (Ovisaries)[J].JAnimSci,2007,85(3):598-603.
[28] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the method[J].Methods,2001,25(4):402-408.
[29] 刘宝凤.绵羊瘦素及其受体基因多态性、mRNA表达及其与性状的关联研究[D].太谷:山西农业大学,2013.
LIU B F.Study on the polymorphism,mRNA expression of leptin and its receptor genes and their association with traits in sheep[D].Taigu:Shanxi Agricultural University,2013. (in Chinese)
[30] FU Y F,LI L,LI B X,et al.Long form leptin receptor and SNP effect on reproductive traits during embryo attachment in Suzhong sows[J].AnimReprodSci,2016,168:57-65.
[31] 卢守亮,李良远,高 磊,等.不同品种绵羊发情周期LEPRbmRNA表达分析[J].生物技术通报,2017,33(5):139-144.
LU S L,LI L L,GAO L,et al.The expression ofLEPRbmRNA in the estrus cycle of different sheep strains[J].BiotechnologyBulletin,2017,33(5):139-144. (in Chinese)
[32] 肖旭东,杜典策,王 峰,等.LEPR基因在贵州白山羊组织中的表达[J].山地农业生物学报,2017,36(1):36-39.
XIAO X D,DU D C,WANG F,et al.Expression ofLEPRgene in the tissues of Guizhou white goat[J].JournalofMountainAgricultureandBiology,2017,36(1):36-39. (in Chinese)
[33] SARKAR M,SCHILFFARTH S,SCHAMS D,et al.The expression of leptin and its receptor during different physiological stages in the bovine ovary[J].MolReprodDev,2010,77(2):174-181.
[34] TU X Y,KUANG Z C,GONG X,et al.The influence of LepR tyrosine site mutations on mouse ovary development and related gene expression changes[J].PLoSOne,2015,10(11):e0141800.
[35] KLEIN K O,MARTHA P M Jr,BLIZZARD R M,et al.A longitudinal assessment of hormonal and physical alterations during normal puberty in boys.II.Estrogen levels as determined by an ultrasensitive bioassay[J].JClinEndocrinolMetab,1996,81(9):3203-3207.
[36] SMOLINSKA N,KAMINSKI T,SIAWRYS G,et al.Long form of leptin receptor gene and protein expression in the porcine ovary during the estrous cycle and early pregnancy[J].ReprodBiol,2007,7(7):17-39.
[37] CATTEAU A,CAILLON H,BARRIRE P,et al.Leptin and its potential interest in assisted reproduction cycles[J].HumReprodUpdate,2016,22(3):320-341.
[38] KOSIOR-KORZECKA U,BOBOWIEC R.Leptin effect on nitric oxide and GnRH-induced FSH secretion from ovine pituitary cellsinvitro[J].JPhysiolPharmacol,2006,57(4):637-647.
