子宫颈球囊扩张导管产品审评要点分析
2018-06-07魏增江孙兆霞何泽文
魏增江 孙兆霞 何泽文
1 广东省食品药品监督管理局审评认证中心 (广东 广州 510080)2 广州医科大学附属第一医院 (广东 广州 510120)
临床上,产科医生会经常遇到晚期妊娠、过期妊娠而无临产征兆及因其他各种原因需要行引产术的孕妇。引产是产科治疗学中的难点之一,引产的成功与否取决宫颈的条件,引产中宫颈不成熟会导致产程延长,从而导致剖宫产率和胎儿窒息增加。国内最常用引产的方法是小剂量缩宫素及阴道内填塞前列腺素E2栓剂(PGE2)等[1]。缩宫素为传统引产药物,通过缩宫素受体发生作用,但该受体在宫颈的分布很少,对宫颈的直接作用小,仅能通过刺激蜕膜合成前列腺素,促宫颈成熟,效果比较差[2]。另外一种引产方法是物理方法,相比于药物引产方法,机械性方法国内外多采用子宫颈扩张球囊导管。子宫颈扩张球囊导管是一种新型的引产器械,国内外文献报道指出,子宫颈扩张球囊导管(以美国COOK公司产品报道居多)是一种安全而有效的引产方式,其促宫颈成熟的主要原理是靠导管及宫颈口内外双球囊压力,机械性刺激宫颈管,促进宫颈局部内源性前列腺素合成与释放,从而促进宫颈软化成熟,使产妇在不知不觉中自然、渐进地扩张宫颈并易化引产[3-5]。
1.子宫颈扩张球囊导管产品简介
子宫颈扩张球囊导管通常由硅胶材料制成,一般以无菌形式提供,一次性使用。子宫颈扩张球囊导管是一种双球囊导管,将双球囊(阴道球囊和宫颈球囊)分别置于宫颈内外口,通过对宫颈内外口缓慢、持续的机械刺激作用产生渐进性扩张宫颈作用,是通过机械性扩张原理促进宫颈成熟。该产品适用于足月引产前对成熟度不佳的宫颈进行宫颈管的机械扩张。
截止2018年2月,已获准境内注册证的国内医疗器械生产企业有十多家,主要分布在珠三角、江苏等地,少量分布在江西、河北、湖北。发稿前为止,广东省已获该产品注册证的厂家有6家,正在申报的有2家。进口产品主要以美国COOK公司为主。
2.子宫颈球囊扩张导管产品审评要点分析
2.1 产品结构设计、使用、工作原理
子宫颈扩张球囊导管产品一般由导管、球囊、Y型连接器、充盈接头、止逆阀组成(具体详见产品图1)。主要关注产品的结构尺寸设计,如:扩张管的内外径、有效长度,球囊尺寸的设计,球囊间距,扩张管前端圆滑无损伤设计,球囊充起泄压设计是否合理、接头设计,内外球囊充盈接头是否标记清楚等。使用时一般是通过器械辅助将子宫颈球囊扩张导管远端送入宫颈口(保证两个球囊都通过宫颈内口),先通过充盈接头注射生理盐水将远端球囊(手术操作者的较远的球囊,也成为“子宫球囊”)部分充盈(一般为充盈标称体积的一半),然后回拉导管确保远端球囊贴近内宫颈口,同时通过辅助观察器械可见近端球囊(手术操作者的较近的球囊,也成为“阴道球囊“)位于宫颈外口。接下来通过充盈生理盐水逐步扩张内外球囊,一般每次注入10~20mL并作准确记录,累计充盈体积不能超过产品说明书中标称的充盈体积。临床医生可结合产妇宫颈的成熟度决定注入生理盐水的体积,进而控制对宫颈扩张的程度。其工作原理可简单概括为:球囊在宫颈内口和外口提供温和、持续的扩张力促使子宫颈成熟与扩张。
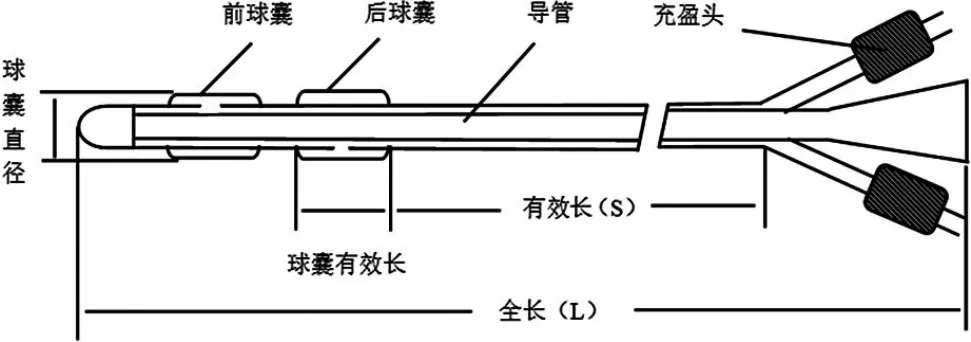
图1.子宫颈扩张球囊导管
2.2 原材料控制
子宫颈扩张球囊导管产品的原材料应具有稳定的供货渠道以保证产品质量。申报企业应参考《医疗器械生产企业供应商审核指南》[6]建立供应商审核制度,对供应商进行审核和评价,确保所采购物品满足其产品生产的质量要求。需提供原材料生产厂家的资质证明、外购合同协议(应体现对原材料的要求,建议考虑:理化性能、生物性能、洁净度等)及相关供应商评价报告。应在注册申报资料中(综述资料)明确原材料相关信息,如原材料名称(通用名称、化学名称、商品名称)、材质、牌号、化学结构式/分子式、CAS号,级别、符合的相关标准、生产商名称等基本信息。建议申报企业建立材料安全数据表(Materials Safety Data Sheets,MSDS),以方便检查每种原材料信息。注册核查应关注所用原材料及配件的采购,包括采购协议、质量标准、原材料名录、供应商资质证明文件、质检报告、入场检验放行要求、是否对原材料进行分级分类管理,是否对供应商的进行评估等。
2.3 生物相容性评价
生物相容性评价是无源产品审评过程重点关注点。可根据GB16886.1和申报产品预期与人体的接触部位、接触时间,判断申报产品应进行的生物相容性评价项目。可参考《关于印发医疗器械生物学评价和审查指南的通知》[7](国食药监械[2007]345号)提交生物相容性评价研究资料或进行生物相容性试验。该产品正常使用过程中一般接触完整黏膜,短期接触。因此评价项目一般为细胞毒性、迟发性超敏反应、刺激反应(阴道黏膜刺激)。特殊使用情形,应参考GB16886.1重新评估生物相容性评价项目。
2.4 产品技术要求
产品技术要求的格式和内容应符合《医疗器械产品技术要求编写指导原则》[8]的要求。产品技术要求的主要内容为产品性能指标和检验方法。其中性能指标是指可进行客观判定的成品的功能性、安全性指标以及与质量控制相关的其他指标。检验方法要求具有可重复性和可操作性。生产企业应根据产品的特点制定保证产品安全有效、质量可控的技术要求。相关性能要求建议考虑但不局限于以下内容:①质量控制性能指标:导管内外径、球囊间距直径、有效长度、球囊及导管表面边缘应光滑无锐边、导管头端应圆滑、接头要求等。②物理性能:连接强度、连接分离力、抗扭结、球囊可靠性、球囊充起时无泄漏破坏等。③化学性能:重金属、酸碱度、还原物质(易氧化物)、EO残留(若采用EO灭菌)等。④生物性能:该产品一般以无菌形式提供,参考《中华人民共和国药典》2015年版[9](通则1100生物检查法)制定检验方法。
根据不同材料特性及申报产品具体情况,由企业决定对上述指标提出具体要求。同时也可参考临床评价中已上市产品性能要求,申报产品一般不低于对比产品性能要求,特殊情况应予以说明,必要时提交研究资料。
2.5 临床评价
根据国家食品药品监督管理总局关于发布第二批免于进行临床试验的第二类医疗器械目录的通告(2016年第133号)[10],子宫颈扩张球囊导管可免于进行临床试验。注册技术审评应重点关注申报产品与已获准境内注册的《目录》中
医疗器械产品在工作原理、结构组成(结构、尺寸、设计)、适用范围、制造材料(现产品一般为硅橡胶材质)、性能要求、使用方法、禁忌证等方面的等同性。申请人应识别出与对比产品的差异,并对差异提交研究资料。提交的研究资料应能证明存在的差异不影响申报产的安全有效性,且能够说明申报产品与《目录》所述的产品具有等同性。
2.6 风险分析
风险分析贯穿于整个医疗器械生命周期,生产企业应对子宫颈扩张球囊导管产品的设计开发、原材料控制、生产加工过程、包装运输、灭菌、贮存、使用等各个环节进行风险分析。
主要风险如:①生物学危害,形成因素包含包装破损,灭菌不完全等导致的产品带致病菌的风险;原材料控制、生产工艺(如:配方)、助剂和胶黏剂的添加、小分子残留等控制不严格导致的生物相容性风险。②环境危害:运输存储环境控制不严格,导致产品老化、包装受损的风险。③与医疗器械使用有关的危害,不适当的操作说明,由不熟练/未经培训的人员使用,使用前的产品检查和准备。④信息风险:未标注产品有限期,没有标示是否重复使用,没有写明产品存储环境要求,型号规格的选择未注明等等。
2.7 其他关注点
子宫颈扩张球囊导管产品一般以无菌形式提供,技术审查以及注册核查过程,应重点关注产品的灭菌过程、无菌检测(厂房、设备、仪器、检测能力)等。注册核查过程中还应关注生产工艺中的特殊工序和关键工序是否经过验证和确认,并按照经确认和验证的工艺参数进行生产。应关注说明书是否符合《医疗器械说明书标签管理规定》,重点关注该产品使用说明,禁忌证、注意事项、适用范围的描述。
3.总结
子宫颈球囊扩张导管产品目前无相应的产品标准,也无相应的技术审查指导原则。各省、自治区、直辖市在技术审查工作中容易出现要求不一致的情况。本文仅代表作者本人对该类产品审评的看法和意见,在此希望医疗器械审评的同行们多多发表意见,以期使子宫颈球囊扩张导管产品的审评工作更全面和完善,最终确保上市产品的安全性和有效性。
[1]薛洪喜,马玉燕,李桦,等.足月妊娠促宫颈成熟方法的探讨[J],现代产科进展,2007,16(9):647-649.
[2]白桂芹,付逢萍,王慰敏.宫颈粗成熟球囊在临床计划分娩中的作用[J],中国妇幼健康研究,2011,22(21):179-181.
[3]梁依斐,黄芳.子宫颈扩张球囊导管促宫颈成熟及引产临床分析[J],现代诊断与治疗,2016,27(23):4483-4484.
[4]陈君玉,陈平,盛霞玲,等.双球囊导管机械性扩张宫颈在未临产孕妇引产中的应用价值[J],中国医学创新,2014,7(34):87-89.
[5]黎燕,苏放明,高宇,等.宫颈扩张双球囊导管和控释地诺前列酮栓促宫颈成熟的比较研究[J],中国妇幼保健,2013,28(11):1822-1825.
[6]食品药品监督管理总局.国家食品药品监督管理总局关于发布医疗器械生产企业供应商审核指南的通告(2015年第1号)[Z].http://samr.cfda.gov.cn/WS01/CL0087/112629.html.2015-01-19.
[7]国家食品药品监督管理局.关于印发医疗器械生物学评价和审查指南的通知(国食药监械[2007]345号)[Z].http://samr.cfda.gov.cn/WS01/CL0845/10708.html.2007-06-27.
[8]国家食品药品监督管理局.《医疗器械产品技术要求编写指导原则》(局令第9号)[Z].http://samr.cfda.gov.cn/WS01/CL1421/100817.html.2014-05-30.
[9]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015.
[10]食品药品监管总局.总局关于发布第二批免于进行临床试验医疗器械目录的通告(2016年第133号)[Z].http://samr.cfda.gov.cn/WS01/CL0087/164956.html.2016-09-30.
