基于氮掺杂碳量子点/DNA自组装纳米探针检测鱼精蛋白
2018-06-06武建露闫桂琴
武建露,闫桂琴
(山西师范大学 生命科学院,山西 临汾 041004)
1 引 言
鱼精蛋白(Protamine)是一种从鱼类精巢组织中分离获得的多聚阳离子碱性蛋白。在医学领域里,它可延迟或阻止胰岛素释放,或作为肝素解毒剂等[1]。鱼精蛋白作为一种新型的食品资源,具有高效抑菌活性[2]。同时,鱼精蛋白也是近年发展起来的又一新型的天然高分子非病毒载体,鉴于鱼精蛋白丰富的生物活性和重要的药用价值,如何实现鱼精蛋白快速、简单的测定引起了广大学者的关注。
目前,关于鱼精蛋白的测定方法报道的甚少,仅见于液相色谱法、传统荧光法、电位滴定法等。这些方法中,液相色谱法需要复杂的样品预处理,电化学法需要复杂的电极修饰过程,传统荧光法虽然灵敏,但难以避免干扰物质。因此,建立一种灵敏、准确的鱼精蛋白分析方法十分有必要。
碳量子点作为一种新兴的纳米材料,因其易于合成、定制的功能化及优异的化学和胶体稳定性对跨学科研究给予了巨大的希望[3],它们内在的光致发光性质被称为“纳米亮点”[4],特别是由于碳点的多色发射性能和生物相容性对发展生物成像和生物传感非常重要[5],碳量子点作为一种新型荧光探针,已广泛应用于化学分析[6-7]和生物传感[8]等研究领域。本文将氮原子掺入到碳点中。由于氮原子具有孤对电子,其进入碳骨架后将有效调节碳点的本身性质,如电子特征、表面或者局部的化学特性[9]。碳点的发射特性及其优点已被用于生物传感器开发,现已被应用到临床重要蛋白质的检测。因此本文参考Hu[10]的方法由下至上地快速、简单、大规模合成氮掺杂荧光碳点(NCDs)。这种方法是将柠檬酸置于单乙醇胺中,通过简单加热实现的。其中单乙醇胺扮演了修饰剂和溶剂的双重角色,而柠檬酸是碳源。该方法不需要特殊的仪器,在相对温和的条件下(170℃,空气环境),能够快速(10min)地一锅合成大量(39.96g)的高质量氮掺杂碳点。
本文的研究目的是通过表面修饰或自组装(氢键、酸/碱质子转移、静电作用)等功能化过程,使量子点与DNA通过静电作用构建一种纳米复合物,并探索将该复合物作为荧光纳米探针对鱼精蛋白进行检测的可行性。双链DNA的磷酸骨架(ds-DNA)通过负的静电引力与带有正电的NCDs相互吸引结合,形成了NCDs/DNA杂交物,使得NCDs的荧光明显增强。有趣的是,当将鱼精蛋白加入到NCDs/DNA混合物中时,鱼精蛋白能够竞争结合DNA,于是双链DNA和鱼精蛋白由于强烈的亲和力结合,使得DNA从NCDs表面脱落从而解除了NCDs荧光信号,NCDs的荧光恢复,因此,可以通过监测荧光增强和恢复检测鱼精蛋白。
2 实 验
图1为氮掺杂碳量子点/DNA纳米探针测定鱼精蛋白的原理示意图。
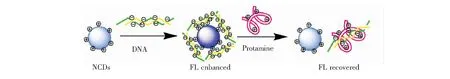
图1 氮掺杂碳量子点/DNA纳米探针测定鱼精蛋白的原理示意图Fig.1 Principle of determination of protamine with NCDs/DNA nano probe
2.1 试剂和材料
单乙醇胺、鲑鱼精子DNA(hsDNA)、鱼精蛋白(Protamine)均购与美国Sigma公司。柠檬酸购于上海爱为科研公司。其他试剂都为分析纯并按原样使用。实验用水为超纯水。
2.2 仪器
通过JEM-2100透射电子显微镜(日本电子,日本)观察量子点形貌和微观结构,通过Cary Eclipse荧光分光光度计(瓦里安有限公司,美国)对荧光和共振光散射(Resnnanee Light Seattering,RLS)进行信号测定(扫描波长200~800nm),通过pH酸度剂(上海雷磁,中国)对pH值进行测定。
2.3 氮掺杂碳点的合成
用柠檬酸作碳源大规模合成氮掺杂碳点。首先,将30g柠檬酸与230mL单乙醇胺混合,剧烈搅拌使其分散均匀。之后在冷凝回流的条件下,以大约20℃·min-1的速度加热上述混合物至170℃并持续反应10min。在上述过程中,混合物溶液由无色慢慢变为黄色且颜色逐渐加深至棕黄色,这表明生成了氮掺杂碳点。10min后撤去热源,将溶液自然冷却至室温。用旋转蒸发仪蒸去未反应的单乙醇胺(蒸出的液体大约204mL)并真空干燥样品,得到39.96g氮掺杂碳点粉末。
2.4 碳点的表征

荧光光谱(图4)表明氮掺杂碳点具有激发波长依赖的荧光特性。当激发波长从360nm调至440nm时,氮掺杂碳点的荧光发射峰峰位从451nm红移至518nm。这种依赖于激发波长的荧光变化特性很可能与粒子尺寸不均一和表面发射缺陷点过多有关[12]。当激发波长为370nm时,氮掺杂碳点具有最强的荧光发射,其峰位为365.085nm,半峰宽为75nm。以硫酸奎宁为参比,氮掺杂碳点的荧光量子产率为40.3%,高于绝大多数文献报道的碳纳米材料的荧光量子产率。氮掺杂碳点的光学稳定性好,在室温下经近一年的储存后,其荧光强度仍基本保持不变,在350nm的紫外灯照射下仍能发射明亮的蓝色荧光。

图2 NCDs的透射电镜图Fig.2 TEM image of NCDs
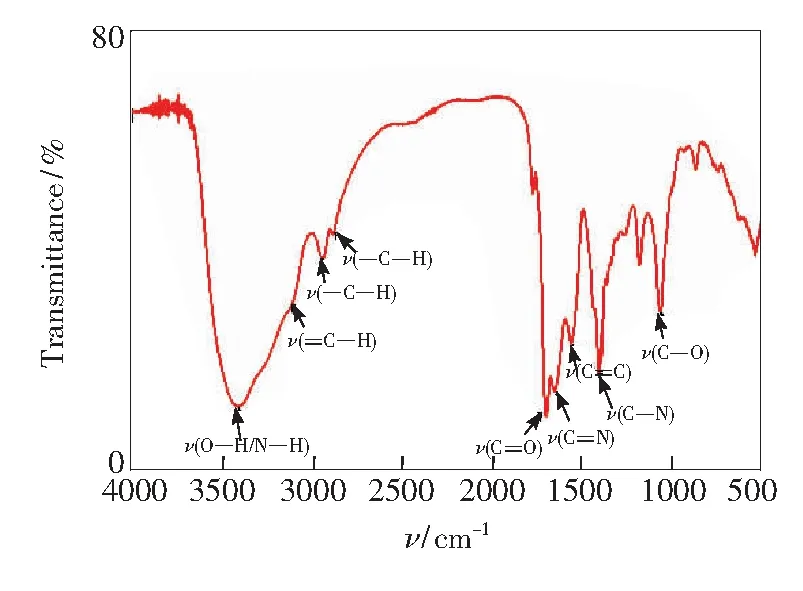
图3 NCDs的红外光谱图Fig.3 FTIR spectra of NCDs
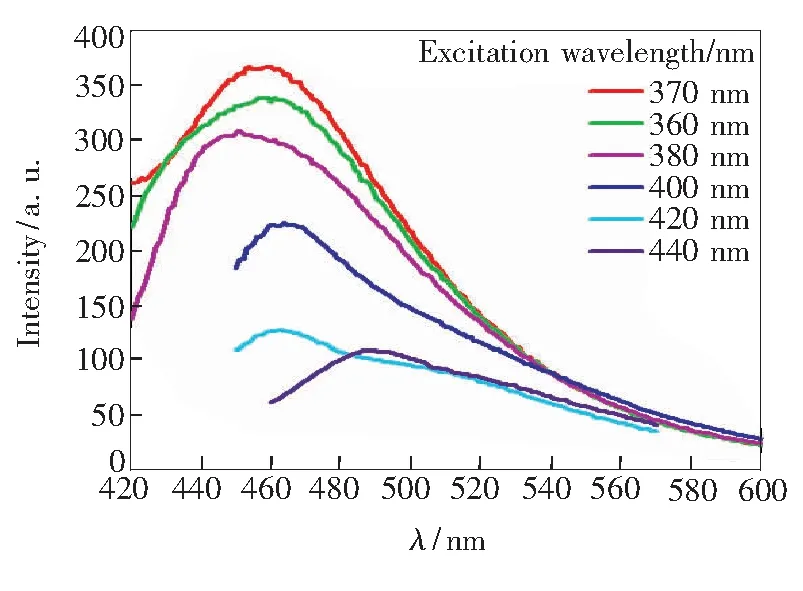
图4 不同激发波长下NCDs的荧光光谱Fig.4 Normalized FL spectra of NCDs under different excitation wavelengths
2.5 测定方法
为研究DNA对NCDs荧光强度的影响,将DNA溶于超纯水中,浓度为400μg·mL-1(经多次试验后找到的最佳浓度),在一系列比色管中分别加入100~1000μL上述溶液,再分别加入(PBS10mol/mL,pH=7.4)0.5mL以及50μL浓度为1μg·mL-1的NCDs溶液于各比色管中。超纯水定容至5mL,此时,DNA的浓度为8~88μg·mL-1。10min后进行荧光光谱测定分析。对于鱼精蛋白的检测,先将一定量的鱼精蛋白溶于水,制得1mg·mL-1溶液,接着在一系列比色管中依次加入(PBS10mol/mL pH=7.4)0.5mL,和50μL浓度为1μg·mL-1的NCDs溶液以及1000μL浓度为400μg·mL-1的DNA溶液以及5~50μL浓度为1mg·mL-1不同量的鱼精蛋白溶液(定容后浓度为1~10μg·mL-1),用高纯水定容至5mL,静止30min,进行荧光检测。激发波长为370nm,扫描范围为400~600nm,取激发光谱的最大吸收峰值作为定量分析值。
3 结果与讨论
3.1 荧光纳米探针构建原理
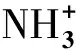
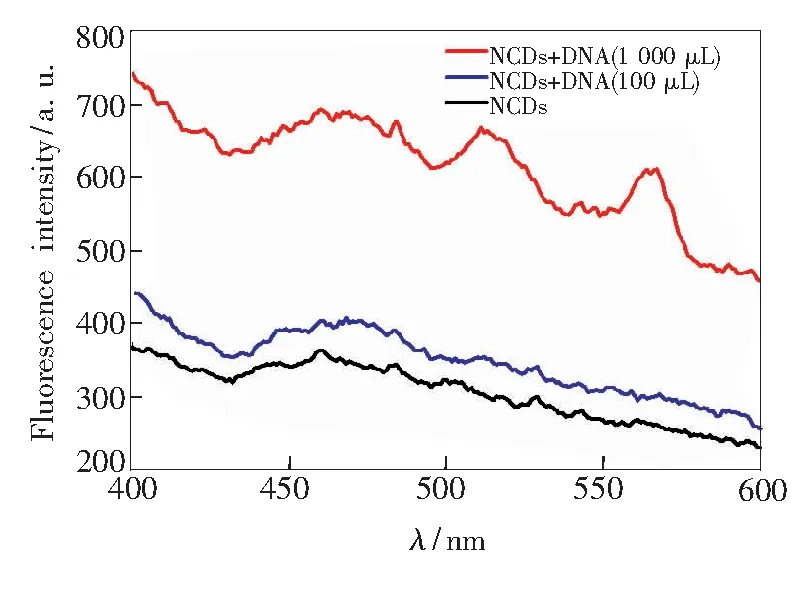
图5 不同浓度的DNA与NCDs的RLS光谱Fig.5 RLS spectra of DNA and NCDs with different concentrations
通过Zeta电位进一步分析可得,在pH=7.4时,该体系的Zeta电位值(Z)从+24.68mV下降到+17.23mV也证实,NCDs与DNA通过静电作用使得DNA周围的负电荷减少,与NCDs的正电荷结合。
此外,还合成了阴离子型碳点(ACD)来验证静电吸引是否是形成混合物NCDs/DNA的驱动力,并进行了凝胶确认。NCDs/DNA混合形成一个典型的琼脂糖凝胶电泳(质量分数3%,stained with ethidium bromide(EB)),电泳是由ACD/DNA、NCDs 和NCDs/DNA 进行的(NCDs和ACD为50μL,浓度为1μg·mL-1;DNA 为200μL,浓度为400μg·mL-1)。观察比较发现EB染色的琼脂糖凝胶电泳,ACD/DNA、NCDs/DNA 这两条带颜色显著(图6)。然而,在单纯的含有NCDs条带上,看不到任何荧光迁移现象。而在NCDs/DNA上,由于大多数自由的DNA和NCDs结合,NCDs/DNA的DNA带也很微弱,但几乎没有DNA可以跟复杂的ACD结合,因此该条带较亮。此外,密度分析该凝胶的发光区显示,70%的DNA在和NCDs结合后不在凝胶中迁移。
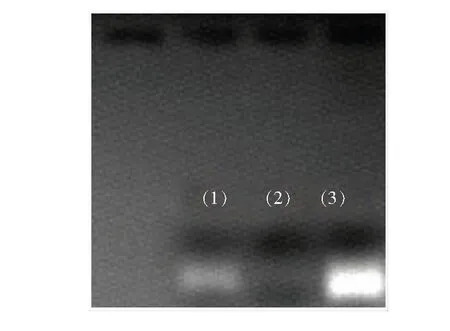
图6琼脂糖凝胶电泳。(1)NCDs/DNA;(2)NCDs;(3)ACD/DNA。
Fig.6Agarose gel electrophoresis.(1)NCDs/DNA.(2)NCDs.(3)ACD/DNA.
3.2 NCDs对DNA的荧光响应
DNA对NCDs的荧光强度有明显的增强作用。我们在NCDs/DNA形成后测量每个溶液的发射光谱。通过增加DNA的量发现,NCDs的发射波长逐渐增大且发射最小值从310nm急剧增大到334nm,表明形成了纳米混合物,如图7所示。 随着加入的 DNA浓度的增加,荧光强度逐渐增大,且增大效应明显(图7)。随着DNA浓度从8μg·mL-1增加到88μg·mL-1,荧光强度呈线性增大,嵌入图表示浓度与荧光强度之间的线性关系,其线性方程为I/I0=0.0875CDNA+0.9416(R=0.995)。实验证明两者之间发生了相互作用,可以通过荧光增强效应来测定DNA的含量。
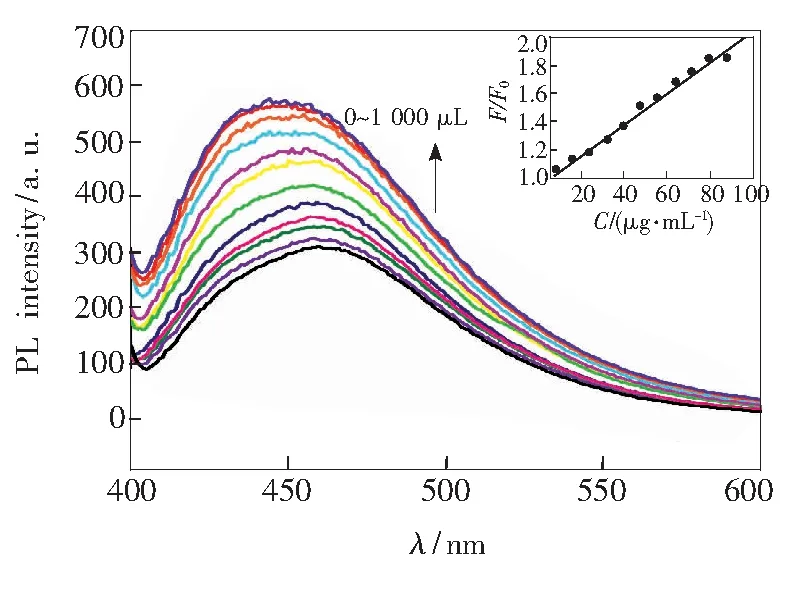
图7 不同浓度的DNA荧光响应Fig.7 Relationship between different concentrations of DNA and fluorescence intensity
3.3 实验条件的优化
图8分别表示了溶液pH值和时间对DNA增强NCDs荧光强度的影响。如图8(a)所示,pH值在4.0~9.0之间时,体系荧光较强,随后开始逐渐降低。当下降到pH值为6.5后又开始增强。直到pH值到8.3之后,荧光强度又有了较明显的下降,但在6.5~7.4之间基本保持不变。因此,我们选择pH值为7.4作为后续测定最佳pH条件,之后对该体系反应时间进行了测定,如图8(b)所示。在加试剂后立即测定,在最初反应时间之后每隔10min进行一次测定,一直到90min后,反应荧光强度基本都保持不变,说明该体系比较稳定,时间对其影响不大。
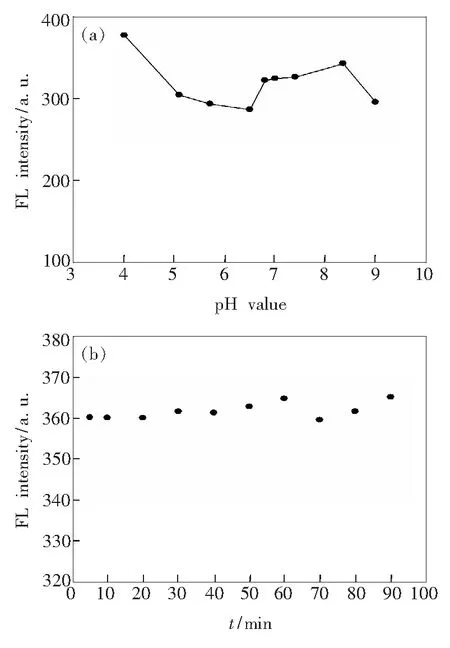
图8(a)pH值对氮掺杂碳量子点/肝素荧光强度的影响;(b)时间对氮掺杂碳量子点/肝素荧光强度的影响。
Fig.8(a) Effect of pH value on fluorescence intensity of NCDs/DNA.(b) Effect of time on fluorescence intensity of NCDs/DNA.
3.4 NCDs/DNA自组装纳米探针对鱼精蛋白的检测
如图9所示,在NCDs/DNA复合体系中加入鱼精蛋白后,体系荧光强度随着鱼精蛋白的加入逐渐降低。而在单纯的NCDs溶液中加入鱼精蛋白,NCDs室温荧光强度基本保持不变,这归因于NCDs与鱼精蛋白在溶液中均呈现正电,二者不会发生相互作用。
图10显示在加入DNA与鱼精蛋白后,紫外光照射下NCDs荧光视觉变化的顺序。从左到右依次为NCDs、NCDs+DNA、NCDs+DNA+鱼精蛋白。该图直观地表明,加入DNA后NCDs荧光显著增强,但继续加入鱼精蛋白后,荧光有所降低,基本恢复到了原有荧光亮度,说明鱼精蛋白能竞争结合DNA并使DNA从NCDs表面脱落,使得NCDs的荧光恢复。
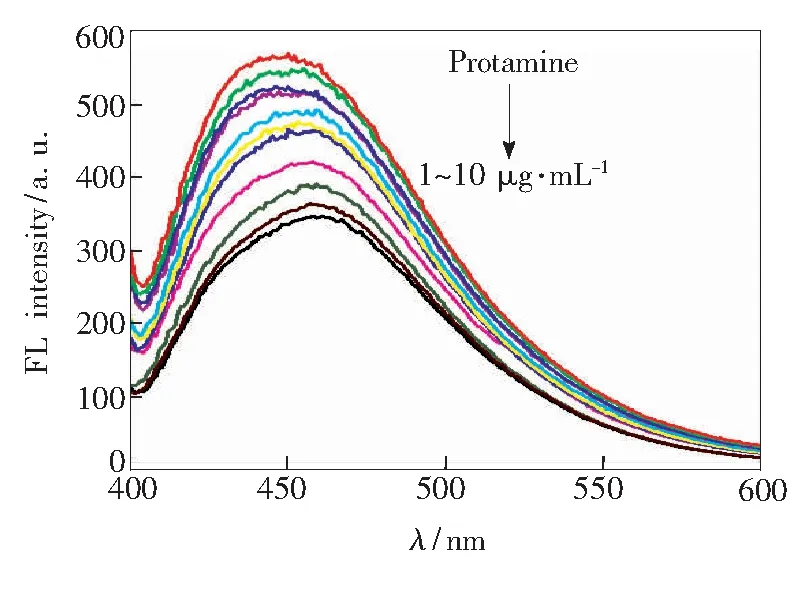
图9不同浓度的鱼精蛋白对NCDs/DNA纳米探针荧光强度的影响
Fig.9Effect of different concentrations of protamine on fluorescence intensity of NCDs/DNA nano probe

图10 紫外光照射下NCDs荧光视觉变化Fig.10 Visual changes of NCDs fluorescence under UV irradiation
通过Zeta电位进一步分析发现,在PH为7.4时,单独的NCDs溶液的Zeta电位为+24.68mV,加DNA使Zeta电位降为+17.23mV。在二者体系中继续加入鱼精蛋白后,Zeta电位又升至+24.62mV。这些结果也说明DNA能与NCDs通过静电作用形成基态复合物使NCDs周围的电荷减少,鱼精蛋白会中和DNA本身的负电荷,由于鱼精蛋白与DNA形成了稳定的复合物,从而减弱了DNA与NCDs之间的静电作用,使DNA从NCDs表面脱离,Zeta电位也随之恢复,NCDs的荧光得到恢复。
基于以上结果分析,在最佳实验条件下,我们建立了NCDs/DNA复合物荧光强度变化与鱼精蛋白之间的线性响应关系,如图11所示,线性方程为I/I0=0.0396Cprotamine+0.5789(R=0.991),线性范围为1~10μg·mL-1。连续测定11次不含鱼精蛋白和含1μg·mL-1体系荧光强度差值的相对偏差为6.8%,该方法检出限(3σ/k)为0.61μg·mL-1。
就检出限与检出范围与其他检测方法相比较(表1),该方法的检出限明显低于液相色谱法。此外,与相似的量子点荧光法比较,虽然检出限高,但范围更宽。且NCDs荧光法中,量子点的合成更简单,原料更便宜环保,操作更简单。
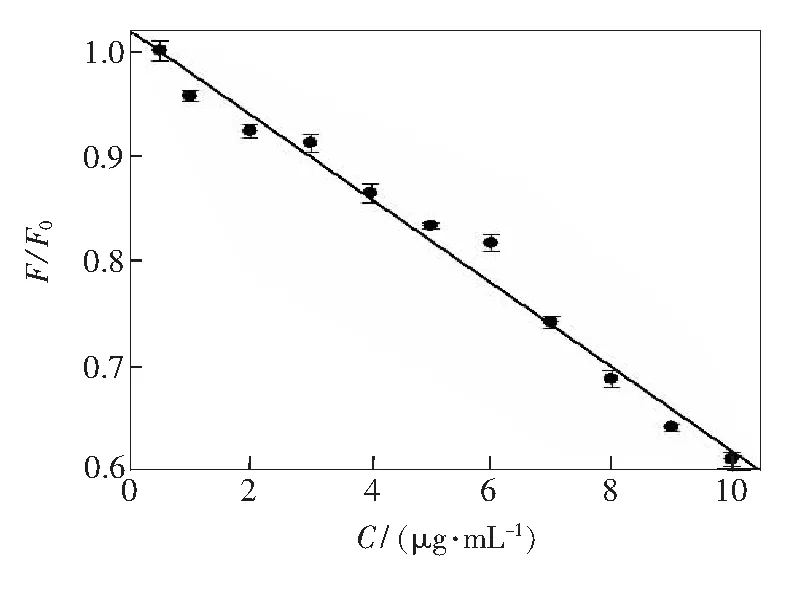
图11NCDs/DNA复合物荧光强度变化与鱼精蛋白之间的线性响应关系曲线
Fig.11Linear response curve between fluorescence intensity of NCDs/DNA complex and protamine

表1 鱼精蛋白测定中不同分析方法的比较Tab.1 Comparison of the proposed method with different analytical techniques reported for determination of protamine
3.5 外源物质的干扰
为探究NCDs对肝素选择的灵敏性及生物体液中常见小分子、离子对该检测体系的干扰,我们做了以下干扰实验(表2)。在5 μg·mL-1鱼精蛋白存在的环境下,1 000倍的Na+、1 000倍的K+、150倍的Mg2+、200倍的Ca2+、500倍的Glucose、500倍的Lysozyme、140倍的Arginine、80倍的BSA、50倍的HA、50倍的KS对鱼精蛋白的检测造成的影响不明显,其中Lysozyme影响稍高,可能和其带有正电与一小部分DNA发生了静电作用有关,但影响并不大可以忽略。因此,在实际检测中外源物质对该检测方法干扰较小,以上结果证明,该方法具有良好的选择性。
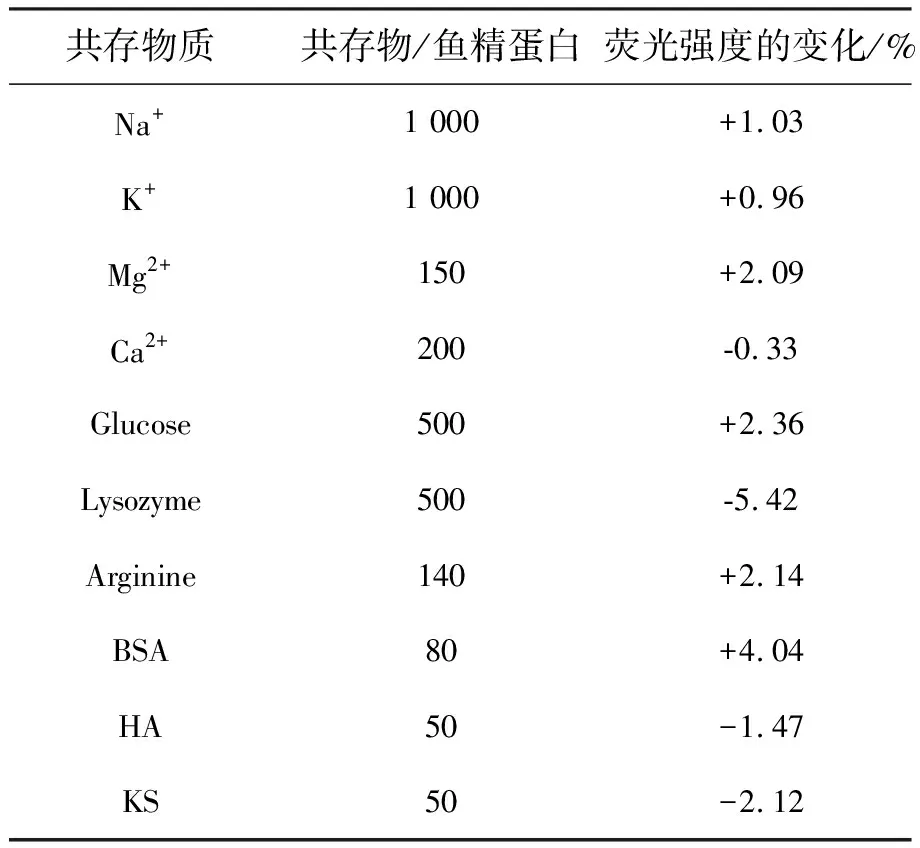
表2 外源物质的干扰Tab.2 Tolorance of foreign substances
4 结 论
基于氮掺杂碳量子点和DNA之间强烈的静电作用,构建了一种快速、简单、灵敏的自组装纳米探针检测鱼精蛋白。该方法有效地利用NCDs量子点特有的荧光性质,使DNA通过静电作用与NCDs量子点结合并将量子点的荧光增强。随后加入鱼精蛋白,鱼精蛋白与DNA相互作用并结合,将DNA从NCDs量子点表面解吸,进而使得NCDs量子点的荧光得到恢复。基于NCDs量子点荧光性质的检测方法与传统的方法相比较,不需要添加任何诱导剂及除氧。该纳米探针可在浓度范围1~10 μg·mL-1内有效检测鱼精蛋白,检出限为0.61 μg·mL-1。此外,该检测法具有成本低、无毒、环保、容易操作等优点,具有较强的实际意义。
参 考 文 献:
[1] JAQUES L B.Protamine-antagonist to heparin [J].Can.Med.Assoc.J., 1973, 108:1291-1297.
[2] POTTER R, HANSEN L T, GILL T A.Inhibition of foodborne bacteria by native and modified protamine:importance of electrostatic interactions [J].Int.J.Pharm., 2012, 425:35-43.
[3] JOAQUIM C G, DA SILVA E, HELENA M R,etal..Analytical and bioanalytical applications of carbon dots [J].Anal.Chem., 2011, 30(8):1327-1336.
[4] BAKER S N, BAKER G A.Luminescent carbon nanodots:emergent nanolights [J].Angew.Chem.Int.Ed., 2010, 49:6726-6744.
[5] LIU J H, LI J S, JIANG Y,etal..Combination of p-p stacking and electrostatic repulsion between carboxylic carbon nanoparticles and fluorescent oligonucleotides for rapid and sensitive detection of thrombin [J].Chem.Commun., 2011, 47:11321-11323.
[6] HAMISHEHKAR H, GHASEMZADEH B, NASERI A,etal..Carbon dots preparation as a fluorescent sensing platform for highly efficient detection of Fe(Ⅲ) ions in biological systems [J].Spectrochim.ActaA, 2015, 150:934-939.
[7] ZHAO J J , ZHAO L M, LAN C Q,etal..Graphene quantum dots as effective probes for label-free fluorescence detection of dopamine [J].Sens.ActuatorsB-Chem., 2016, 223:246-251.
[8] WANG G L, FANG X, WU X M,etal..Label-free and ratiometric detection of nuclei acids based on grapheme quantum dots utilizing cascade amplification by nicking endonuclease and catalytic G-quadruplex DNAzyme [J].Biosens.Bioelectron., 2016, 81:214-220.
[9] WU X, TIAN F, WANG W X,etal..Fabrication of highly fluorescent graphene quantum dots using L-glutamic acid forinvitro/invivoimaging and sensing [J].Mater.Chem.C, 2013, 1:4676-4684.
[10] HU Y P, YANG J, TIAN J W,etal..How do nitrogen-doped carbon dots generate from molecular precursors? An investigation of the formation mechanism and a solution-based large-scale synthesis [J].Mater.Chem.B, 2015, 3:5608-5614.
[11] LIU S, TIAN J Q , WANG L,etal..Hydrothermal treatment of grass:a low-cost, green route to nitrogen-doped, carbon-rich, photoluminescent polymer nanodots as an effective fluorescent sensing platform for label-free detection of Cu(Ⅱ) ions [J].Adv.Mater., 2012, 24:2037-2041.
[12] SHVAREV A, BAKKER E.Reversible electrochemical detection of nonelectroactive polyions [J].J.Am.Chem.Soc., 2003, 125:11192-11193.
[13] ZHAO J N, YI Y H, MI N X,etal..Gold nanoparticle coupled with fluorophore for ultrasensitive detection of protamine and heparin [J].Talanta, 2013, 116:951-957.
[14] SNYCERSKI A, DUDKIEWICZ-WILCZYNSKA J, TAUTT J.Determination of protamine sulphate in drug formulations using high performance liquid chromatography [J].J.Pharmaceut.Biomed.Anal., 1998, 18(4-5):907-910.
[15] AWOTEW-OTOO D, AGARABI C, FAUSTINO P J,etal..Application of quality by design elements for the development and optimization of an analytical method for protamine sulfate [J].J.Pharmaceut.Biomed., 2012, 62:61-67.
