垂序商陆叶片总皂苷的提取及杀虫活性研究
2018-06-06刘媛琪毛龙毅闫荣玲何禧源
刘媛琪,毛龙毅,闫荣玲,①,何禧源,廖 阳,①
(湖南科技学院:a. 化学与生物工程学院,b. 湘南优势植物资源综合利用湖南省重点实验室,c. 湖南省银杏工程技术中心,湖南 永州 425199)
皂苷广泛存在于植物不同器官,具有降血脂、抗氧化、抗肿瘤及抗植物病毒等作用,为近年来倍受关注且极具开发潜力的植物次生代谢产物之一[1]。
垂序商陆(PhytolaccaamericanaLinn.)隶属于商陆科(Phytolaccaceae)商陆属(PhytolaccaLinn.),为多年生草本植物,其根具有逐水消肿、通利二便及解毒散结的药效。垂序商陆具一定毒性,服用不当会引起腹痛和腹泻等不良反应,因此作为中药材使用时,需对其进行炮制等前处理并准确控制用量。垂序商陆对人体的毒性主要由于其所含的商陆皂苷A、商陆皂苷B和商陆皂苷C等皂苷类物质所致,这些物质可引发炎症、溶血和细胞生理活动异常[2-5]。此外,垂序商陆皂苷对其他动物(如血吸虫寄主钉螺)以及植物病毒(如烟草花叶病毒)等也具有一定灭杀或抑制效应,这使其在生物农药等植物源生物防治剂的应用及产品开发领域表现出极大潜力[6-7]。目前,关于垂序商陆皂苷提取及其对特定作物害虫灭杀效果的研究极少,且研究部位集中在根部,而更易获取、前处理更简单、且生物量巨大的叶片则作为废弃物被舍弃,因此,挖掘垂序商陆叶片中皂苷的潜在价值,对其开发利用具有重要的经济和社会效益。
目前,研究者主要采用乙醇多次回流的方法提取植物总皂苷,但该方法存在提取次数多、耗时长等不足,这主要因为植物细胞壁增加了细胞破碎的难度并阻碍了细胞内植物活性物质的释放[8-9]。纤维素酶可水解细胞壁中的主要成分纤维素,使细胞壁疏松甚至破裂和崩解,减小活性物质向胞外释放的传质阻力。微波具有穿透力强、细胞破碎效果好和对提取物破坏小等优点,可有效减少溶剂用量、缩短提取时间、提高提取得率。近年来,纤维素酶和微波提取以及二者协同作用被越来越多应用于植物活性物质的提取[8-10]。植物叶片中活性物质含量随地区、部位、株龄和月份等不同而异[11-14],弄清垂序商陆叶片中皂苷含量随月份的波动规律可为叶片科学采摘提供指导。为此,本文摸索了垂序商陆叶片总皂苷的纤维素酶-微波协同提取条件,分析了叶片总皂苷含量随月份的动态变化规律,测试了总皂苷提取物对常见害虫小菜蛾〔Plutellaxylostella(Linn.)〕的灭杀效果,以期为垂序商陆叶片的开发利用提供理论依据。
1 材料和方法
1.1 材料
于2016年4月选取湖南科技学院附近空地长势基本一致的40株野生垂序商陆挂牌标记,注明其科研用途进行保护。分别于2016年4月至10月的每月20日进行叶片采摘,每次随机选取5株,被采样后的植株不再进行后续采样。用剪刀从植株中下部叶(不包括新叶)的基部剪断,去叶柄后混合,迅速带回实验室,清洗沥干后于60 ℃烘干至恒质量,研磨过80目筛后密封保存、备用。
主要试剂和仪器:纤维素酶(15 U·mg-1,上海展云化工有限公司),齐墩果酸标准品(纯度大于等于98%,上海源叶生物科技有限公司),其他试剂均为分析纯。JP-300B高速多功能粉碎机(永康市久品工贸有限公司),BSA124S电子天平〔赛多利斯科学仪器(北京)有限公司〕,HH-W600恒温水浴锅(金昌实验仪器厂),XH-MC-1微波合成反应仪(北京金阳万达科技有限公司),UV-2400紫外分光光度计(上海舜宇恒平科学仪器有限公司),SHZ-D循环水真空泵(巩义市予华仪器有限责任公司),RF52-A旋转蒸发仪(上海亚荣生化仪器厂),DGG-9053AD电热恒温鼓风干燥箱(上海森信实验仪器有限公司)。
1.2 方法
1.2.1 叶片总皂苷提取条件的筛选
1.2.1.1 标准曲线绘制 参考文献[15]绘制标准曲线。精密称取齐墩果酸标准品10.0 mg,用甲醇定容至100 mL,得到质量浓度0.1 mg·mL-1齐墩果酸标准溶液。吸取200 μL齐墩果酸标准溶液置于具塞试管中,水浴挥干,加入质量体积分数5%香草醛-冰乙酸溶液0.2 mL,高氯酸0.8 mL,70 ℃水浴15 min,显色后用冰水冷却10 min,加冰乙酸5.0 mL,摇匀,随行试剂作空白,于波长400~700 nm下进行全波长扫描,确定最大吸收波长为540 nm,并记录吸光度值。在此基础上,分别吸取50、100、300、400和500 μL齐墩果酸标准溶液,按照上述步骤,分别测定在波长540 nm下的吸光度值。所有实验重复3次,以齐墩果酸标准溶液质量浓度为横坐标(X)、吸光度值为纵坐标(Y)得到标准曲线Y=0.180X+0.004,R2=0.999[15]。
1.2.1.2 总皂苷的提取及含量测定 选取7月份垂序商陆叶片样品进行提取。参考文献[8-9,16]并结合纤维素酶的特性及预实验,确定提取反应体系的料液比1∶15、纤维素酶作用温度50 ℃、pH 4.5。称取上述垂序商陆叶片样品5.0 g,加入体积分数75%乙醇75 mL,再加入一定量的纤维素酶,在50 ℃和pH 4.5条件下处理一定时间后,再在一定的微波提取时间和微波功率下进行总皂苷提取,之后趁热抽滤并用甲醇定容滤液至100 mL,待测。
精密吸取200 μL总皂苷提取液置于具塞试管中,65 ℃水浴挥干,按照上述方法在波长540 nm下测定吸光度值并根据标准曲线方程计算总皂苷提取液质量浓度,根据总皂苷提取液质量浓度和定容后体积计算总皂苷含量(C1),并根据公式“总皂苷得率=(C1/5.0)×100%”计算总皂苷得率。
1.2.1.3 单因子实验和正交实验 分别考察纤维素酶用量、纤维素酶作用时间、微波提取时间和微波功率4个因子对垂序商陆叶片总皂苷得率的影响,其中,纤维素酶用量分别为0.02、0.04、0.06、0.08、0.10和0.15 g·g-1,纤维素酶作用时间分别为40、60、80、100、120和150 min,微波提取时间分别为5、15、25、35、45和55 s,微波功率分别为100、200、300、400、500和600 W。进行某一单因子实验时,其他因子保持不变,分别为纤维素酶用量0.06 g·g-1、纤维素酶作用时间100 min、微波提取时间35 s和微波功率400 W。根据单因子实验结果,分别选取4个因子的3个较好水平进行L9(34)正交实验。所有单因子实验及正交实验均重复3次。并对最佳提取条件重复3次。
1.2.2 总皂苷提取物杀虫活性的测试方法 参照文献[17]测试总皂苷提取物的杀虫活性。将5月、7月和9月的垂序商陆叶片总皂苷提取液减压浓缩至稠膏状,于40 ℃烘干至恒质量,然后分别称取适量,加入少量丙酮和质量体积分数1%吐温80,完全溶解后用无菌水稀释至总皂苷提取物质量浓度为5.0 mg·mL-1,备用。吸取2份7月的待测液,用无菌水分别稀释至总皂苷提取物质量浓度为1.0和2.5 mg·mL-1,备用。供试小菜蛾幼虫(1~2龄)采自湖南科技学院周边菜地未喷过农药的白菜(Brassicarapavar.glabraRegel)叶片,室内适应性饲养后,挑选形态大小基本一致的小菜蛾幼虫进行实验。将面积5 cm×5 cm的新鲜白菜嫩叶在质量浓度1.0和2.5 mg·mL-1总皂苷提取物溶液中分别浸泡10 s后取出,挥干后放入垫有湿润滤纸的培养皿中,每皿5片,接入经过饥饿处理的小菜蛾,每皿10头,每24 h更换1次叶片。以随行试剂作为空白对照,所有实验均重复3次,分别于接入12、24、48、72和96 h统计小菜蛾的死亡总数,并根据公式“校正死亡率=〔(对照组生存率-处理组生存率)/对照组生存率〕×100%”[17]计算校正死亡率,其中,生存率根据公式“生存率=〔1-(处理后小菜蛾死亡数/供试小菜蛾数)〕×100%”计算。
1.3 数据处理
采用EXCEL 2003和SPSS 19.0统计分析软件进行数据整理和分析,采用SigmaPlot 10.0软件制图。
2 结果和分析
2.1 垂序商陆叶片总皂苷提取条件的筛选结果
单因子实验结果(图1)显示:纤维素酶用量、纤维素酶作用时间、微波提取时间和微波功率均对垂序商陆叶片总皂苷得率有明显影响。随着纤维素酶用量、纤维素酶作用时间、微波提取时间和微波功率的增加,总皂苷得率先急剧增加然后趋于稳定,即当纤维素酶用量为0.08 g·g-1、纤维素酶作用时间为120 min、微波提取时间为25 s以及微波功率为500 W时,总皂苷得率不再增加或增加幅度不明显。
正交实验结果(表1)显示:4个因子对垂序商陆叶片总皂苷得率的影响由大到小依次为纤维素酶用量、微波功率、纤维素酶作用时间、微波提取时间,最佳提取条件为纤维素酶用量0.08 g·g-1、纤维素酶作用时间100 min、微波提取时间35 s和微波功率400 W。最佳提取条件的验证结果显示:该条件下垂序商陆叶片总皂苷得率为2.53%。

图1 纤维素酶用量(A)、纤维素酶作用时间(B)、微波提取时间(C)和微波功率(D)对垂序商陆叶片总皂苷得率的影响Fig. 1 Effects of cellulase dosage (A),cellulase action time (B),microwave extraction time (C),and microwave power (D) on yield of total saponins from Phytolacca americana Linn. leaves
表1纤维素酶-微波协同提取垂序商陆叶片总皂苷正交实验结果1)
Table1ResultoforthogonaltestontotalsaponinsfromPhytolaccaamericanaLinn.leavesbycellulase-microwaveassistedextraction1)
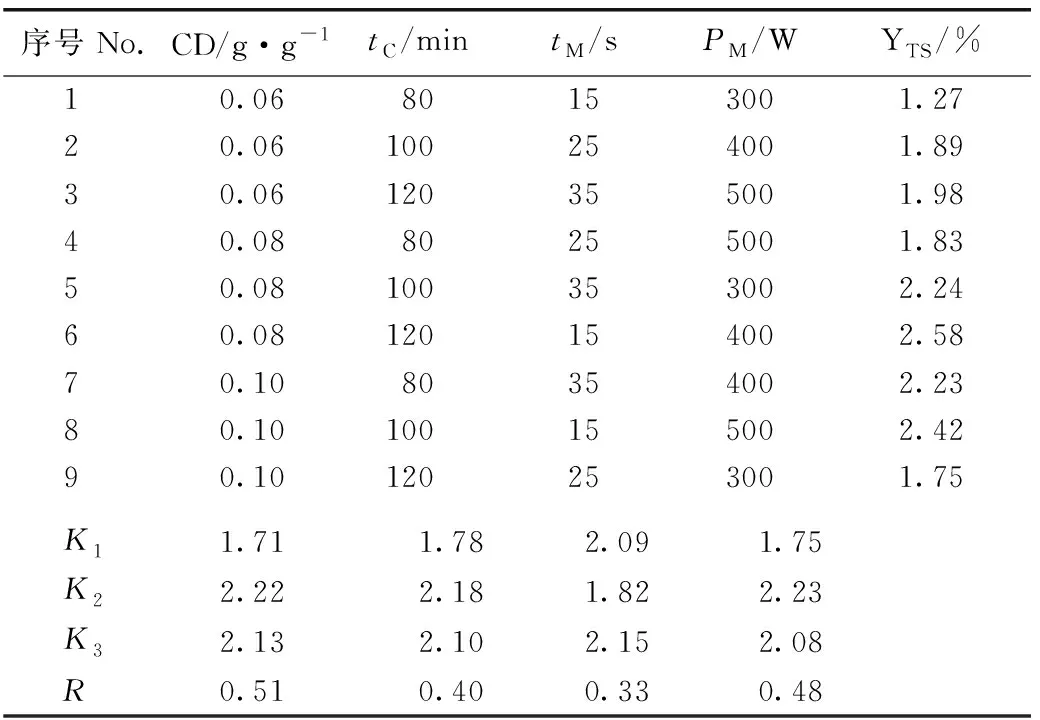
序号No.CD/g·g-1tC/mintM/sPM/WYTS/%10.0680153001.2720.06100254001.8930.06120355001.9840.0880255001.8350.08100353002.2460.08120154002.5870.1080354002.2380.10100155002.4290.10120253001.75K11.711.782.091.75K22.222.181.822.23K32.132.102.152.08R0.510.400.330.48
1)CD:纤维素酶用量Cellulase dosage;tC:纤维素酶作用时间Cellulase action time;tM:微波提取时间Microwave extraction time;PM:微波功率Microwave power;YTS:总皂苷得率Yield of total saponins.
2.2 垂序商陆叶片总皂苷含量的动态变化分析
垂序商陆叶片总皂苷含量的动态变化见图2。由图2可以看出:4月至10月,垂序商陆叶片总皂苷含量呈“升高—稳定—降低”的变化趋势。其中,4月至8月,垂序商陆叶片总皂苷含量呈逐渐升高的趋势,其中4月至5月总皂苷含量的增幅较小,5月至6月总皂苷含量的增幅最大,8月时总皂苷含量达到最高;8月至9月总皂苷含量维持稳定,之后总皂苷含量急剧下降。
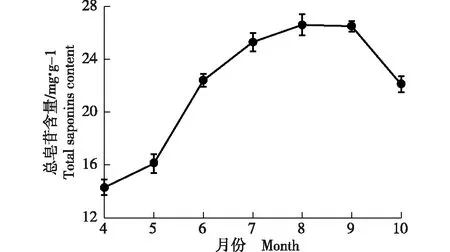
图2 垂序商陆叶片总皂苷含量的动态变化Fig. 2 Dynamic change of total saponins content in Phytolacca americana Linn. leaves
2.3 垂序商陆叶片总皂苷提取物对小菜蛾的灭杀效果分析
垂序商陆叶片(7月)总皂苷提取物对小菜蛾的灭杀效果见图3。由图3可以看出:质量浓度1.0、2.5和5.0 mg·mL-1总皂苷提取物对小菜蛾均具有明显灭杀活性,且总皂苷提取物质量浓度越高,对小菜蛾的灭杀效果越好。不同质量浓度总皂苷提取物处理12 h,小菜蛾的校正死亡率为0.0%。质量浓度5.0和2.5 mg·mL-1总皂苷提取物处理24 h,以及质量浓度1.0 mg·mL-1总皂苷提取物处理48 h后小菜蛾出现死亡。随处理时间的延长,不同质量浓度总皂苷提取物处理组小菜蛾的校正死亡率逐渐升高,且在处理24~72 h增幅较大,处理72 h之后增幅明显减缓。处理96 h时,质量浓度5.0 mg·mL-1总皂苷提取物处理组小菜蛾校正死亡率达73.3%,远高于质量浓度2.5和1.0 mg·mL-1总皂苷提取物处理组(校正死亡率分别为36.7%和16.7%)。
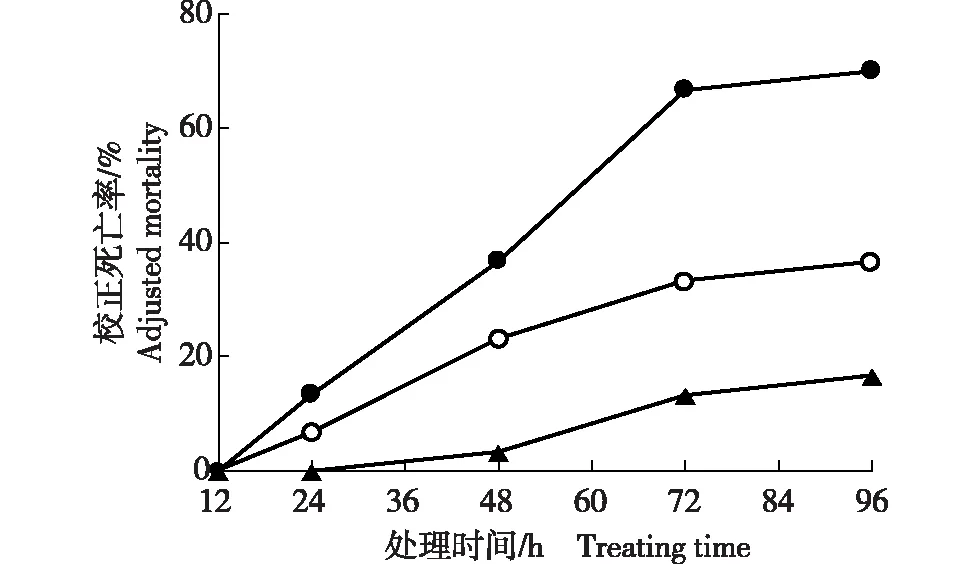
:5.0 mg·mL-1;:2.5 mg·mL-1;:1.0 mg·mL-1.图3 垂序商陆叶片(7月)总皂苷提取物对小菜蛾的灭杀效果Fig. 3 Insecticidal effect of total saponins extract from Phytolacca americana Linn. leaves (July) against Plutella xylostella (Linn.)

:5月May;:7月July;:9月September.图4 不同月份垂序商陆叶片总皂苷提取物对小菜蛾的灭杀效果Fig. 4 Insecticidal effect of total saponins extract from Phytolacca americana Linn. leaves in different months against Plutella xylostella (Linn.)
不同月份垂序商陆叶片总皂苷提取物对小菜蛾的灭杀效果见图4。由图4可以看出:7月和9月垂序商陆叶片总皂苷提取物处理24~96 h,小菜蛾的校正死亡率均高于5月。处理72 h内,9月垂序商陆叶片总皂苷提取物的灭杀效果较7月更佳,但处理72 h后,两者的灭杀效果达到一致。随处理时间的延长,5月、7月和9月垂序商陆叶片总皂苷提取物对小菜蛾的灭杀活性均呈逐渐升高的趋势。
3 讨论和结论
垂序商陆的根、茎和叶等器官在生长过程中会累积皂苷类物质,叶片中皂苷主要富集于叶肉细胞[18]。本研究中,4月至8月垂序商陆叶片中总皂苷含量持续升高,其中5月至6月总皂苷含量增幅最大;8月总皂苷含量达到峰值后,保持稳定;9月之后总皂苷含量急剧下降。推测可能与不同月份外界光照和温度等环境因子的差异,以及叶片作为光合器官,在植株一年生长周期中,需不断调节细胞主代谢与次生代谢间平衡以满足生命活动需要有关[18-20]。建议8月至9月采摘垂序商陆叶片提取皂苷。
传统的浸提法存在溶剂量大、耗时长及提取率低等不足,因此,需建立从叶片中快速、高效提取垂序商陆皂苷的工艺。微波具有很好的穿透与破碎作用,纤维素酶可有效分解覆盖于植物细胞最外层的细胞壁,二者协同作用可在植物活性物质提取上发挥显著效应。纤维素酶与微波协同提取工艺具有溶剂消耗更少、所需时间更短且提取得率可观等优点[8,10,15,21]。本研究获得的垂序商陆叶片总皂苷的最佳提取条件为纤维素酶用量0.08 g·g-1、纤维素酶作用时间100 min、微波提取时间35 s和微波功率400 W,该条件下叶片总皂苷得率达2.53%。垂序商陆叶片的皂苷提取得率低于根部可能与叶片中皂苷含量低于根部有关[18]。由于垂序商陆叶片较根更易获取且生物量大,因此,本研究结果为其后续开发奠定了基础。
垂序商陆对稠李巢蛾和朱砂叶螨等农业害虫等均有一定的灭杀效果[4-7]。近年来,人们开始关注其在农业病虫害防治中的应用及生物农药开发。虽然垂序商陆对农业害虫产生毒性的物质及作用机制还未阐明,但普遍认为皂苷类物质在其中发挥了重要作用[3,22-24]。本研究认为,垂序商陆叶片总皂苷提取物可有效灭杀小菜蛾,而较低质量浓度总皂苷提取物的灭杀效果不佳,说明与其他用于生物农药开发的植物活性成分一样,垂序商陆皂苷对农业害虫存在致死浓度的临界阈值[25]。本研究中,灭杀效果随处理时间的延长还表现出一定的时相特征,药效作用集中在处理24~72 h,之后的灭杀效果不明显。推测垂序商陆叶片总皂苷被摄入小菜蛾体内后,被迅速吸收并与受体结合,导致细胞基因表达或生理生化反应异常。上述研究结果可为后续生物农药配方中皂苷浓度的确定及生物农药的施用等提供参考依据。
不同月份垂序商陆叶片总皂苷提取物在相同质量浓度条件下对小菜蛾的灭杀效果存在明显差异,推测不同月份叶片中皂苷的组分及含量可能存在差异,即不同皂苷成分由于其结构、性质、含量,以及膜受体数量和信号传导途径等存在差异导致灭杀效果不同。垂序商陆中商陆皂苷A、商陆皂苷B和商陆皂苷C含量的变化及不同皂苷组分之间的物质转化均会影响其毒性[18]。推测不同月份垂序商陆叶片中商陆皂苷A、商陆皂苷B和商陆皂苷C等物质的含量可能存在差异,且不同皂苷种类随月份变化发生相互转化[2]。
为更好地开发利用垂序商陆皂苷,还需对提取的总皂苷进行纯化及组分与含量分析,以明确其在农业病虫害防治中发挥关键作用的具体成分,为生物农药的开发提供准确的目标物;同时,还需进一步深入研究垂序商陆皂苷在害虫体内作用的受体、相关信号传导途径以及引发的生理生化响应等,揭示其作用机制。
参考文献:
[1] 李 佳,王成章,严学兵,等. 植物皂苷生物活性研究进展[J]. 草业科学,2012,29(3):488-494.
[2] 郁红礼,张程超,吴 皓,等. 醋制对商陆及商陆正丁醇部位中皂苷类成分含量的影响[J]. 中国中药杂志,2017,42(1):125-129.
[3] YU H,GONG L,WANG X,et al. Rabbit conjunctivae edema and release of NO,TNF-α,and IL-1βfrom macrophages induced by fractions and esculentosides isolated fromPhytolaccaamericana[J]. Pharmaceutical Biology,2016,54(1):98-104.
[4] 崔楠楠,孟祥龙,马俊楠,等. 商陆皂苷甲急性毒性与利尿作用研究[J]. 医药导报,2014,33(8):981-984.
[5] 肖振宇,张俊平,陆 峰,等. 商陆皂苷甲对细胞间粘附的影响[J]. 药学学报,2003,38(10):728-730.
[6] 房伟伟,陈 钧,韩邦兴,等. 垂序商陆叶灭螺活性及其毒性的初步研究[J]. 中国血吸虫病防治杂志,2011,23(4):449-452.
[7] 葛永辉,罗焕平,郑 钰,等. 商陆中三萜皂苷类成分抗烟草花叶病毒活性研究[J]. 农药学学报,2015,17(3):300-306.
[8] 吕凤娇,谢晓兰. 响应面法优化纤维素酶辅助提取黄芪总皂苷的工艺研究[J]. 福州大学学报(自然科学版),2015,43(3):398-404.
[9] 王慧竹,陈 帅,朱 岩,等. 纤维素酶-微波辅助法提取金樱子总皂苷的工艺研究[J]. 中国酿造,2016,35(3):84-88.
[10] 房信胜,王建华,祝丽香. 微波辅助提取酸枣仁皂苷A的工艺优化[J]. 林产化学与工业,2010,30(1):92-96.
[11] 张 英,吴晓琴,俞卓裕. 竹叶黄酮和内酯的季节性变化规律研究[J]. 林产化学与工业,2002,22(2):65-69.
[12] 孙化鹏,阮琴妹,曹雄军,等. 洋常春藤皂苷类化合物代谢累积规律研究[J]. 中草药,2016,47(16):2916-2920.
[13] 曾 燕,郭兰萍,杨 光,等. 环境生态因子对药用植物皂苷成分的影响[J]. 中国实验方剂学杂志,2012,18(17):313-318.
[14] 张 涛,张育松,张顺萍,等. 我国10个省区绞股蓝的皂苷含量分析[J]. 热带作物学报,2008,29(6):814-817.
[15] 易运红,吴功庆,王莲婧,等. 金樱根总皂苷的超声提取工艺研究[J]. 食品工业科技,2011(5):270-272.
[16] 张春红,许 宁,吴 双,等. 纤维素酶-微波辅助提取软枣猕猴桃茎黄酮的工艺优化[J]. 食品科学,2012,33(8):24-28.
[17] 蒋 妮,缪剑华,谢保令. 商陆等6种药用植物粗提物对扶芳藤稠李巢蛾的杀虫活性[J]. 中国农学通报,2006,22(10):297-299.
[18] 贺 敏. 商陆和垂序商陆的结构发育与商陆皂苷甲积累关系的研究[D]. 西安:西北大学生命科学学院,2012:16-18.
[19] 许云章,任 烨,王静霞,等. 不同生长年限、不同采收月份加拿大原产地西洋参根中9种人参皂苷和2种拟人参皂苷含量动态变化研究[J]. 中草药,2014,37(10):1743-1748.
[20] 郑名敏. 雪莲果块根糖分组成及叶片总黄酮含量动态变化研究[D]. 成都:四川农业大学玉米研究所,2009:26-27.
[21] 欧阳凯,何先元,陈 飞,等. 四齿四棱草总皂苷提取工艺优化及抗氧化性研究[J]. 食品与机械,2016,32(7):141-145.
[22] 吴 飞. Ⅰ、商陆皂苷甲衍生物的合成及其构效关系研究 Ⅱ、活化新型开链核苷类似物的合成[D]. 上海:第二军医大学药学院,2007:10-15.
[23] 宫 乐,吴 皓,郁红礼,等. 商陆提取物醋制前后毒性作用的比较研究[J]. 中国中药杂志,2013,38(10):1610-1613.
[24] 张程超,郁红礼,吴 皓,等. 商陆正丁醇部位醋制前后肠道毒性变化研究[J]. 中国中药杂志,2016,41(2):216-219.

