基于rDNA-ITS和组蛋白3基因序列分析鉴定新疆棉花叶斑病病原
2018-06-06李映程张国丽任毓忠李海强武刚李天义李国英张莉
李映程 ,张国丽 ,任毓忠 ,李海强 ,武刚 ,李天义 ,李国英 *,张莉 *
(1.石河子大学农学院/新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室,新疆石河子832003;2.新疆农垦科学院生物技术研究所,新疆石河子832000;3.新疆农业科学院植物保护研究所,乌鲁木齐830000;4.新疆生产建设兵团第一师农业科学研究所,新疆阿拉尔843300;5.新疆塔里木河种业股份有限公司,新疆阿拉尔843300)
棉花叶斑病在世界各大植棉区普遍发生,也是我国棉花上的1种常见病害,其中链格孢菌(Alternariaspp.)是引起叶斑病的1类重要病原。但各地报道引起叶斑病的链格孢菌种类存在较大差异。Sciumbato等[1]1972年报道印度棉花轮纹斑病是由Alternaria macrospora引起的。在美国密苏里州(Missouri)、路易斯安那州(Louisiana)以及以色列,该病也是由A.macrospora造成的;原苏联棉区发生的叶斑病主要由大孢链格孢(A.macrospora)和棉链格孢菌(A.gossypina)引起[2];Palmateer等2000年和2001年调查美国亚拉巴马州(Alabama)陆地棉叶斑病,最常见的病原为A.alternata[3]。我国棉花轮纹斑病病原以大孢链格孢(A.macrocpora)、细极链格孢(A.tenuissima)和棉链格孢(A.gossypina)等为常见种,最常见的为大孢链格孢(A.macrospora)[4-5]。张文蔚等从北京、天津、新疆、山东、河北、河南、江苏等地采集17份叶斑病样品鉴定,16份为A.alternata,只有1份从天津棉田采集的为A.macrospora[6]。陈凯等鉴定河南省洛阳市、三门峡市、周口市和河南省农业科学院棉田(郑州市)发生的棉花叶斑病由A.tenuissima引起[7]。
新疆是我国最大的棉区,属典型的大陆性气候,春季常有明显的倒春寒,秋季降温快,是我国棉花叶斑病的常发区[8],但对其病原尚未进行较为系统的调查和鉴定,为此开展了本研究。
1 材料与方法
1.1 病害调查、病样采集及症状描述
2016年在棉花苗期和中后期,棉花叶斑病分别在石河子和阿克苏植棉区大发生。为此于2016年和2017年,以北疆石河子和南疆阿克苏(主要种植陆地棉,也种植长绒棉)为主,分别对北疆石河子、昌吉、博乐、阿勒泰和南疆阿克苏、喀什、和田等7个地区30个地点的棉花叶斑病发生情况进行了调查,并采集典型症状的病样206份,供分离鉴定。同时对田间症状和接种后的症状进行现场观察和描述。
1.2 病原分离、纯化及代表性菌株的选择
采用常规组织分离法,即将所采病样经流水冲洗后,从病健交界处剪取4~5 mm2的组织块,用0.1%(质量分数)升汞消毒5~10 s,无菌水漂洗3次后,用无菌吸水纸吸干表面水分,置于马铃薯葡萄糖琼脂培养基 (Potato dextrose agar medium,PDA)上,25℃恒温培养 2 d后,挑取菌落边缘菌丝进行纯化;并根据病样采集时间、地点、分离菌株的数量及菌落的培养特征,按南疆、北疆分苗期(5―6月份采样)和生长中后期(主要在8―9月份,个别在7月上旬采样),各选取10个代表性菌株(共40个代表性菌株),4℃保存在PDA上,供鉴定用。
1.3 病原致病性测定
采用离体叶片接种法。采集植株相同部位的健康叶片,清洗干净,用75%(体积分数)酒精轻轻擦拭叶片表面,消除杂菌,4℃处理24 h后供接种用。接种前用少量无菌水洗下在PDA上培养7 d的分生孢子,用血球计数板按常规方法配制每毫升1×107个分生孢子的悬浮液,采用喷雾法进行接种,重复3次,以无菌水为对照。接种结束后,将其置于12 cm×12 cm、垫有湿润无菌滤纸的发芽盒中,放入白天18℃、夜间12℃的智能光照培养箱中,定期观察并记录发病情况。发病后,观察其症状并进行分离和镜检,明确与原接种菌的异同。
1.4 病原鉴定
1.4.1形态学鉴定。用刀片直接刮取病斑处的分生孢子,观察其形态、颜色并记录分生孢子的纵横膈膜数,测量50个分生孢子的大小。挑取纯化后的供试菌株在PDA上培养5 d,观察并描述菌落形态和颜色。采用常规玻片培养法,25℃下培养5 d,观察、记录其分生孢子的着生状态并拍照,作为病原鉴定的主要形态学依据,参照《中国真菌志》(第十六卷)链格孢属[9]对病原进行鉴定。
1.4.2分子生物学鉴定。用灭菌刀片刮取在PDA上25℃培养7 d的各供试菌株的菌丝体。用BioFlux试剂盒提取供试菌株的基因组DNA。参照Kusaba等[10]和王洪凯等[11]报道,用真菌内转录间隔区(Internal transcribed spacer,ITS)通用引物[ITS1 (5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3'),由上海生物工程股份有限公司合成]进行聚合酶链式反应(Polymerase chain reaction,PCR),反应程序:94℃预变性5 min;94℃变性50 s,56℃退火40 s,72℃延伸1 min,共35个循环;最后72℃延伸10 min,反应体系为 25 μL;参照王泰云等[12]、杨超等[13]的报道,用组蛋白3基因扩增引物[H3-1a(5'-ACTAAGCAGACCGCCCGCAGG-3')和H3-1b(5'-GCGGGCGAGCTGGATGTCCTT-3'),由上海生物工程股份有限公司合成]进行PCR,反应程序:96℃预变性 2 min;96℃变性 15 s,55℃退火30 s,75℃延伸 35 s,共 30个循环;最后 72℃延伸 2 min,反应体系为 25 μL。
2对引物的PCR扩增产物,分别用1%(质量分数)的琼脂糖凝胶电泳检测,在凝胶成像仪上观察并拍照。在ZF-90型多功能暗箱式紫外透射仪下切取目的片段,使用全式金凝胶回收试剂盒(Easy Pure Quick Gel Extraction Kit)回收目的片段。纯化后与pMD19-T载体连接,转入大肠杆菌DH5α。PCR检测筛选阳性克隆,送到上海生物工程有限公司测序。
测序结果在NCBI上进行Blast比对,应用MEGA 5.0软件中的临近法(Neighbor-Joining,NJ)构建病原系统发育树,分析菌株间的亲缘关系,确定病原分类地位。
2 结果与分析
2.1 棉花叶斑病发病情况的调查和症状描述
2016年和2017年在南北疆植棉区调查发现,该病在新疆整个生长期虽然都可发生,但主要在棉花苗期和生长后期发生较重。不同时期、不同年份和不同地区间发病情况有较大差异。如2016年春季,北疆棉区由于持续低温多雨,棉花苗期叶斑病大发生,发病率高达100%,明显抑制幼苗生长和发育;8月下旬南疆阿克苏地区遭遇冰雹,之后叶斑病大发生,不少棉田棉花一片枯焦,严重影响产量。2017年由于苗期和生长后期气候比较正常,该病发生相对较轻。
无论是陆地棉还是长绒棉,苗期子叶、真叶均可发病,发病初期子叶和真叶上均产生紫红色或褐色、中部稍凹陷的小型斑点,后逐渐扩大成外缘红褐色或褐色、圆形或不规则形、直径2~3 mm的病斑,严重时病斑彼此连接成片,形成大型的褐色枯死斑,导致叶片焦枯、脱落。生长后期发病的症状和苗期基本相同,均主要为害叶片产生叶斑,典型的轮纹很少,只有在条件非常有利发病的情况下才会出现。据在阿克苏地区调查,该病在长绒棉上发生一般重于陆地棉,在长绒棉上不仅感染叶片,还感染苞叶,并在茎秆上产生细长的梭状条斑。
供试菌株接种后的症状和田间症状相同,主要在叶片产生斑点,极少产生典型的轮纹。
2.2 病原分离及代表性菌株的选择
从南疆、北疆所采集的206份典型叶斑病样中,成功分离出180个链格孢属(Alternariaspp.)菌株,分离率达87.4%。选取40个代表性菌株供病原鉴定。其中,1~20号为北疆病样(1~10为苗期,11~20为生长中后期),21~40为南疆病样(21~30为苗期,31~40为生长中后期)。具体情况见表1。
2.3 病原致病性测定
室内接种5 d后,叶片开始出现黑褐色斑点,症状与自然病害症状相似,40个代表性菌株均会引起叶片发病,对照组棉花叶片则未出现症状。从发病组织中再次分离的菌株与原接种菌形态特征一致。根据柯赫氏法则,40个代表性菌株均具有致病性。
2.4 病原鉴定
2.4.1形态学鉴定。经形态观察,初步可将供试菌株分为3类。第1类包括1~6、19和20号,共8个菌株,在PDA培养基上培养,初期菌落灰白色,后期中央略微隆起,褐色或深褐色,毛毡状,基质浅褐色至褐色。分生孢子梗单生或簇生,直立或弯曲;分生孢子单生或2~11个串生,具3~7个横膈,2~4个纵膈或斜膈,大小(12.5~35.0)μm×(5.0~12.5)μm,黄褐色或褐色,棒形、倒梨形;有喙或无喙,喙锥形或短柱状,(2.0~12.5)μm×(1.5~4.5)μm。 初步鉴定为A.alternata(图1 A1、A2、A3)。
第2类包括 7~10、12~18、21~30 和31~36号,共27个菌株,其形态和第1类比较相似,在PDA培养基上培养,菌落初期灰白色,后期中央略微隆起,灰白色至深灰绿色或深橄榄绿色,绒毛状,基质浅褐色至褐色。分生孢子梗单生或簇生,直立或曲膝状弯曲;分生孢子倒棍棒形、卵圆形或近椭圆形,淡褐色至暗褐色,单生或7~15个串生,具4~7个横膈,2~7个纵膈或斜膈,大小 (17.5~50.0)μm×(5.0~15.5)μm; 有喙或无喙,喙锥形或短柱状,大小 (2.5~15.0)μm×(2.5~4.5)μm。 初步鉴定为A.tenuissima(图 1 B1、B2、B3)。

表1 菌株样品编号及来源Table 1 Number and source of strain samples

表1(续)Table 1 (Continued)

图1 链格孢(A1、A2、A3)、细极链格孢(B1、B2、B3)和大孢链格孢(C1、C2、C3)菌落、分生孢子及着生方式Fig.1 Colonies,sub spore and the mode of production ofA.alternata(A1,A2,A3),A.tenuissima(B1,B2,B3)and A.macrospora (C1,C2,C3)
第3类包括11和37~40号,共5个菌株,其孢子形态和着生方式和前2类有明显区别。在PDA培养基上培养,菌落初期灰白色,后期中央略微隆起,灰褐色,绒毛状,基质褐色或深橄榄绿色。分生孢子梗单生或簇生,直或弯曲;分生孢子多单生或少数2个串生,具6~10个横膈,1~6个纵膈或斜膈,大小(49.8~110.6)μm×(15.0~40.3)μm;顶端有细长的喙,喙浅褐色至近无色,长度超过孢子的一半,大小(30.5~135.0)μm×(2.0~4.5)μm。 初步鉴定为A.macrospora(图 1 C1、C2、C3)。
2.4.2分子生物学鉴定。采用真菌通用引物ITS1/ITS4对病原基因组DNA进行扩增,11号和37~40号菌株扩增出582 bp的片段,剩余其他35个菌株扩增出 569 bp的片段 (图 2),经BLAST比对,11号和37~40号菌株序列与Gen-Bank中A.macrospora(登录号AY154689.1和DQ156342.1)同源性达99%。而其他菌株与A.al-ternata(登 录 号 KT384278.1、KY814634.1、KY788019.1和MG195995.1)的同源性达100%,与A.tenuissima(登录号 KF280456.1、KY788031.1、KT384277.1和MG250391.1)的同源性也达100%,无法确定其归属。因此,结合病原形态学特征,确认11号和37~40号菌株为A.macrospora。

图2 供试病原菌ITS区PCR扩增Fig.2 The results of the PCR of pathogen’s ITS
通过构建系统进化树发现,分析rDNA-ITS区序列,可以将大孢子种A.macrospora与小孢子种中的A.alternata和A.tenuissima区分,但无法将小孢子种A.alternata和A.tenuissima区分(图 3)。
采用组蛋白3基因扩增引物H3-1a/H3-1b对病原基因组DNA进行扩增,1~6号和19号菌株扩增出494 bp的片段,20号菌株扩增440 bp的片段,7~10号、11~18号、21~30号和 31~40号菌株扩增出 546 bp的片段 (图 4)。经BLAST比对显示,1~6号和19号与A.alternata(AF404620、KF997067 和 KR866858) 相似性达99%;20 号菌株与A.alternata(KF280540.1)相似性达 100%;7~10号、12~18号、21~30号和31~36号菌株与A.tenuissima(KT384348.1)相似 性 达 99%, 与A.tenuissima(KT384290.1、KT384354.1和KP267539.1)相似性达100%;而11号和37~40号菌株与A.alternata和A.tenuissima相似性都很高,说明组蛋白3基因扩增引物H3-1a/H3-1b,不能准确区分大孢子种和小孢子种。
由此,根据病原菌形态学特征,结合分子生物学鉴定,确认7~10号、12~18号、21~30号和 31~36 号菌株为A.tenuissima,1~6 号、19 号和20号菌株为A.alternata。
通过构建系统进化树发现,分析组蛋白3基因序列,很容易将小孢子种A.alternata和A.tenuissima分为2个类群,所有供试菌株与A.macrospora都不聚在一起(图 5)。
由此确认,此次采样的新疆棉花叶斑病的病原种类有3种,即A.alternata、A.tenuissima和A.macrospora,但各地链格孢属病原菌的种类有一定差别(表2),与内地报道的棉花叶斑病的病原种类也不完全相同[4-7]。
3 结论与讨论
经调查,棉花叶斑病在新疆棉花整个生长期都可发生,但主要发生在苗期和生长后期,此时如遇持续低温高湿的环境,则叶斑病发生较重。如2016年北疆春季遇持续低温高湿,苗期叶斑病发病率达100%,严重影响棉苗生长和发育;当年8月下旬后南疆阿克苏地区持续低温高湿,后期叶斑病大发生,不论是长绒棉还是陆地棉,都有不少棉田一片枯焦。正常气候条件下,该病在棉花生长中期很少发生;但若此时遇持续低温高湿的环境,特别是下冰雹之后,也会较重发生。如2016年6月末博州81团下冰雹之后,凡遭冰雹危害的棉花也发生较重的叶斑病。这种情况与新疆气候变化比较剧烈、春季常有明显的倒春寒、秋季降温快等因素有关。

图3 供试病原菌与相似种的ITS序列的发育树Fig.3 Dendrogram of ITS sequences of the pathogen and its related species
以形态学鉴定为基础,结合rDNA-ITS和组蛋白3基因序列分析,确定新疆棉花叶斑病的病原有 3种, 即A.alternata、A.tenuissima和A.macrospora,没有分离到棉链格孢A.gossypina。其中:北疆苗期(5―6月)棉花叶斑病的主要病原为A.alternata,占供测菌株的60%,次为A.tenuissima,占供测菌株的40%;生长后期(8―9月)棉花叶斑病的主要病原为A.tenuissima,占供测菌株的70%,次为A.alternata和A.macrospora,分别占供测菌株的20%和10%。南疆棉花苗期叶斑病的主要病原为A.tenuissima,占供测菌株的100%。南疆生长后期主要病原为A.tenuissima和A.macrospora,分别占供测菌株的60%和40%;其中,3个长绒棉品种上的病样(37~39号)病原全是A.macrospora,故生长后期长绒棉叶斑病的病原可能以A.macrospora为主,陆地棉以A.tenuissima为主,有待继续研究。
近年来研究证明,链格孢属级特征明显,种级特征变异较大,特别是链格孢属中小孢子组的成员,仅根据形态特征进行种的鉴定比较困难;因此,分子生物学方法越来越多地被应用。rDNA ITS区域介于18S rDNA、5.8S rDNA和 28S rDNA之间,进化速度较编码区快,可以为种间或种内的分子系统研究提供足够多的变异[14]。本研究基于rDNA-ITS可有效区分大孢子种A.macrospora与小孢子种A.alternata和A.tenuissima,而对于rDNA-ITS同源性超过98%的小孢子种A.alternata和A.tenuissima,通过分析组蛋白3基因序列可以较好地辨别。这与Wang等[12]、杨超等[13]研究结果一致。另外,新疆地域广阔,本研究采样点南疆以阿克苏为主,北疆以石河子为主,其他植棉区的叶斑病采样相对较少,且长绒棉叶斑病的采样也较少。因此,今后进一步研究时应注意合理确定采样地域及其分布。

图4 供试病原菌组蛋白H3基因PCR扩增
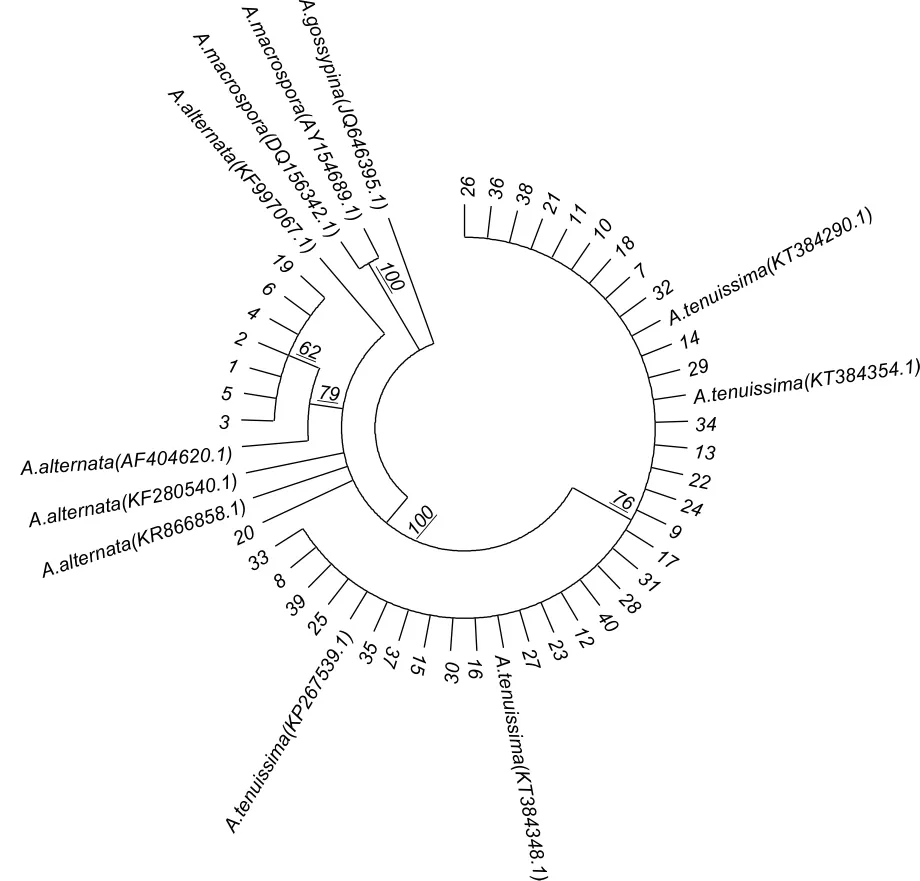
图5 供试病原菌与相似种组蛋白3基因序列的发育树Fig.5 Dendrogram of histone 3 gene sequences of the pathogen and its related species
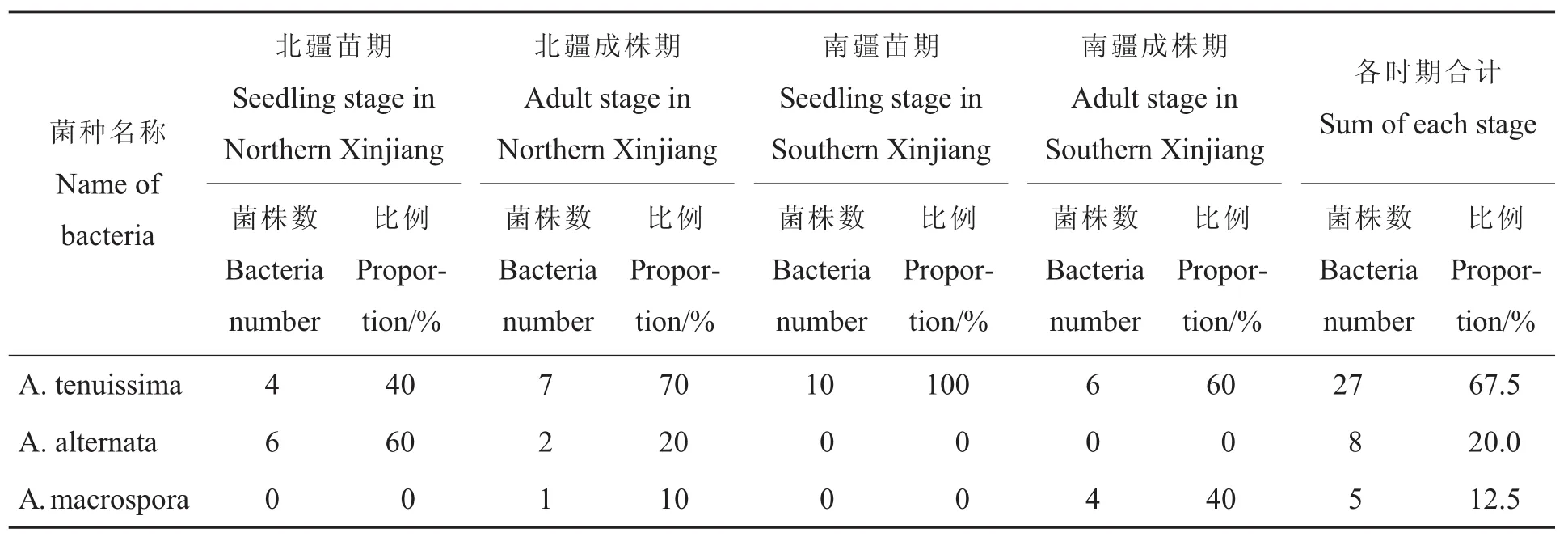
表2 3种病原菌在南疆、北疆棉花苗期和成株期所占比例Table 2 Proportion of three pathogenic bacteria at the seedling and adult stage of cotton in Northern and Southern Xinjiang
[1]Sciumbato G L,Pinckard J A.Leaf spot of cotton in Louisiana in 1972[J].Plant Disease Reporter,1974,58(3):201-208.
[2]Пересыпкин В Ф.Сельскохозяйственная фитопатология[M].Москва.Агропромиздат,1989.(俄文)
[3]Palmateer A J,Mc Lean K S,Morgan-Jones G,et al.Frequency and diversity of fungi colonizing tissues of upland cotton[J].Mycopathologia,2004,157(3):303-316.
[4]中国农业科学院植物保护研究所.中国农作物病虫害[M].北京:农业出版社,1979.Institute of Plant Protection of Chinese Academy of Agricultural Sciences.Crop diseases and insect pests in China[M].Beijing:China Agriculture Press,1979.
[5]中国农业科学院植物保护研究所,中国植物保护学会.中国农作物病虫害[M].3版.北京:农业出版社,2015.Institute of Plant Protection of Chinese Academy of Agricultural Sciences,China Society of Plant Protection.Crop diseases and insect pests in China[M].3th ed.Beijing:China Agriculture Press,2015.
[6]张文蔚,李莎,简桂良,等.中国部分棉区棉花轮纹斑病病原菌“种”的初步鉴定[J].棉花学报,2014,26(3):268-273.Zhang Wenwei,Li Sha,Jian Guiliang,et al.Preliminary identification ofAlternariaisolates from cotton in some cotton regions in China[J].Cotton Sciences,2014,26(3):268-273.
[7]陈凯,刘爱荣,吴尚英,等.棉花黑斑病病原鉴定及生防木霉菌株的筛选[J].湖北农业科学,2011,50(9):1793-1796.Chen Kai,Liu Airong,Wu Shangying,et al.Identification of pathogen causing cottonAlternarialeaf spot and screening of biocontrolTrichodermastrains[J].Hubei Agricultural Sciences,2011,50(9):1793-1796.
[8]李国英.新疆棉花主要病虫害及其防治[M].北京:中国农业出版社,2017.Li Guoying.Main diseases and insect pests of cotton in Xinjiang and its prevention and control[M].Beijing:China Agriculture Press,2017.
[9]张天宇.中国真菌志:第16卷:链格孢属[M].北京:科学出版社,2003.Zhang Tianyu.Chinese fungi annals:Vol.16:Alternaria[M].Beijing:Science Press,2003.
[10]Kusaba M,Tsuge T.Nuclear ribosomal DNA variation and pathogenic specialization inAlternariafungi known to produce host-specific toxins[J].Applied Environmental Microbiology,1994,60(9):3055-3062.
[11]王洪凯,张天宇,张猛.链格孢属真菌分类研究进展[J].山东农业大学学报(自然科学版),2001,32(3):406-410.Wang Hongkai,Zhang Tianyu,Zhang Meng.Advances on taxonomic studies of the genusAlternaria[J].Journal of Shandong Agricultural University(Natural Science),2001,32(3):406-410.
[12]Wang T Y,Zhao J,Sun P,et al.Characterization ofAlternariaspecies associated with leaf blight of sunflower in China[J].European Journal of Plant Pathology,2014,140:301-315.
[13]杨超,张国丽,任毓忠,等.北疆沿天山北坡一带葡萄穗轴褐枯病病原菌的鉴定[J].植物保护,2017(3):129-135.Yang Chao,Zhang Guoli,Ren Yuzhong,et al.Identification of the pathogens causing spike-stalk brown spot on grape on the northern slope of Tianshan Mountains area[J].Plant Protection,2017(3):129-135.
[14]侯丽冰,贺伟,刘小勇,等.我国几种松干锈菌亲缘关系的ITS序列分析[J].北京林业大学学报,2002,24:175-182.Hou Libing,He Wei,Liu Xiaoyong,et al.Sequence analysis of ITS region in relationships of Chinese isolates ofCronartium[J].Journal of Beijing Forestry University,2002,24:175-182.
