CD62P在过敏性紫癜和紫癜性肾炎中的变化和临床意义
2018-06-06叶乐珍康国贵
叶乐珍 康国贵★
HSP(Henoch-Schönlein purpur,HSP)是儿童时期最常见的系统性血管炎,临床常表现为双下肢典型皮疹,并多伴有消化道﹑关节等多系统器官受损,当HSP累及肾脏,出现血尿﹑蛋白尿等临床表现时,即为 HSPN(Henoch-Schönlein purpur nephritis,HSPN)。HSP的发病机制目前仍不明确,研究表面粘附分子异常激活可能在HSP的血管损伤中发挥重要作用。P-选择素(P-selectin,CD62P)是粘附分子选择素家族主要成员之一,参与机体炎症反应﹑血栓形成等多种病理过程[1],在肾脏疾病及风湿免疫性疾病的发生发展中起着重要作用[2-4]。但目前关于血﹑尿CD62P的动态研究并不多,因此开展本项实验来探讨CD62P在HSP及HSPN中的变化及作用。
1 临床资料
1.1 一般资料 收集2014年10月至2015年6月本院住院的HSP患儿共80例,均为初发病例,符合HSP或HSPN标准,并排除血小板减少性紫癜﹑系统性红斑狼疮,川崎病及合并严重心﹑肝﹑肾疾病等。所有患儿治疗并随访6个月,根据病程中有无出现肾脏损害分为HSP组(n=48)及HSPN组(n=32)。其中HSP组男22例,女26例,平均年龄(6.69±2.60)岁;HSPN组中男20例,女12例,平均年龄(7.53±2.66)岁。另外选取同期来本院体检的40例健康儿童作为健康对照组,其中男19例,女21例,平均年龄(7.05±2.35)岁。HSP组﹑HSPN组及健康对照组三组间的年龄﹑性别均无明显差异(χ2=2.401,P=0.301;t=1.199,P=0.305)。
1.2 血CD62P的测定 采集入院当日及治疗8周后患儿的外周静脉血1ml,1h内送检。取血标本0.1ml加入CD62P PE荧光单克隆抗体试剂10μl(美国BD公司),暗箱中避光反应30min后加入PBS液800μl,采用流式细胞仪(美国BD公司)技术检测CD62P阳性血小板的百分比。
1.3 尿CD62P测定 收集入院当天及治疗8周后患儿的小便50ml于干净尿杯中,1h内送检。将50ml尿液离心(1500rpm),(5min),留尿沉渣加PBS制成尿悬液,加CD62P PE荧光单克隆抗体试剂10ul,暗箱中避光反应30min后取出,加入溶血素1ml,离心(1500r/min,5min),PBS液洗涤3次,采用流式细胞仪(美国BD公司)技术进行检测,上机后检测104个血小板。
1.4 统计学方法 采用SPSS19.0统计软件。计量资料以()表示。各组别血﹑尿CD62P水平的比较采用t检验(三组间资料比较时采用SNK检验),相关性分析采用直线相关分析法,P<0.05为差异有统计学意义。
2 结果
2.1 不同组别血CD62P水平变化及比较 见表1。
表1 各组别血CD62P水平的变化[%,()]

表1 各组别血CD62P水平的变化[%,()]
注:与对照组比较,*P<0.05,与HSP组治疗后比较,#P<0.05
组别 治疗前 治疗后 t值 P值HSP组 1.95±1.42* 1.33±0.79 5.219 0.025 HSPN组 1.98±2.11* 2.04±2.97*# 0.630 0.430健康对照组 0.91±0.72 0.91±0.72 F值 6.844 1.808 P值 0.002 0.184
2.2 不同组别尿CD62P水平变化及比较 见表2。
表2 各组别尿CD62P水平的变化[%,()]
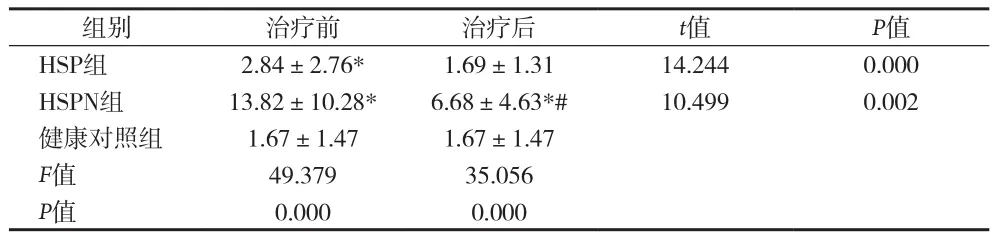
表2 各组别尿CD62P水平的变化[%,()]
注:与对照组比较,*P<0.05,与HSP组治疗后比较,#P<0.05
组别 治疗前 治疗后 t值 P值HSP组 2.84±2.76* 1.69±1.31 14.244 0.000 HSPN组 13.82±10.28* 6.68±4.63*# 10.499 0.002健康对照组 1.67±1.47 1.67±1.47 F值 49.379 35.056 P值 0.000 0.000
2.3 血清及尿液CD62P相关性 比较HSP组及HSPN组患儿入院时的血清﹑尿CD62P水平,发现两者均无显著相关性(分别为r=-0.025,P=0.865;r=0.087,P=0.636,P 值均 >0.05)。
3 讨论
作为儿童时期最常见的系统性血管炎,中性粒细胞及嗜酸性粒细胞等免疫炎性细胞的粘附迁移在HSP中发挥了关键的作用。病理显示HSP患儿的中小型动脉壁上存在中性粒细胞的浸润及其坏死性核碎片的沉积[7],而动物研究亦表明患有HSP的大鼠及家兔的皮肤﹑肾脏及胃肠道等多个组织中存在炎性细胞的浸润﹑血管充血渗出及病灶组织的坏死[8]。因此,炎症是HSP发病的重要组成部分,而CD62P被认为是炎症的重要介质和靶分子。在受到腺苷﹑凝血酶﹑胸苷磷酸化酶等刺激时,活化的血小板及内皮细胞weibelpalade小体可瞬时释放CD62P,并与白细胞表面的CD62P糖蛋白配体 1(P-selectin glycoprotein ligand,PSGL-1)结合,使得白细胞运动减缓,并通过粘附级联过程穿越血管迁移至病灶,进而启动炎症反应。同时,CD62P亦被认为是血小板和内皮细胞的活化标志,其可以活化血小板﹑减缓血液流速并促使血管内微血栓形成,而抑制P选择素的表达不仅能够减少CD62P介导的内皮细胞与白细胞的相互作用,还可以促进血管内血栓溶解。
鉴于HSP在病理上存在炎症及微血栓的改变,推测血CD62P参与了HSP的发病过程。而本研究结果显示HSP及HSPN患儿的血CD62P较对照组明显增高,也进一步证实了推测。但是HSPN组患儿的血CD62P水平并未高于HSP组,两者无显著差异,提示血CD62P可能仅代表了全身血管炎性状态及血小板功能变化,并不能较好的反映肾脏的受累情况。
Wu T等[9]的动物模型研究表明,给小鼠注射抗肾小球基底膜(GBM)抗体后CD62P即在肾小球内皮细胞表达,应用Elisa方法检测尿CD62P水平明显增高,表明尿CD62P可以反映肾脏局部的病变情况。在本研究中HSP组及HSPN组患儿的尿CD62P高于健康对照组,提示尿CD62P参与了HSP及HSPN的发生。而HSPN组患儿的尿CD62P又显著高于HSP组,可能与血﹑尿CD62P的来源不同有关。尿CD62P中仅有小部分来自于从肾小球中滤过的血CD62P,其余大部分由肾脏局部的上皮细胞﹑内皮细胞及血小板活化而产生。同时,作者在血﹑尿CD62P的相关性研究中也发现两者并不成正比,血CD62P增高并不代表尿CD62P也随之增长,表明血CD62P反映了全身的炎性状态,而尿CD62P则代表肾脏局部的病变情况,也更能准确显示肾脏的损伤程度。
在本研究中经过8周治疗后HSP组患儿的血CD62P已较前明显下降,而HSPN组患儿的血CD62P值仍处于高水平,与治疗前无显著差异,提示HSPN组患儿全身炎症持续时间明显长于HSP组患儿,其病程更持久。治疗8周后HSP组患儿的尿CD62P已与对照组无明显差异,而HSPN组患儿的尿CD62P虽较前有下降,但仍高于对照组,提示HSP组患儿病情明显改善,未出现肾脏损害,而HSPN组患儿肾脏局部病变程度虽较前有好转,但尚未完全恢复正常,需警惕肾炎复发或加重。临床中应尽量延长HSPN患儿的随访时间,推荐>10年甚至终生随访。因此,血﹑尿CD62P的表达水平基本与患儿的病情变化基本相一致,且因为创伤小,家长易于配合等优点,临床中可将血﹑尿CD62P作为反映HSP及HSPN病情变化的无创或微创指标。
本研究不足之处在于HSP患儿的随访问题,有14例HSP患儿因为各种原因失访,导致低估了HSPN的发病率。而32例HSPN患儿中仅有3例患儿失访,提示家长对于HSPN的重视程度明显高于HSP。因此,对于尿CD62P明显增高的患儿,需要警醒家长并注意密切监测,必要时及早干预,这对HSPN的早期发现及提高其治愈率具有重要的意义。
[1] Zuchtriegel G, Uhl B, Hessenauer ME, et al. Spatiotemporal expression dynamics of selectins govern the sequential extravasation of neutrophils and monocytes in the acute inflammatory response.Arterioscler Thromb Vasc Biol,2015,35(2):296-302.
[2] Wassel CL, Berardi C, Pankow JS, et al. Soluble P-selectin predicts lower extremity peripheral artery disease incidence and change in the ankle brachial index:The Multi-Ethnic Study of Atherosclerosis(MESA).Atherosclerosis,2015,239(2):405-411.
[3] Schmitt-Sody M,Metz P,Gottschalk O.Platelet P-selectin is significantly involved in leukocyte-endothelial cell interaction in murine antigen-induced arthritis.Platelets,2007,18(5):365-372.
[4] Wu T,Xie C,Wang HW,et al.Elevated urinary VCAM-1,P-selectin,soluble TNF receptor-1,and CXC chemokine ligand 16 in multiple murine lupus strains and human lupus nephritis.J Immunol,2007,179(10):7166-7175.
[5] 中华医学会儿科学分会免疫学组.儿童过敏性紫癜循证诊治建议.中华儿科杂志,2013,51(7):502-507.
[6] 中华医学会儿科学分会肾脏病组.紫癜性肾炎的诊治循证指南(试行).中华儿科杂志,2009,47(2):911-913.
[7] Ebert EC.Gastrointestinal manifestations of Henoch-Schonlein Purpura.Dig Dis Sci,2008,53(8):2011-2019.
[8] Yanhong Li,Xiaochun Feng,Lan Huang,et al.Hematologic and immunological characteristics of Henoch-Schonlein purpura in rat and rabbit models induced with ovalbumin based on type III hypersensitivity.Sci Rep,2015,2015,5(2):8862-8868.
[9] Wu T,xie C,Bhaskarabhatla M,et al.Excreted urinary mediators in an animal model of experimental immune nephritis with potential pathogenic significance.Arthritis Rheum,2007,56(3):949-959.
