FWHM图像分割法分析OCT影像中视网膜血管直径变化及其与2型糖尿病的相关性
2018-06-06李义杰李爱莲詹海静徐博伦童毓华
李义杰 李爱莲 詹海静 徐博伦 童毓华★
糖尿病视网膜病变(DR)会引起患者视力下降,甚至失明。视网膜血管的检查提供了一种途径,用以研究视网膜血管的形态特征改变与糖尿病之间的关系[1]。以往的研究中,最常见的视网膜血管测量是基于眼底照相分析测得的[2],但是眼底彩图只能测得视网膜血管的一个笼统的直径值,不能区分视网膜血管的腔内直径和腔外直径,以及其他体现血管形态的参数,如血管壁厚度(WT)﹑血管壁截面面积(WCSA)﹑壁腔比(WLR)等。频域相干光断层扫描(SD-OCT)可以产生一个高分辨率的视网膜血管的横截面影像[3],在此影像上能够分辨出视网膜血管的结构。以往的研究大多用SD-OCT内置软件手工测量血管直径,但可重复性差,误差较大[4]。近年来,显微光密度测量技术已大量应用于眼底照相中视网膜血管测量﹑评估等研究中,但是在SD-OCT影像识别应用上尚未见相关报道,应用较广泛的方法为半高全宽(FWHM)算法。
1 临床资料
1.1 一般资料 随机选自2016年7月至2017年7月本院的眼科门诊患者。观察组选取>50岁内分泌科确诊为2型糖尿病的患者47例,其中男19例,女28例;平均年龄60岁;平均体重指数(24.52±3.16)。排除标准:有其他类型的糖尿病﹑高血压病﹑既往或现在有心血管疾病(不包括脑血管疾病)﹑近视>6.0D﹑严重的屈光介质浑浊﹑眼压>21mmHg﹑青光眼病史﹑葡萄膜炎﹑视网膜疾病或既往有激光或超声乳化手术史﹑既往无吸烟和饮酒等患者。对照组为同期门诊体检的无任何类型糖尿病健康人员52例,其中男23例,女29例;平均年龄61岁;平均体重指数(23.44±3.20)。两组一般资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 方法 所有的OCT影像均采用SD-OCT获取。让受试者坐好并将头部固定于检查台上,叮嘱患者注视镜头内的蓝色固视灯。用SD-OCT仪扫描每个受试者右眼颞上B区视网膜动脉及其伴行的静脉,B区定义为距离视盘边缘0.5~1.0个视盘直径(DD)距离的颞上区域。扫描方式选用增强深度成像模式的线性扫描,扫描线尽量调整与血管轴线垂直,如果血管在B区前已经分支,则在分支前扫描,扫描完成后先将获得的OCT影像的垂直水平比率调整为1:1μm,只有能清晰显示血管壁的影像才选入下一步研究中。每条血管扫描≥5张清晰OCT影像用于分析。为了比较手工方法和FWHM方法一致性,本实验用这两种方法测量观察组同一张OCT影像中视网膜血管的直径。先用SD-OCT仪内置的标尺软件测量OCT影像中视网膜血管的内外直径,所得数据选入手动组。然后用FWHM方法再测量同一张OCT影像中视网膜血管的内外直径,在IMAGJ软件中打开BMP格式的OCT影像图片,用直线工具穿过血管中间位置划一垂直线获得密度曲线图。在密度曲线图上有两个开口向上的曲线,表示OCT影像中血管的上下壁,在每个曲线的左右两边,波峰和波底分别用三个连续数值的平均数确定最大值和最小值,计算最大值与最小值之间的中间数值。曲线的每一边,用连续的且相差值最大的点拟合直线函数,该直线函数与中间数值水平线的交叉点即边缘位置。最后,IMAGJ软件会自动识别两条曲线边界点的距离并计算出视网膜血管的内外直径,所得数据选入FWHM组。所有的操作由同一个人在不同的时间测量两次,所得的数据分成手动组和FWHM组。将手动组和FWHM组的数据做比较分析,分别记录视网膜动脉的外径(RAOD)﹑视网膜动脉的腔内直径(RALD)﹑视网膜静脉的外径(RVOD)﹑视网膜静脉的腔内直径(RVLD)的值,比较组间的变异性。通过实验论证FWHM方法的一致性高于手工测量。所以本次实验选用FWHM方法用于下一步研究。所有受试者的每条血管用FWHM方法重复测量三次,取平均值,最终测得RALD﹑RAOD﹑RVOD﹑RVLD,视网膜血管的其他形态参数参考文献[5]介绍的方法计算,视网膜动脉公式如下:WT=(RAOD-RALD)/2;WLR=(RAOD-RALD)/RALD ;WCSA=3.14×(RAOD2-RALD2)/4。
1.3 统计学方法 采用SPSS21.0统计软件。检测方法的重复性用变异系数(CV),组内相关系数(ICC)和Bland-Altman图检验。ICC越大表明测量结果越稳定,可重复性越好。计量资料以()表示,组间比较采用t检验,计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 手动测量与FWHM一致性比较 见表1。
表1 手动和FWHM结果的可重复性分析()
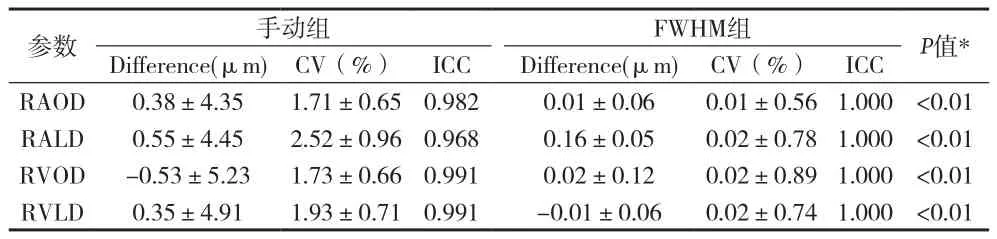
表1 手动和FWHM结果的可重复性分析()
*注:比较两组之间的CV值,Mann-Whitney 检验
参数 手动组 FWHM组 P值*Difference(μm)CV(%) ICC Difference(μm) CV(%) ICC RAOD 0.38±4.35 1.71±0.65 0.982 0.01±0.06 0.01±0.561.000 <0.01 RALD 0.55±4.45 2.52±0.96 0.968 0.16±0.05 0.02±0.781.000 <0.01 RVOD -0.53±5.23 1.73±0.66 0.991 0.02±0.12 0.02±0.891.000 <0.01 RVLD 0.35±4.91 1.93±0.71 0.991 -0.01±0.06 0.02±0.741.000 <0.01
2.2 Bland-Altman图 RAOD Bland-Altman一致性分析结果显示,手工测量平均差值为(0.4±8.5)μm,95%一致性界限为-8.1~8.9μm;FWHM平均差值为(0.00±0.11)μm,95%一致性界限为-0.11~0.11μm,FWHM的一致性高于手工测量,在临床上更易接受。RALD﹑RVOD﹑RVLD与RAOD直径具有同样的结论,FWHM的一致性均高于手工测量。
2.3 两组视网膜动脉参数值比较 见表3。
表3 各组视网膜动脉参数值比较()
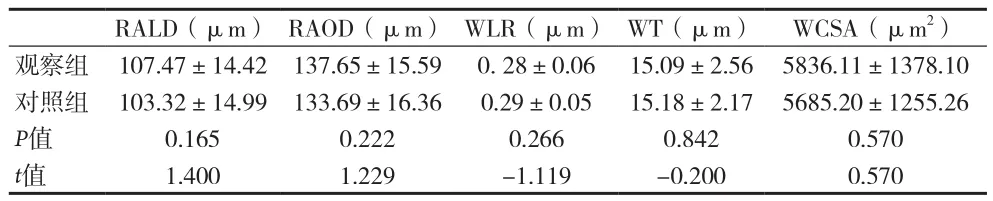
表3 各组视网膜动脉参数值比较()
RALD(μm) RAOD(μm) WLR(μm) WT(μm) WCSA(μm2)观察组 107.47±14.42 137.65±15.59 0. 28±0.06 15.09±2.56 5836.11±1378.10对照组 103.32±14.99 133.69±16.36 0.29±0.05 15.18±2.17 5685.20±1255.26 P值 0.165 0.222 0.266 0.842 0.570 t值 1.400 1.229 -1.119 -0.200 0.570
2.4 两组视网膜静脉的参数值比较 见表4。
表4 两组视网膜静脉的参数值比较()
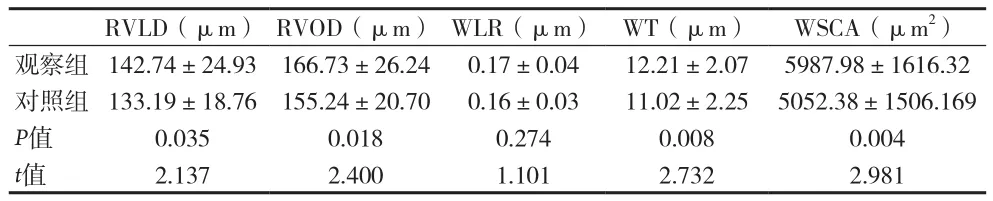
表4 两组视网膜静脉的参数值比较()
RVLD(μm) RVOD(μm) WLR(μm) WT(μm) WSCA(μm2)观察组 142.74±24.93 166.73±26.24 0.17±0.04 12.21±2.07 5987.98±1616.32对照组 133.19±18.76 155.24±20.70 0.16±0.03 11.02±2.25 5052.38±1506.169 P值 0.035 0.018 0.274 0.008 0.004 t值 2.137 2.400 1.101 2.732 2.981
3 讨论
本实验发现2型糖尿病观察组不止视网膜静脉的RVOD﹑RVLD高于对照组,WT﹑WCSA也都明显高于对照组。符合2型糖尿病患者的静脉直径增宽这一认知,还能提供WT和WCSA这一更详细﹑实用的参考指标。因为血管壁比血管直径,受血管搏动的影响更小,这样获得的结果具有更高的可重复性,拥有更高的研究价值。并且糖尿病患者视网膜血液循环障碍也常引起血管内皮细胞功能受损,进一步引起内皮细胞表达一氧化氮增加,通过一氧化氮介导视网膜闪光刺激,从而参与血管扩张的调节过程。也有些研究者认为高血糖可造成视网膜缺氧,乳酸堆积,静脉扩张是为增加视网膜血液供应而出现的代偿机制[6]。由于本次实验的局限性,未能比较WT和RVOD﹑RVLD的敏感性及出现变化的时序先后,需要进一步研究。
在本实验中,观察组视网膜动脉的RAOD﹑RALD高于对照组,这可能与选取样本是排除了并发高血压患者有关。此前的研究认为高血压与视网膜血管狭窄﹑血管壁增厚具有相关性。所以在去除了高血压这个最主要的狭窄因素后,出现RAOD﹑RALD扩张的结果。Cheung等[7]研究发现,随着血糖和糖化血红蛋白的升高﹑DR的发展,视网膜动脉会增宽。所以目前针对糖尿病患者的视网膜动脉直径变化所得出的结论仍有争议,需要更大的样本量及进一步的论证。但是本次实验中作者提供了一些新的动脉参数,这些数据具有重要的研究价值,为研究DR与视网膜血管直径的关系拓展了研究内容。应用非侵入性的SD-OCT在人体上获得的实验结果与先前的体外实验的结果是一致的[8]。
SD-OCT检测配合FWHM分割法是一种可靠的技术,用于测量视网膜血管壁,但是仍有不足之处:(1)由于视网膜血管大都靠近视网膜表面,血管的上壁与表面组织难以区分开,所以会导致更大的血管外直径,更厚的血管壁等。(2)FWHM分割法虽然可以降低操作者误差,但并非完全自动化,仍有操作失误的可能,并且整个测量过程手工操作步骤过多,过于繁琐,未实现完全自动化,影响检测的效率。
[1] Sun C,Wang JJ, Mackey DA, et al. Retinal vascular caliber:systemic,environmental,and genetic associations.Surv Ophthalmol,2009, 54(1):74-95.
[2] Hubbard LD,Brothers RJ,King WN,et al.Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study.Ophthal-mology, 1999,106(12):2269-2280.
[3] Kiernan DF,Mieler WF,Hariprasad SM.Spectral-domain optical coherence tomography: a comparison of modern high-resolution retinal imaging systems.Am J Ophthalmol,2010,149(1):18-31.
[4] Zhu TP,Tong YH,Zhan HJ,et al.Update on retinal vessel structure measurement with spectral-domain optical coherence tomography.Microvasc Res,2014,95:7-14.
[5] Ritt M,Harazny JM,Ott C,et al.Analysis of retinal arteriolar structure in never-treated patients with essential hypertension.J Hypertens,2008,26(7):1427-1434.
[6] Saldívar E,Cabrales P,Tsai AG,et al.Microcirculatory changes during chronic adaptation to hypoxia.Am J Physiol Heart Circ Physiol,2003,285(5):H2064-2071.
[7] Cheung N, Rogers SL, Donaghue KC, et al. Retinal arteriolar dilation predicts retinopathy in adolescents with type 1 diabetes.Diabetes Care, 2008,31(9):1842-1846.
[8] Endemann DH,Pu Q,De Ciuceis C,et al.Persistent remodeling of resistance arteries in type 2 diabetic patients on antihypertensive treatment.Hypertension,2004,43(2):399-404.
