一株产红色素真菌的鉴定及其色素性质的研究
2018-06-05付金菊王强陈玉龙杨清香
付金菊,王强,陈玉龙,杨清香
(河南师范大学生命科学学院,河南新乡453007)
目前,色素在食品和饲料行业中的应用日益剧增,具有广阔的市场前景。天然提取色素主要来源于有色植物,受到原料等因素的制约,植物色素含量低、品质差异大,价格昂贵[1]。人工合成色素的安全性向来受到争议,难以在食品领域得到广泛的应用。利用微生物生产色素不仅克服了上述困难,而且微生物色素通常比植物或动物源色素具有更高的稳定性和溶解性[2]。因此,利用微生物生产色素受到了越来越多研究者的关注。在产色素的微生物中,丝状真菌色素含量高,易培养,成为微生物色素的重要来源,已报道的真菌色素近600种,如红曲红色素、类胡萝卜素、虾青素等[3]。真菌色素不仅在化学结构上表现出多样性,而且拥有丰富多彩的颜色,是主要的产色素微生物[4]。真菌不仅能在固体培养基中产生色素,在液体培养基中同样能产生大量色素,适宜于规模化生产[5]。然而,目前具有市场应用价值的微生物源色素依然有限,寻找有价值的色素仍然任重道远。
本研究从三孢布拉霉培养过程中的污染平板上筛选得到一株产红色素的丝状真菌,初步判断该色素与番茄红素完全不同。为了进一步挖掘该丝状真菌产红色素的潜在价值,我们对该真菌进行了分子生物学鉴定,并对该红色素进行了提取和初步分离,以及对常见物理化学因素的稳定性。
1 材料与方法
1.1 菌株的培养
培养基:麦芽汁培养基、pH值自然[6]。
平板培养:将保藏于20%甘油里的菌液接种于6°麦芽汁固体培养基上,28℃下培养4 d。
发酵液培养:无菌条件下,用接种环从培养好的平皿中挑取一环接种于6°麦芽汁液体发酵培养基中,28℃,180 r/min培养5 d。
1.2 主要仪器
高速冷冻离心机:德国Sigma公司;LRX系列生化培养箱:上海恒科有限公司;电热恒温水浴锅:上海医疗器械厂;离心机(5415R):德国EPPENDORF公司;电泳仪:Powerpac USA;超净工作台:AIR TECH苏州净化设备有限公司;高压蒸汽灭菌锅(MLS-3781L-PS):松下健康医疗器械株式会社;紫外可见分光光度计(UV2600):岛津仪器(苏州)有限公司。
1.3 菌株的分子生物学鉴定
从培养的单菌落上挑取适量的菌体,用Takara微生物细胞裂解液裂解细胞,以细胞裂解液为模板,进行PCR扩增,以ITS序列通用引物ITS1、ITS4进行PCR 扩增[7]。各引物序列如下:ITS1(5′TCCGTTAGGTGAACCTGCGG3′),ITS4(5′TCCTCCGCTTATTGATATGC3′)所有引物均由上海生工公司合成。PCR扩增的反应体系为:25 μL的总反应体积中包含1 μL DNA模板,每个引物 0.8 μL,12.5 μL Mix,加水至 25 μL。扩增条件:95℃预变性5min,然后进行35个循环的扩增(细菌 94℃ 40 s,55℃ 90 s,72℃ 90 s;真菌 94℃ 30 s,54℃30 s,72℃1min),最后72℃延伸10min,PCR反应结束后,取5 μL反应产物,用1%琼脂糖凝胶电泳检测目的条带。将目的片段的PCR产物送到上海生工公司进行测序,利用BLAST与GenBank数据库中18S rRNA基因和真菌ITS序列进行比对分析,通过MEGA4.1软件对同源序列以及相关标准菌株的序列进行多重序列比对,使用Neighbor-Joining构建系统发育树法,确定菌株的分类水平。
1.4 产色素真菌的发酵曲线的测定
配30瓶发酵液,每瓶接种2 mL浓度为107个/mL的孢子悬液。从发酵开始,每隔12小时取3瓶发酵液,离心,上清液在495 nm波长下测定红色素的吸光值。菌丝体用洗涤3次,105℃烘干至恒重,即为生物量。
1.5 红色素的提取
将菌株在发酵培养基中培养5天后,取25 mL发酵液,8 000 r/min 离心 10min,取上清液,使用 0.45 μm膜过滤,留下滤液。将红色素提取液分别与等体积的乙醇,乙酸乙酯,石油醚混合,充分摇匀后静置,观察互溶情况。
1.6 全波长光谱扫描与高效液相色谱分析
将发酵120 h的发酵液过0.45 μm滤膜后,利用紫外可见分光光度计-UV2600对滤液进行全波长扫描,确定最大吸收波长。
色素成分分析采用高效液相色谱法,色谱柱为ZORBAX Eclipse Plus C18 柱(250 mm×4.6 mm)。流动相为乙腈 ∶水=60∶40,流速1 mL/min,检测波长为495 nm。
1.7 红色素稳定性检测
用蒸馏水将红色素适当稀释,直到其吸光度范围在0.3~0.8之间,记下此时的吸光度,稀释过的色素用于色素的稳定性检测。
1.7.1 pH 值对色素稳定性的影响
分别取稀释后的色素样品5 mL于9支试管中,用氢氧化钠和盐酸将色素溶液调成不同的pH值,静置30min后,在波长为495 nm处测定色素吸光度。
1.7.2 温度对色素稳定性的影响
分别取稀释后的色素样品5 mL于5支试管中,置于 20、40、60、80、100℃下的恒温水浴锅中,每个温度下处理30min后拿出,在波长495 nm下检测吸光度。
1.7.3 光照时间对色素稳定性的影响
分别取稀释后的色素样品5 mL于8支试管中,分别置于自然光和紫外光下,照射 0、2、4、6、8、10 h 后,在波长为495 nm下测定其吸光度。
1.7.4 过氧化氢对色素稳定性的影响
分别取稀释后的色素样品5 mL于8支试管中,向试管中各添加 0、1、2、3、4、5 mL 10%的过氧化氢溶液,然后用蒸馏水定容至10 mL,充分震荡后静置2 h,在波长为495 nm处检测吸光度。
1.7.5 亚硫酸钠对色素稳定性的影响
分别取稀释后的色素样品5 mL于8支试管中,向试管中各添加 0、1、2、3、4、5 mL 10%的亚硫酸钠溶液,然后定容至10 mL,震荡后静置2 h,在波长为495 nm处检测吸光度。
2 结果与分析
2.1 产色素真菌的分离纯化及形态特征
在培养产番茄红素的三孢布拉霉固体平板上污染一株霉菌,其菌落周围出现红色,其菌丝特征和产生的红色素在培养基中的扩散特征均明显不同于三孢布拉霉菌及其产生的番茄红素。将该菌株分离纯化,菌落形态如图1所示。
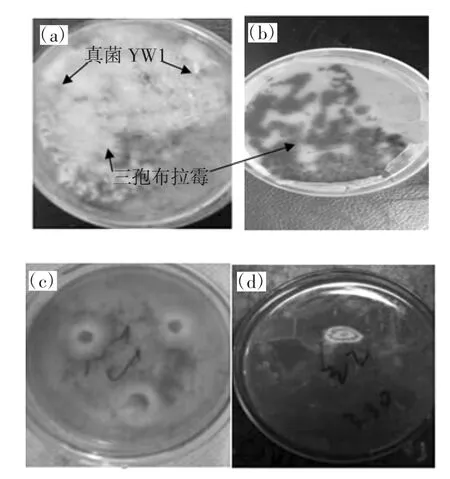
图1 产红色素真菌的菌落特征Fig.1 Colony characteristics of red-pigment-producing fungi
从菌落形态上判断,该霉菌与三孢布拉霉具有很大差异,菌落表面呈深绿色,并且向周围培养基中渗透大量红色素。而三孢布拉霉的菌落呈黄色,并且不会向周围培养基中渗透色素。因此,该霉菌很可能是一株分泌胞外色素的真菌,具有潜在的价值,值得进一步对菌种和所产色素进行鉴定。
2.2 产色素真菌的分子生物学鉴定
为了进一步鉴定该产色素真菌,扩增该真菌核糖体rRNA基因的IT1-IT4序列,并测序,将该序列在NCBI上进行同源性比对,选取同源性较高的序列,并使用Neighbor-Joining构建系统发育树,结果如图2所示。
从系统发育树中可以看出,菌株YW1的IT1-IT4序列与踝节菌属(Talaromyces)的产紫踝节菌(Talaromyces purpurogenum)在发育树上聚为一簇,具有99%的相似性。因此,本研究将该产色素真菌命名为T.purpurogenum YW1。

图2 产色素真菌YW1的Neighbor-joining系统进化树Fig.2 Phylogenetic tree of T.purpurogenum YW1(Neighbor-joining)
2.3 产色素真菌的发酵曲线
产色素真菌的的生长过程曲线和红色素的合成过程曲线如图3所示。

图3 产色素真菌的发酵曲线Fig.3 Fermentation curve of pigment fungi
从图3中可以看出,该产色素真菌的生长速度较快,经过短暂的适应期后,在发酵48 h生物量达到最大值[(13.51±1.22)g/L],随后进入稳定期,并在96 h后生物量开始缓慢下降。红色素的合成是在发酵36 h后开始,在48 h~96 h内快速合成,随后保持稳定。从发酵曲线可以看出,红色素的合成是在霉菌进入稳定期后开始的,是霉菌的次级代谢产物,这与大多数真菌色素相似。
2.4 红色素的提取和分离
2.4.1 红色素在不同溶剂中的溶解性
为了确定合适的提取溶剂,本研究将发酵液与不同极性的有机溶剂混合,静置分层后,出现了不同的分层情况。在极性较弱的石油醚中,明显的分为两层,色素集中在水相,有机相中几乎没有颜色。当发酵液与乙酸乙酯互溶后,有机相中呈现黄色,水相为红色。当发酵液与极性较大的乙醇互溶后,没有出现分层,色素均匀的分布在溶液中。据此可以推测,该红色素是具有较强的极性,可能是多种色素混合在一起,且主要为水溶性色素。水作为色素提取溶剂,不仅无毒、价格低廉,而且操作简单,远远优越于三孢布拉霉产生的番茄红素的提取。通过对发酵液离心,得到的菌丝体用水洗涤5次,菌丝体接近无色,说明色素为胞外产物。与三孢布拉霉产生的番茄红素相比较,减少了细胞破壁过程,大大节约了时间和色素提取成本。
2.4.2 色素的光谱吸收特征和组分分析
将发酵液过0.45 μm滤膜后,利用紫外可见分光光度计-UV2600对滤液进行全波长扫描,结果如图4(a)所示。从扫描结果可以看出,有两个峰值,说明色素成分不是单一的,但在波长为495 nm时得到最大吸收峰。为了进一步对色素的成分进行分离,本研究利用高效液相色谱对红色素进行分离,结果如图4(b)所示。

图4 红色素的全波长扫描及高效液相色谱分离Fig.4 Whole wavelength scanning and HPLC of red pigment
2.5 理化因素对红色素稳定性的影响
用蒸馏水将发酵液适当到其吸光度范围在0.3~0.8之间,进而对稀释后的色素进行pH值、温度、光照时间、氧化还原性等性质进行稳定性检测。以上理化因素对红色素稳定性的影响如图5所示。

图5 理化因素对色素稳定性的影响Fig.5 Effects of physical and chemical factors on pigment stability
2.5.1 pH 值对色素稳定性的影响
pH值对色素稳定性的影响如图5(a)所示,在pH值为5.5时,测得的OD值最高。但值得注意的是,在强酸(pH1.34)和强碱(pH11.71)的条件下,该色素的吸收分别达到最大吸收峰的74.83%和76.44%,说明该色素具有很好的酸碱稳定性。
2.5.2 温度对色素稳定性的影响
将色素置于不同温度下处理30min,测定其在495 nm下的吸光值,结果如图5(b)所示。虽然随着温度的升高,测得的吸光值有所下降,但整体的下降速度和下降幅度并不大。当温度从20℃升高的100℃时,色素的吸光值从0.74下降到0.62,下降幅度仅为16.2%。因此,该色素具有较好的热稳定性,可适用于温度较高的环境。
2.5.3 光照对色素稳定性的影响
将色素分别置于自然光和紫外线下处理不同时间,测定其在495 nm下的吸光值,结果如图5(c)所示。随着光照时间的增加,色素溶液OD值略微减小,但与对照相比,6 h内色素的OD值下降并不显著。这说明该色素在自然光和紫外线的照射下,含量稳定。
2.5.4 氧化剂、还原剂对色素分解的作用
将色素分别置于不同浓度的过氧化氢和亚硫酸钠溶液中处理2 h,测定其在495 nm下的吸光值,结果如图5(d)所示。在低浓度的过氧化氢溶液中,该色素溶液的OD值就迅速下降,随着过氧化氢浓度的增加,OD值进一步下降。在较低亚硫酸钠溶液中,色素的OD值就明显下降,但随着亚硫酸钠的浓度进一步升高,色素的OD值保持稳定。这可能是因为该红色素不是单一的成分,而是含有多种色素,其中的一种或者多种色素对过氧化氢和亚硫酸钠较为敏感。
3 结论与讨论
虽然真菌色素种类很多,但真正具有商业化价值的色素较少,尤其食品和化妆品行业对新型天然色素的需求仍然较大。三孢布拉霉是工业上生产番茄红素的主要菌种,菌落呈黄色或者红色,所产生的番茄红素是一种脂溶性的胞内色素,具有抗氧化、抗衰老等生理功能。而从三孢布拉霉污染平板上分离得到的这株霉菌无论从菌落形态还是所产色素,都与原菌大为不同。经鉴定,该菌株为产紫踝节菌(T.purpurogenum)。踝节菌属(Talaromyces)是 1955年 Benjamin将青霉属(Penicillium)中的部分菌株归类后定义的,现在产紫踝节菌(T.purpurogenum)在命名上仍与产紫青霉(P.purpurogenum)同用[8]。该真菌不仅能够产生天然红色素[9],还能够产生木聚糖酶、纤维素酶等[10-11],在生物技术领域具有重要作用。已报道的该真菌所产的色素为红曲色素的氨基衍生物PP-V[(10Z)-12-carboxyl-monascorubramine][12],但并没有关于该色素功能的研究,并且本研究所获得的色素从液相图谱看,其出峰时间与常用的色素番茄红素、红曲红胺均不同,但是否为PP-V目前还不确定。未来需要对该色素进行进一步鉴定。
相比三孢布拉霉等菌株,产紫踝节菌在用于色素的生产具有诸多优势,如营养需求简单,生长速度快,不易受到污染,色素产量高等。三孢布拉霉的培养需要正、负两种菌株同时存在才能大量合成色素,并且菌丝浓度高、需氧量高,在放大培养过程中产量急剧下降[6,13]。而产紫踝节菌仅需要一种菌就能合成大量的红色素,培养更容易,产量更稳定。另外,产紫踝节菌产生的色素为胞外产物,色素产量提升潜力大,而且也降低了提取成本。作为水溶性的红色素,不仅具有广泛的应用范围,而且在提取过程中不需要使用有机溶剂,即节约成本,又减少了环境污染[14]。因此,无论是菌株还是所产的红色素,都比三孢布拉霉和番茄红素更易于工业化。该红色素的稳定性结果表明,一般的理化因素对其影响不大,但氧化剂和还原剂对其有一定的降解作用。这说明该红色素虽然不及番茄红素的抗氧化性强,但可能也具有一定的抗氧化性,并且性质更稳定,更适用于产品的着色剂等。然而,该红色素的结构和功能,以及该产紫踝节菌是否产生有毒代谢产物还需进一步的鉴定,实现商业化生产仍需更多的研究。
综上所述,本研究从三孢布拉霉污染平板上分离得到了一株能够产生水溶性红色素的霉菌,经鉴定,该真菌为产紫踝节菌。菌株在生长的稳定期(48 h发酵)产生红色素,到发酵第120 h产量最大。红色素经过水提取后,在495 nm处具有最大吸收峰,经液相色谱分析,该红色素为复合色素,由4种以上的单色素组成,但与目前常用的番茄红素、红曲红胺等在液相色谱中的出峰时间均不同;该色素具有对紫外线等光照不敏感,耐高温、在强酸和强碱条件下都具有很好的稳定性,并且为胞外水溶性分泌物,因此具有很好的开发价值。但需要进一步对其生理功能、结构以及毒性进行深入研究。
[1]Shahid M,Mohammad F.Recent advancements in natural dye applications:a review[J].Journal of Cleaner Production,2013,53(1):310-331
[2]Kumar A,Vishwakarma H S,Singh J,et al.Microbial pigments:production and their applications in various industries[J].International Journal of Pharmaceutical,Chemical&Biological Sciences,2015,5(1):203-212
[3]Gill M,Steglich W.Pigments of fungi(Macromycetes)[J].Natural product reports,2003,20(6):615-639
[4]J。zlová P,Martinkova L,Ken V.Secondary metabolites of the fungus Monascus:a review[J].Journal of Industrial Microbiology,1996,16(3):163-170
[5]Sayyed I,Majumder D R.Pigment production from fungi[J].International Journal Current Microbiology Applied Sciences,2015,2(1):103-109
[6]王强,余晓斌.三孢布拉霉发酵产番茄红素的研究进展[J].微生物学通报,2015,42(2):420-426
[7]桓明辉,李杨,刘晓辉,等.1株产纤维素酶木霉菌种的鉴定[J].微生物学杂志,2012,32(5):65-68
[8]Samson R A,Houbraken J,Thrane U,et al.Food and indoor fungi CBS laboratory manual series 2[J].Utrecht:CBS-Fungal Biodiversity Centre,2010,2(1):276-390
[9]Yilmaz N,Houbraken J,Hoekstra E S,et al.Delimitation and characterisation of Talaromyces purpurogenus and related species[J].Persoonia,2012,29(12):39-54
[10]Steiner J,Socha C,Eyzaguirre J.Culture conditions for enhanced cellulase production by a native strain of Penicillium purpurogenum[J].World Journal of Microbiology&Biotechnology,1994,10(3):280-284
[11]Belancic A,Scarpa J,Peirano A,et al.Penicillium purpurogenum produces several xylanases:purification and properties of two of the enzymes[J].Journal of Biotechnology,1995,41(1):71-79
[12]Arai T.Importance of the ammonia assimilation by Penicillium purpurogenum in amino derivative Monascus pigment,PP-V,production[J].Amb Express,2013,3(1):19-25
[13]Mantzouridou F,Tsimidou M Z.Lycopene formation in Blakeslea trispora.Chemical aspects of a bioprocess[J].Trends in Food Science&Technology,2008,19(7):363-371
[14]You T T,Zhou S K,Wen J L,et al.Chemical composition,properties,and antimicrobial activity of the water-soluble pigments from Castanea mollissima shells[J].Journal of Agricultural&Food Chemistry,2014,62(8):1936-1944
