温度和氯离子对初榨胡麻油中 3-MCPD酯生成的影响
2018-06-05王永瑞徐宇丽魏长庆
王永瑞 王 丹 徐宇丽 魏长庆
(石河子大学食品学院1,石河子 832000) (新疆植物药资源利用教育部重点实验室2,石河子 832000) (石河子出入境检验检疫局3,石河子 832000)
胡麻油,又称亚麻籽油。是以亚麻科、亚麻属作物种子胡麻籽为原料生产出的一种营养价值极高的食用油[1]。胡麻适合生长于干旱半干旱地区,在中国的种植主要是分布在新疆、甘肃、宁夏等西北偏远地区。胡麻油虽然有工业化生产,但在大部分农村地区依旧是小作坊压榨自然沉淀,未经过精炼直接用于日常饮食中。3-MCPD酯是4类氯丙醇酯中的一类,最早于1980年由Velíšek等[2]在用酸水解蔬菜蛋白过程中发现,是一种潜在的致癌物质。随着检测设备以及检测方法的发展,陆续有研究者在各类食品中检测出3-MCPD酯的存在,如饼干、面包皮、咖啡、薯条、鱼油、食用油、奶粉等[3-9]。目前报道的采用GC-MS间接法测定3-MCPD酯的相关研究主要是采用电子轰击(EI)离子源,采用化学离子(CI)源的研究相对较少。CI源是软电离离子源,根据极性不同分为负化学离子源(NCI)和正化学离子源(PCI),其中NCI对于柱流失和绝大多数基质成分没有响应,并且对含电负性元素或基团的化合物具有很好的响应。3-MCPD的七氟丁酰咪唑(HFBI)的衍生物具有氯原子以及多个氟原子,因而采用NCI源分析3-MCPD七氟丁酰咪唑衍生物会有很好的灵敏度和选择性[10-13]。本研究采用甲醇钠-甲醇碱水解,将胡麻油中3-MCPD酯水解释放出3-MCPD。再用固相萃取柱净化,结合同位素稀释-气相色谱-负化学离子源-质谱方法对初榨胡麻油样品进行检测分析,研究温度以及氯离子对初榨胡麻油中3-MCPD酯生成的影响,评估初榨胡麻油中3-MCPD酯的风险以及为胡麻油精炼工艺改进提供参考,更好的把控精炼胡麻油中3-MCPD酯的含量。
1 材料与方法
1.1 实验材料
胡麻籽:市售;甲醇钠、无水硫酸钠、冰醋酸:分析纯;无水硫酸钠使用前于 650 ℃灼烧 4 h 以上;甲基叔丁基醚、乙酸乙酯、甲醇、正己烷:色谱纯;3-MCPD 棕 榈 酸 二 酯 ( 98%),d5-3-MCPD 棕榈酸二酯(化学纯度: 97%,异构体纯度: 98.2%),3-MCPD( 98%),d5-3-MCPD(化学纯度: 97.5%, 异构体纯度: 98.7%)。
1.2 实验仪器
7890A/5975C inert XL EI/CI气相色谱-质谱(GC-MS)联用仪(配有 NCI 源);OP-Y5欧意普瑞家用榨油机;XW-80A 旋涡混合仪;Xcelvap 全自动氮吹浓缩仪;FD115 电热鼓风干燥箱;LXJ-IIB低速大容量多管离心机;ELF 11/14 马弗炉;Milli-Q 去离子水发生器; CleanertMCPD 氯丙醇专用固相萃取柱(4 g/30 mL)。
1.3 胡麻油中3-MCPD酯的检测方法
1.3.1 水解与净化
准确称取 0.10 g 胡麻油样品至具盖玻璃试管中,加入 51 μL 10 mg/L 的 d5-3-MCPD 棕榈酸二酯内标溶液(相当于100 ng 游离态的 d5-3-MCPD),加入 0.5 mL 甲基叔丁基醚-乙酸乙酯混合溶液(8∶2),涡旋混匀后再加入 1 mL 0.5 mol/L 的甲醇钠/甲醇溶液,涡旋后,静置反应4 min后,迅速加入3 mL冰醋酸-20% 硫酸钠溶液(1∶30,中和过量的甲醇钠)和3 mL 正己烷(脱脂),涡旋混匀,静置分层后弃去上层有机相,再加3 mL正己烷重复脱脂两次。将下层水相溶液上样于 CleanertMCPD 氯丙醇专用固相萃取柱中,待液体完全进入硅藻土填料后,静置平衡10 min。再用15 mL 乙酸乙酯在重力作用下洗脱目标组分, 将洗脱液接收于装有 5 g 无水硫酸钠的玻璃离心管中,然后将洗脱液转移至具盖试管中,于40 ℃水浴下氮吹浓缩至近干,用 2 mL 正己烷溶解残渣。
1.3.2 衍生化
向“1.3.1”所得溶液中加入50 μL HFBI,旋紧盖子并涡旋混匀,置于70 ℃恒温干燥箱中反应25 min。衍生化完成后,取出冷却至室温,加3 mL 水并涡旋振荡30 s后静置分层,弃去下层水相,重复水洗3 次后取上层有机相,经无水硫酸钠除水后装入进样瓶中,待GC-NCI-MS分析。
1.4 仪器条件
1.4.1 气相色谱条件
色谱柱: HP-5MS UI石英毛细管色谱柱(30 m×250 μm,0.25 μm); 进样口温度: 300 ℃; 程序升温条件:初始温度为 40 ℃,以 5 ℃/min的速率升温至 90 ℃,再以 40 /min ℃的速率升温至 270 ℃,保持 1.5 min; 载气:高纯氦气(纯度≥99.999%);柱流速:1.0 mL/min; 进样量:1 μL; 进样方式:不分流进样。
1.4.2 质谱条件
离子源: NCI; 反应气:甲烷(纯度≥99.99%);离子源温度:150 ℃;四级杆温度:150 ℃;溶剂延迟: 8 min;数据采集方式:选择离子监测模式(SIM)。
2 结果与讨论
2.1 3-MCPD和3-MCPD的HFBI衍生物的定性分析
采用间接法检测分析3-MCPD酯,最终是通过将3-MCPD酯碱水解成3-MCPD后,再经过HFBI衍生化进行GC-NCI-MS检测分析。在3-MCPD以及d5-3-MCPD质谱图中,m/z213 [C3F7CO2]-、194[C3F7CO2-F]-、175[C3F7CO2-F-F]-离子碎片的相对丰度较大,但其均为七氟丁酰基的特征离子,并不是3-MCPD或者d5-3-MCPD衍生物的特征离子[11]。本文采用代表性的氯丙醇衍生物的特征离子作为定性、定量离子,如表1所示[12-13]。其中m/z=502以及m/z=507分别为3-MCPD以及d5-3-MCPD七氟丁酰咪唑衍生物的分子离子峰,m/z=482以及m/z=486分别为3-MCPD、d5-3-MCPD七氟丁酰咪唑衍生物的分子离子失去一个HF分子所得到的碎片离子峰,而m/z=446为3-MCPD七氟丁酰咪唑衍生物的分子离子失去一分子HF和一分子HCl所得到的碎片离子峰。

表1 3-氯丙醇及其内标物衍生产物的特征离子
注:下划线离子为定量离子,其余为定性离子。
2.2 方法学评价
2.2.1 线性范围、检出限、定量限
准确移取一定量的3-MCPD以及d5-3-MCPD标准溶液于具盖试管中,用正己烷定容至2 mL,配制成10、20、40、50、80、100 μg/mL的一系列标准溶液,其中d5-3-MCPD浓度为50 μg/mL。用HFBI衍生后进GC-NCI-MS进行检测。图1为3-MCPD以及d5-3-MPCD标准品衍生物的GC-MS的气相色谱图,图2、图3分别为3-MCPD以及d5-3-MPCD标准品衍生物的GC-NCI-MS的特征离子质谱图。以3-MCPD以及d5-3-MCPD衍生物的定量离子峰面积之比为纵坐标,3-MCPD质量浓度为横坐标进行线性回归。得到的线性方程为Y=0.568 2X-0.094 3,R2=0.997 4。线性相关性良好。以信噪比(S/N)为3和10时对应的加标水平分别作为方法的检测限和定量限,检出限为5 μg/kg,定量限为20 μg/kg。满足油脂中低含量3-MCPD酯的分析检测。

图1 3-MCPD,d5-3-MCPD衍生物的气相色谱图
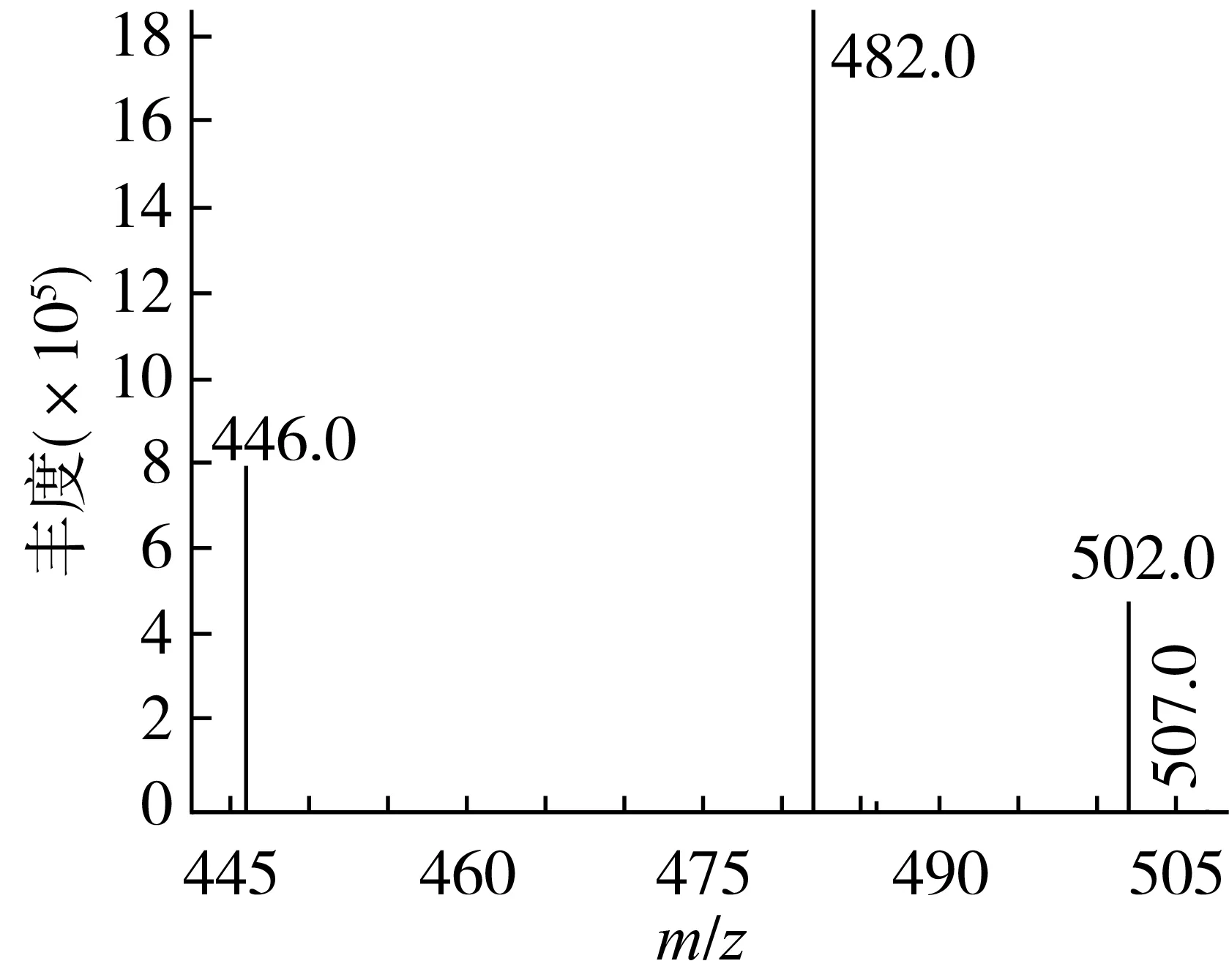
图2 3-MCPD衍生物的质谱图

图3 d5-3-MCPD衍生物的GC-NCI-MS的质谱图
2.2.2 加标回收率
取12份胡麻油初榨油样品(105 ℃炒籽压榨并加热至200 ℃,加热0.5 h的胡麻油),其中3份空白对照,其余样品中分别加入0.25,0.5,1.0 mg/kg 3-MCPD棕榈酸二酯标准液,每组做3个平行样,经过样品前处理后检测3-MCPD酯含量,计算相应的加标回收率和RSD,如表2所示。结果表明3-MCPD脂肪酸酯的平均加标回收率在80.47%~81.68%之间,RSD 5.60%~8.35%。表明本研究所建立的方法的准确度和精密度较高,适用于胡麻油中3-MCPD酯含量的测定。
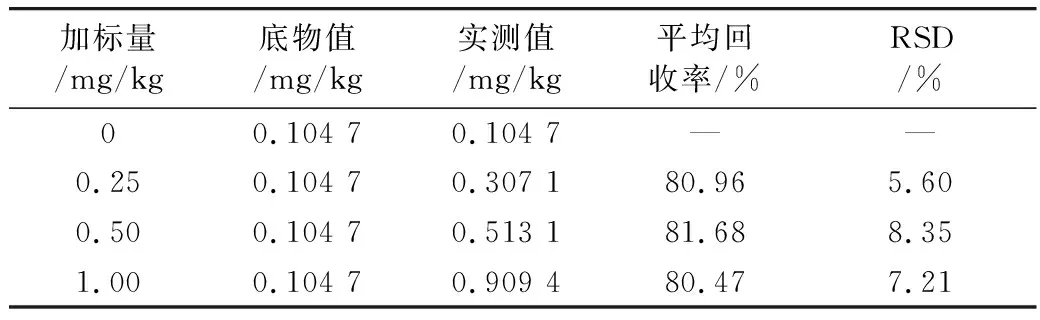
表2 加标回收率和相对标准偏差(n=6)
2.3 初榨胡麻油中3-MCPD酯的消长规律
2.3.1 低温炒籽对于初榨胡麻油中3-MCPD酯生成的影响
分别取新鲜胡麻籽1kg 3份,于常温(25 ℃)、45、65、85、105 ℃烘箱内烘烤30 min后用家用榨油机榨取胡麻油。将榨取物装于离心管中于-4 ℃,5 000 r/min离心20 min后取出上层油液冷藏保存备用并进行GC-NCI-MS检测分析。结果如图4所示,低温炒籽对于胡麻油中3-MCPD酯含量的影响不大,且炒籽后压榨的胡麻油中3-MCPD酯的含量处于一个较低的水平。
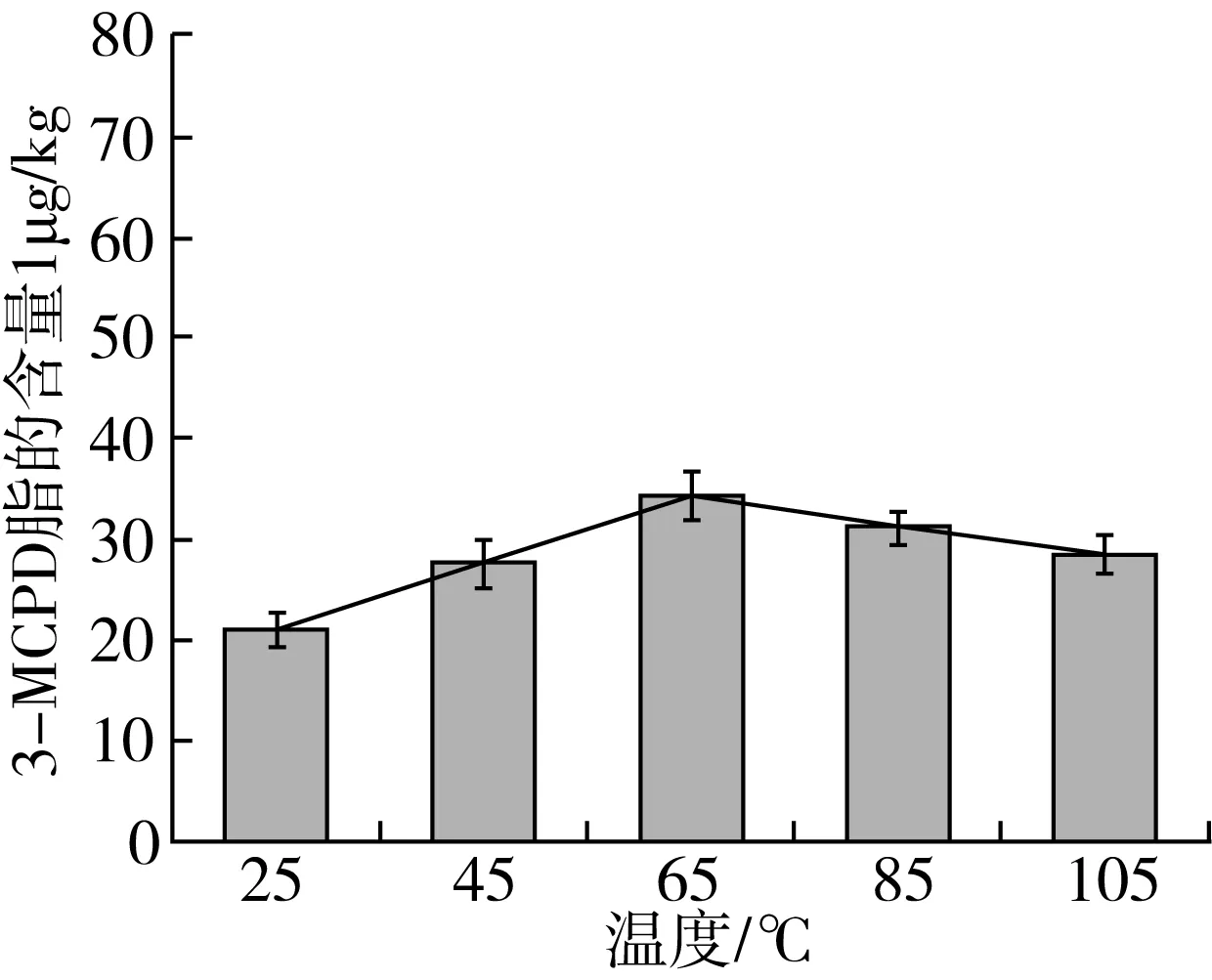
图4 炒籽温度对于初榨胡麻油中3-MCPD酯含量的影响
2.3.2 温度对于初榨胡麻油中3-MCPD酯生成的影响
取5支试管,分别加入105 ℃炒籽温度压榨的胡麻油8 g,分别置于恒温二甲基硅油油浴锅内加热至160、180 、200 ℃,加热时间为2 h。实验结束后取出油样待冷却后进行分析检测,结果如图5所示。结果表明随着温度的升高,胡麻油中3-MCPD酯的含量也在逐渐上升,但上升程度不明显。这说明对于初榨胡麻油来说,高温加热对于3-MCPD酯含量的影响不大。这与Mogol等[5]发现在饼干烤制程中,3-氯丙醇及其酯的含量随温度上升而显著增大的研究而言有点相悖,原因可能是由于初榨胡麻油未经过工业精炼过程脱胶,脱酸,脱色等以及水洗步骤。脱胶、脱色以及水洗环节的酸带入,氯离子带入都可能是影响其3-MCPD酯的生成。
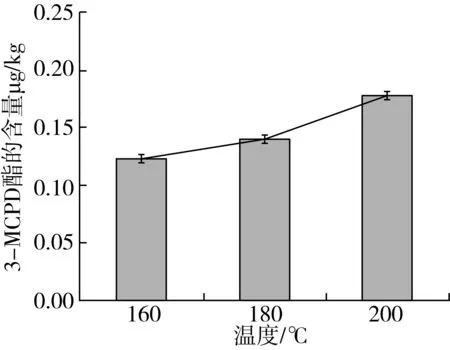
图5 温度对于初榨胡麻油中3-MCPD酯含量的影响
2.3.3 加热时间对初榨胡麻油中3-MCPD酯的生成的影响
取5支试管,分别加入105 ℃炒籽温度压榨的胡麻油8 g,置于恒温二甲基硅油油浴锅内加热至200 ℃,每支试管分别加热0.5、1.0、1.5、2.0、2.5 h。取出油样待冷却后进行GC-NCI-MS分析检测,结果如图6所示。结果表明随着加热时间的增加,胡麻油中的3-MCPD酯含量呈逐渐上升的趋势,但对于初榨胡麻油来说,3-MCPD酯的含量上升不明显,这或许与2.3.3中温度的影响一致。

图6 高温加热时间对于初榨胡麻油中3-MCPD酯含量的影响
2.3.4 氯离子对于胡麻油中3-MCPD酯生成的影响
取3支试管,分别加入105 ℃炒籽温度压榨的胡麻油8 g,第1支试管加入100 μL蒸馏水,第2支试管加入100 μL质量分数为10%的NaCl溶液置于恒温二甲基硅油油浴锅内加热至200 ℃,加热2 h。取出油样待冷却后进行GC-NCI-MS分析检测,结果如图7所示。结果表明,随着加入NaCl的含量的增加,初榨胡麻油中3-MCPD酯的含量呈上升趋势,且上升的趋势明显。这表明氯离子的含量对于初榨胡麻油中3-MCPD酯的生成具有重要影响,这与Freudenstein等[14]的研究成果不谋而合。

图7 氯离子对于胡麻油中3-MCPD酯含量的影响
含氯化合物是3-MCPD酯的前体物质之一,胡麻油工业精炼需经过脱胶,脱酸,脱色,脱臭等步骤。若采用磷酸进行脱胶,可能会增加食用油中氯离子的含量,工业水洗也会导致油中氯离子含量的变化。Craft等[15]以及Matthäus等[16]的研究表明,通过水(不含氯化物)或者乙醇洗涤未精炼的食用油可以部分的除去未精炼的油中的含氯化合物,进而有效的限制精炼过程中3-MCPD酯的形成。
3 结论
3.1 采用甲醇钠-甲醇碱水解,固相萃取柱净化,结合同位素稀释-气相色谱-负化学离子源-质谱方法对胡麻油中3-MCPD酯含量的测定。该方法在0.01~0.10 mg/kg范围内线性关系良好,检出限为5 μg/kg,定量限为20 μg/kg。加标回收率在80.47%~81.68%之间,RSD 5.60%~8.35%。表明本研究所建立的方法的准确度和精密度较高,适用于胡麻油中3-MCPD酯含量的测定。
3.2 炒籽温度对于初榨胡麻油中3-MCPD酯生成没有多大影响。低温炒籽对于初榨胡麻油中3-MCPD酯生成没有影响。将初榨胡麻油油样加热至在160~200 ℃时,初榨胡麻油中3-MCPD酯的生成随加热温度的升高以而增加,但增加不明显。当初榨胡麻油油样加热至200 ℃条件下,初榨胡麻油中3-MCPD酯的生成随加热时间的增加而增加,但增长不显著。当初榨胡麻油油样加热至200 ℃条件下,随着初榨胡麻油中氯离子含量的增加,初榨胡麻油中3-MCPD酯呈显著上升趋势。
[1]孟甜.胡麻油营养分析及应用研究进展[J]. 粮食与油脂, 2015, 28(5): 5-8
MENG Tian. Progress and application research in nutrition analysis of flaxseed oil[J]. Cereals & Oils
[3]MACMAHON S, BEGLEY T H, DIACHENKO G W. Occurrence of 3-MCPD and glycidyl esters in edible oils in the United States[J]. Food Additives & Contaminants: Part A, 2013, 30(12): 2081-2092
[4]ABD RAZAK R A, KUNTOM A, SIEW W L, et al. Detection and monitoring of 3-monochloropropane-1,2-diol(3-MCPD) esters in cooking oils[J]. Food Control, 2012, 25(1): 355-360
[5]MOGOL B A, PYE C, ANDERSON W, et al. Formation of Monochloropropane-1,2-diol and Its Esters in Biscuits during Baking[J]. J Agric Food Chem, 2014, 62(29): 7297-7301
[6]JEDRKIEWICZ R, GLOWACZ A, GROMADZKA J, et al. Determination of 3-MCPD and 2-MCPD esters in edible oils, fish oils and lipid fractions of margarines available on Polish market[J]. Food Control, 2016, 59: 487-492
[7]DOLEZAL M, CHALOUPSKM, DIVINOVV, et al. Occurrence of 3-chloropropane-1,2-diol and its esters in coffee[J]. Eur Food Res Technol, 2005, 221(3): 221-225
[10]LIU Q, HAN F, XIE K. Simultaneous determination of total fatty acid esters of chloropropanols in edible oils by gas chromatography-mass spectrometry with solid-supported liquid-liquid extraction[J]. Journal of Chromatography A, 2013, 1314: 208-215
[11]徐小民, 沈向红, 宋国良, 等. 气相色谱质谱联用负化学源法检测方便面调料包中的氯丙醇[J]. 中国卫生检验杂志, 2006, 16(6) :661-726
XU Xiaomin, SHEN Xianghong, SONG Guoliang, et al. Determination of chloropropanols in flavoring of instant noodles by gas chromatography-mass spectrometry with negative chemical ionization[J]. Chinese Journal of Health Laboratory Technology
[12]魏雪缘, 蔡理胜, 张睿, 等. 气相色谱-负化学离子源-质谱测定食用植物油中3-氯丙醇酯的含量[J]. 食品安全质量检测学报, 2016, 7(11): 4484-4489
WEI Xueyuan, CAI Lisheng, ZHANG Rui, et al. Determination of 3-chloro-1,2-propylene glycol ester in edible vegetable oils by gas chromatography-negative chemical ionization-mass spectrometry[J]. Journal of Food Safety and Quality
[13]BERGER-PREIβ E, GERLING S, APEL E, et al. Development and validation of an analytical method for determination of 3-chloropropane-1,2-diol in rat blood and urine by gas chromatography-mass spectrometry in negative chemical ionization mode[J]. Anal Bioanal Chem, 2010, 398: 313-318
[14]FREUDENSTEIN A, WEKING J, MATTHUS B. Influence of precursors on the formation of 3-MCPD and glycidyl esters in a model oil under simulated deodorization conditions[J]. Eur J Lipid Sci Technol, 2013, 115(3): 286-294
[15]CRAFT B D, NAGY K. Mitigation of MCPD-ester and glycidyl-ester levels during the production of refined palm oil[J]. Lipid Technology, 2012, 24(7): 155-157
