miR-130b靶向STAT3参与家兔非特异性消化道紊乱型肠炎的调节
2018-06-05何洪炳蔡明成梁小虎赖松家四川农业大学动物科技学院遗传所四川成都611130
何洪炳,蔡明成,梁小虎,赖松家(四川农业大学动物科技学院遗传所,四川 成都 611130)
【研究意义】兔流行性肠炎病(Epizootic rabbit Enteropathy,ERE)[1-2]的病因复杂,根据病原体的类型肠道疾病被分为特异性肠炎(Specific Enteropathies)和非特异性消化道紊乱(Non-Specific Digestive Disorders,NSDD)。特异性肠炎主要来源一些特定病原微生物,如细菌、病毒和毒素、寄生虫等。非特异性消化道紊乱无特定致病病原微生物,病因十分复杂,饲养管理不当、日粮纤维不当、环境温湿度的变化引起的应激等均可诱发肠炎。已有研究表明,在饲养环境和管理良好的条件下,日粮中粗纤维含量和种类是诱发家兔非特异性消化道紊乱疾病的重要因素[3]。【前人研究进展】圆小囊是家兔特有的免疫淋巴器官,位于家兔回肠末端,属于肠道的组成部分,呈膨大结构,具有消化、免疫和神经内分泌等功能。已有的研究表明,家兔圆小囊能特异性摄取肠腔内的生物大分子和微生物到淋巴细胞中[4],参与整个肠道免疫调控。圆顶上皮(dome epithelium)是一个传递抗原的通道,作为圆小囊重要的免疫组成部分,在传递抗原的同时也可以抵抗和防止抗原侵入组织深部淋巴组织,在肠道免疫防御中发挥重要的作用[5-8]。MicroRNAs是一种长度约为23 bp的单链非编码RNA[9],可靶向mRNA的3’端非翻译区(UTR)发挥调控作用,不完全靶向抑制转录后翻译,完全靶向则引发降解。MicroRNAs可以参与调节哺乳动物的生长发育、细胞分化、细胞增殖、细胞凋亡等生命活动[10-13]。人类基因组中预测并鉴定了超过1000 miRNAs,调节成千上万的人类蛋白编码基因[14-15]。近年来,miRNAs被认为是调节体内免疫反应的关键因子,miRNAs在系统性红斑狼疮[16]、类风湿性关节炎[17]、银屑病[18]和炎症性肠炎病(Inflammatory bowel disease,IBD)[19]存在表达差异且与自身免疫病显著相关。通过对人IBD外周血和各个组织的miRNAs测序表明miRNAs参与IBD的调节[20]。在体外细胞和诱导肠炎的模式动物中,也验证了一些关键的miRNAs可调控信号通路参与IBD发病过程。综上表明,miRNAs在人IBD中存在差异表达,暗示其在肠炎中起重要的调节作用,同时也可以作为分子标记预防和治疗肠炎。【本研究切入点】本研究通过构建家兔非特异性消化道紊乱型肠炎模型,鉴定不同肠炎程度家兔中圆小囊miR-130b的表达趋势,同时利用生物信息学软件分析其靶基因,研究miRNA-130b与靶基因之间的联系,探讨miR-130b在家兔肠炎中的调控模式。【拟解决的关键问题】为家兔肠炎的预防与治疗提供分子基础。
1 材料与方法
1.1 动物模型构建
本实验选用60只49日龄的健康新西兰兔作为试验兔,10只饲喂正常饲料,50只饲喂低纤维饲料(纤维素CF 9 %、木质素ADF 13 %)诱导非特异性消化道紊乱型肠炎。试验前预饲喂7 d适应环境,正式试验14 d,日粮饲喂量为自由采食的85 %,正式试验期每天观察试验兔临床表现1次,并记录试验兔的临床症状。70日龄时,通过耳缘静脉注射戊巴比妥钠致死(符合动物福利保护法),进行病理学检查记录和样品的采集。
1.2 样品的采集
采集圆小囊组织样本1 g并用锡箔纸包裹置于-80 ℃液氮中用于RNA的抽提。组织切片样本的采集,取试验兔的空肠、结肠(取肠段相同的部位),用4 %多聚甲醛浸泡固定,在四川农业大学动物医学院制作切片。
1.3 临床观察、解剖症状评分和切片观察
观察试验兔的饮食、饮水、腹胀情况及排泄物状态等,临床患病指标的判定和记录参照Bennegadi的方法[21]。解剖死亡兔,观察并记录其消化道临床症状。主要观察各肠段、肠系膜出血情况、肠系膜淋巴结、圆小囊等免疫器官的变化。切片用HE染色后在高倍视野中(200×)观察每张切片,对隐窝、粘膜固有层、上皮细胞、凋亡细胞及杯状细胞等的变化。
1.4 实时荧光定量PCR检测
采用Trizol法提取圆小囊的总RNA。参照反转录试剂盒(Takara,Mir-XTMmiRNA First-Strand Synthesis Kit 货号:1604342A和Takara, PrimeScriptTMRT reagent Kit with gDNA Eraer 货号AK4002)进行miRNA和mRNA的反转录,得到各自的cDNA。利用miRBase和NCBI等在线工具,得到该miRNA的成熟序列,采用加尾法设计miRNA的引物,由成都擎科生物科技有限公司合成。下游引物是试剂盒自带,内参用试剂盒自带U6作为引物。采用SYBR®Green I进行荧光定量,参照试剂盒说明书进行(Takara 货号:AK9801),10 μl体系:5 μl SYBR®Green I,0.4 μl Forward、Reverse引物,3.2 μl ddH2O,1μl cDNA。
1.5 靶基因的预测
利用Targetscan、miRBase和miRWalk等生物信息学在线工具预测和用DAVID信号通路富集筛选出miR-130b的靶基因。
1.6 数据的统计与分析
实验荧光定量结果用Excel初步统计并采用2-△△ct进行分析,运用SAS8分析软件进行显著性分析,结果采用“平均值±标准差”表示。用SigmaPlot软件计算STAT3和miR-130b表达量的皮尔逊相关性。

表1 临床评分(CSS)Table 1 Clinical score (CSS)
2 结果与分析
2.1 临床观察和解剖症状评分
每天对试验兔采食情况、排泄物、腹胀情况进行观察记录(表1);临床症状的评分标准为(clinical symptom score, CSS):0分,无症状;1分,采食量变少,粪便呈串连状;2分,腹部臌胀、腹泻严重、盲肠有结块等有明显的患肠炎现象。预饲期因环境应激,健康对照和诱导组均死去1只,正式试验期诱导组因严重腹泻死亡10只。去除因患病死去12只,最终得到对照健康组9只、诱导健康组10、诱导轻微组9只、诱导严重组20只。
解剖症状观察评分标准(GLS)见表2:无症状, 0分;1个肠段出现胀气,内有大量粘液等,1分; 2个以上肠道胀气、肠壁变厚、大量粘液或肠系膜出血等,2分。除去因患病严重或其他原因死去12只(同上),最终得到对照健康组9只、诱导健康组10、诱导轻微组11只、诱导严重组18只。
2.2 切片观察
组织病理学切片观察与分析发现,在空肠和结肠炎症组织中,都存在组织损伤及炎性损伤、隐窝结构异常。在空肠中并未发现淋巴细胞和红细胞的内容物,但存在局部上皮细胞坏死、溶解,而且伴有中性粒细胞的侵润(图1 B空肠严重,红色箭头);粘膜固有层、粘膜下层结缔组织间质有炎症细胞的侵润(图1 B空肠严重,黑色箭头),肌层纤维发生不同程度的溶解,肌膜有轻度溶解,伴有炎性细胞的侵润(图1 B空肠严重,黄色箭头)。
在结肠严重组切片中,可见其隐窝结构异常,隐窝变大变空,且杯状细胞部分融合(图1 D结肠严重,红色箭头);上皮细胞的形态发生变化,有坏死溶解现象,伴有炎症粒细胞的侵润(图1 D结肠严重,黄色箭头)。肌层纤维发生不同程度的溶解,肌膜有轻度溶解,伴有炎性细胞的侵润(图1 D结肠严重,黑色箭头)。
通过对试验兔临床症状,解剖学症状和切片的观察将其分为健康对照组、诱导健康组、轻微组、严重组。

表2 剖检评分(GLS)Table 2 Score of necropsy (GLS)
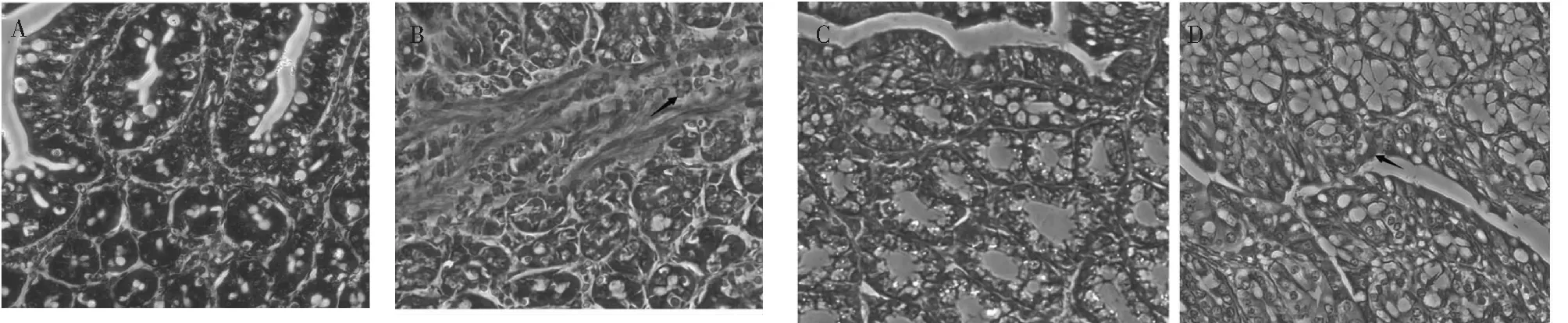
(A)空肠健康对照病理切片(H.E.200X);(B)空肠严重组病理切片(H.E.200X); (C)结肠健康对照病理切片(H.E.200X);(D)结肠严重对照病理切片(H.E.200X)图1 组织病理学切片 Fig.1 Histopathological section

图2 生物学信息预测miR-130b靶基因为STAT3 Fig.2 Biological information predicts that the target gene of miR-130b is STAT3
2.3 生物信息学预测miR-130b靶基因
对miR-130b靶基因进行生物信息学预测,用DAVID进行炎症相关的基因富集,通过筛选,STAT3可作为miR-130b的靶基因(图2)。
2.4 定量检测结果
本试验引物信息见表3。
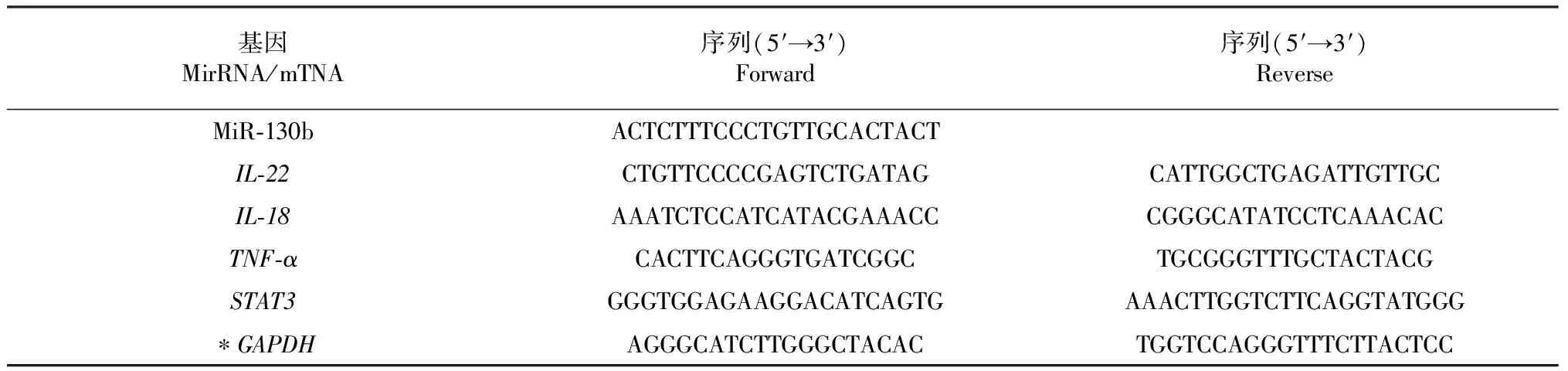
表3 试验引物信息Table 3 Tested primer information
注: ‘*’表示该基因为内参基因。
Note: ‘*’ said the gene as a reference gene.

(A)IL-22;(B)TNF-α;(C)IL-18* 表示0.01≤ P ≤ 0.05; ** 表示 P <0.01; *** 表示0.001≤ P ≤0.005; **** 表示 P <0.001图3 炎症因子在圆小囊中的表达量Fig.3 Expression of inflammatory factors in sacculus

(A)miR-130在圆小囊中的表达量;(B)STAT3在圆小囊中的表达量 * 表示0.01≤ P≤0.05; ** 表示 P <0.01; *** 表示0.001≤ P≤ 0.005; **** 表示 P <0.001图4 miR-130和STAT3在圆小囊中的表达量Fig.4 Expression of miR-130 and STAT3 in the sacculus rounds
通过qPCR检测,发现在家兔圆小囊中,IL-22、TNF-α和IL-18的表达随着患肠炎程度的加重呈上调趋势(图3)。IL-22和TNF-α在严重组的表达量极显著高于对照健康(P<0.01),同时轻微组和诱导健康组也显著高于健康对照组(P<0.05)。IL-18在严重组的表达量极显著高于健康对照组和轻微组(P<0.01),显著高于诱导健康组(P<0.05),而健康对照组、诱导健康组和轻微组表达无显著差异。
不同肠炎程度的家兔圆小囊中miR-130b的表达量研究发现,miR-130b随着患肠炎程度的加深表达下调趋势,诱导健康组、轻微组和严重组都极显著低于健康对照组(P<0.01),并且,轻微患病组和严重患病组也极显著低于诱导健康组(P<0.01)。轻微组和严重组之间差异不显著(图4 A)。
同时,利用RT-qPCR技术检测了靶基因STAT3在圆小囊各种患肠炎状态下的表达量,发现在圆小囊中,STAT3随着肠炎严重程度的加深而表达上升。严重组极显著高于健康对照组、诱导健康组和轻微组(P<0.01),且轻微组极显著高于健康对照组(P<0.01),诱导健康组和轻微组差异不显著,健康对照组和诱导健康组差异不显著(图4 B)。

图5 患肠炎圆小囊组织中STAT3与miR-130b的相关性分析Fig.5 Analysis of the correlation between STAT3 and miR-130b in the tissues of enteritis sacculus
2.5 相关性分析
由图5可以看出,SigmaPlot软件计算所有STAT3和miR-130b表达量的皮尔逊相关性发现,在家兔肠炎圆小囊中,miR-130b和STAT3的表达量称显著的负相关(r=-0.635,P<0.01)。
3 讨 论
家兔肠炎可能由多种因素引起,研究已经发现能够引起特异性肠炎的病原微生物主要有大肠杆菌、病毒、真菌等,其中大肠杆菌(Esherichiacoli)引起的肠炎最为普遍[22-23]。由日粮粗纤维不适引起的腹泻,外界应激性引起的腹泻,出血性肠炎和兔流行性肠炎等疾病[24; 21-22]为非特异性肠炎。家兔日粮中的纤维对家兔来说可促进消化系统的发育,增强胃肠道蠕动等功能有尤为重要的作用。有研究表明日粮中纤维素(CF)<12 %、木质素(ADF)<15 %则会引起家兔非特异性免疫[25-26]。
本试验利用低纤维诱导家兔非特异性消化道紊乱型肠炎模型,根据家兔临床症状、解剖病理学评分发现在肠炎发生过程中,家兔会随着炎症程度的加深出现不同的临床症状,而且其肠道也会发生不同程度的病变。切片观察发现空肠和结肠的隐窝变大且上皮细胞和杯状细胞溶解出现不同程度的溶解,粘膜固有层、粘膜下层的结缔组织间质存在大量的炎症细胞的侵润。炎症细胞主要包括巨噬细胞、粒细胞(GRAN)、淋巴细胞等,它们的持续存在导致了肠炎反应的持续,试验结果低纤维日粮可以诱发家兔非特异性消化道紊乱型肠炎的发生,各肠段病理学变化与家兔感染性实验(ERE)相似[27]。炎症性细胞可以上调肿瘤坏死因子(tumornecrosisfactor-α)[28]、IL-18[29]和IL-22[30]影响肠炎的发生,其研究结果与本实验结果一致。通过临床症状和解剖学评分及病理学切片的观察,和检测炎症因子的表达情况,能够充分说明本试验诱导肠炎模型成功,样本可进行下一步试验。
近年来,大量研究表明miRNAs在肠炎组织中存在异常表达,并证实miRNAs参与肠炎的发生。wu等[20]检测了miRNAs在溃疡性结肠炎中的表达差异,发现miR-16、miR-21、miR-23a等9个microRNAs表达上调,miR-192、miR-375和miR-422b表达下调。这表明miRNAs在肠炎的发生过程中发挥着重要的作用。本试验研究发现,miR-130b在家兔低纤维日粮诱导的非特异性消化道紊乱型肠炎的兔圆小囊中表达均明显下调,提示miR-130b可能是参与肠炎发生的新的因子。miR-130b被越来越多的研究证实在多种疾病中发挥重要的作用。在胃癌、结直肠癌、子宫内膜癌等的发生和发展研究中发现, miR-130b可促进癌细胞的增殖和侵袭[31-33]。另外,miR-130b下调可以导致活化的成纤维细胞和上皮-间充质串扰促进失调,进而影响肺腺上皮细胞IGF-1的分泌,提示miRNA-130b的调控作用可预防肺纤维化[34]。这些研究结果充分说明miR-130b广泛参与细胞各种生命活动。
为了更深一步探索miR-130b参与家兔非特异性消化道紊乱型肠炎的发病机制,为家兔肠炎治疗奠定知识基础,本研究通过生物信息学在线工具预测及分析,得到STAT3可作为miR-130b的直接靶基因,通过qPCR定量发现,在患肠炎的家兔圆小囊组织内miR-130b和靶基因STAT3的表达量呈显著负相关,且STAT3随患病程度加深而升高。家兔和人源性的miR-130b及STAT3的3'UTR均十分保守,预测结果为且miR-130b与STAT3的3'UTR区有一段相互匹配,存在miR-130b直接调控STAT3直接调控的可能性。有研究表明,STAT3缺失会导致斑马鱼脊柱畸形和免疫障碍[35],Gang Zhao等[36]发现miR-130b在人胰腺癌组织对比癌旁组织的表达量显著下调,STAT3在胰腺癌组织中表达显著上调,两者之间存在显著的负相关,并用双荧光素酶报告证实了miR-130b可直接靶向STAT3,证明STAT3可作为miR-130b的靶基因,参与胰腺癌的发生,与本试验结果一致。另外有研究表明IL-6可以通过JAK/STAT3信号通路活化STAT3,活化的STAT3可激活相关炎症通路,而抑制IL-6的信号可导致减少STAT3活化,进而减少IL-10的表达,由于IL-10缺乏的缺乏进而导致的结肠炎的发生[37]。有研究表明,敲除小鼠IL-6基因后再诱导发生结肠炎的实验中,JAK//STAT信号通路中,活化的STAT3水平随着炎症程度的降低而降低,表明了STAT3的活化是炎症发生的重要诱因[38]。多项研究表明,在IBD患者炎症肠粘膜中,通过荧光定量和蛋白检测发现总的STAT3和磷酸化的STAT3水平均高表达,进一步研究发现磷酸化的STAT3水平与炎症严重程度呈正相关[39-40]。同时,有研究发现抑制IL-6 /STAT3的级联效应能导致获得性免疫介导的结肠炎被抑制[41]。 Koukos 等[42]对UC儿童和试验诱导小鼠结肠炎的实验中发现,miR-124在炎症组织中表达量显著下调,STAT3和它下游基因的表达水平均显著上调。同时他们也证明,下调miR-124可以增加STAT3的表达和从而促进炎症和UC肠炎病的发生。以上各项研究都表明了IL-6/STAT3信号通路参与肠炎的发生过程,STAT3是参与炎症发生的重要调控因子。
4 结 论
本研究结果表明,STAT3的3’-UTR区可能是家兔miR-130b的潜在的作用靶点,与家兔患非特异性消化道紊乱型肠炎显著相关,在家兔患非特异性消化道紊乱型肠炎的持续过程中miR-130b显著下调,可能增加STAT3的表达和活性,促进下游基因的转录,进而促进炎症的发生。这项研究也暗示了miR-130b在家兔肠炎的发生和发展中有重要的调节作用。总的来说,miR-130b可能作为家兔炎症发生的标志物和抑制剂。
参考文献:
[1]Licois D, Coudert P, Ceré N, et al. Epizootic enterocolitis of the rabbit: review of current research[J]. World Rabbit Sci, 2000, 8: 187-194.
[2]Jones J, Duff J. Rabbit epizootic enterocolitis[J]. Vet. Rec., 2001, 149(17): 532.
[4]Simecka J W. Mucosal immunity of the gastrointestinal tract and oral tolerance[J]. Adv. Drug. Deliv. Rev., 1998, 34(2): 235-259.
[5]刘 环,佘锐萍,宋俊霞,等. 兔圆小囊免疫功能及其与肠道粘膜局部免疫关系的研究 Ⅳ. 实验性感染肠球虫兔的圆小囊上皮间淋巴细胞及杯状细胞定量观察[J]. 畜牧兽医学报,1997,28(5):448-452.
[6]She R-P, Liu H-H, Jia J-Z, et al. Observation on ultrastructure of gut-associated lymphoid tissue-sacculus rotundus of rabbit[J]. JOURNAL-CHINESE ELECTRON MICROSCOPY SOCIETY, 2002, 21(4): 359-363.
[7]She R-P, Yang H-C, Jia J-Z, et al. Ultrastructural pathologic observation on the Gut-associated lymphoid tissues of sacculus rotundus of rabbits infected with rabbit haemorrhagic disease virus[J]. Agricultural Sciences in China, 2003, 2(4): 446-453.
[8]佘锐萍,杨汉春,马毅新,等. 不同日月龄兔感染 RHDV 后圆小囊的比较病理学观察[J]. 中国农业大学学报,2004,9(1):49-53.
[9]Gregory R I, Chendrimada T P, Cooch N, et al. Human RISC couples microRNA biogenesis and posttranscriptional gene silencing[J]. Cell, 2005, 123(4): 631-640.
[10]Ambros V. MicroRNA pathways in flies and worms: growth, death, fat, stress, and timing[J]. Cell, 2003, 113(6): 673-676.
[11]Carrington J C, Ambros V. Role of microRNAs in plant and animal development[J]. Science, 2003, 301(5631): 336-338.
[12]Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[13]Boehm M, Slack F. A developmental timing microRNA and its target regulate life span inC.elegans[J]. Science, 2005, 310(5756): 1954-1957.
[14]Berezikov E, Guryev V, Van De Belt J, et al. Phylogenetic shadowing and computational identification of human microRNA genes[J]. Cell, 2005, 120(1): 21-24.
[15]Lewis B P, Burge C B, Bartel D P. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120(1): 15-20.
[16]崔慧娟, 唐元家, 罗晓兵, 等. 系统性红斑狼疮患者中 miR-146a 表达缺陷与 I 型干扰素通路过度活化相关[J]. 现代免疫学, 2008(4).
[17]钱 龙, 高登文, 汪国生, 等. Pre-miR-146a 基因 rs2910164 位点单核苷酸基因多态性及 miR-146a 表达与类风湿关节炎相关性研究[J]. 中华微生物学和免疫学杂志, 2012, 32(3): 253-257.
[18]孙中斌, 晋 亮, 党二乐, 等. MiR-486-3p 在银屑病皮损的表达及对角蛋白 17 表达的影响[J]. 中华皮肤科杂志, 2013, 46(3): 160-163.
[19]Clark P M, Dawany N, Dampier W, et al. Bioinformatics analysis reveals transcriptome and microRNA signatures and drug repositioning targets for IBD and other autoimmune diseases[J]. Inflamm. Bowel. Dis., 2012, 18(12): 2315-2333.
[20]Wu F, Zikusoka M, Trindade A, et al. MicroRNAs are differentially expressed in ulcerative colitis and alter expression of macrophage inflammatory peptide-2α[J]. Gastroenterology, 2008, 135(5): 1624-1635. e24.
[21]Bennegadi N, Gidenne T, Licois D. Impact of fibre deficiency and sanitary status on non-specific enteropathy of the growing rabbit[J]. Anim Res, 2001, 50(5): 401-413.
[22]De Blas J, Carabao R, Chamorro S, et al. Review. New trends in rabbit feeding: influence of nutrition on intestinal health[J]. Spanish Journal of Agricultural Research (Espaa), 2008.
[23]Schlolaut W, Hudson R, Rödel H. Impact of rearing mangement on health in domestic rabbits: a review[C]. World Rabbit Science, 2013: 145-159.
[24]Whitney J. A review of non-specific enteritis in the rabbit[J]. Lab. Anim., 1976, 10(3): 209-221.
[25]Haligur M, Ozmen O, Demir N. Pathological and ultrastructural studies on mucoid enteropathy in New Zealand rabbits[J]. Journal of Exotic Pet Medicine, 2009, 18(3): 224-228.
[26]朱岩丽, 李福昌, 王春阳, 等. 不同中性洗涤纤维与淀粉比例饲粮对生长肉兔生产性能, 盲肠发酵及胃肠道发育的影响[J]. 动物营养学报, 2013, 25(8): 1791-1798.
[27]Dewrée R, Meulemans L, Lassence C, et al. Experimentally induced epizootic rabbit enteropathy: clinical, histopathologicaI, ultrastructural, bacteriological and haematological findings[J]. World Rabbit Science, 2010, 15(2): 91-102.
[28]Mahida Y R. The key role of macrophages in the immunopathogenesis of inflammatory bowel disease[J]. Inflamm. Bowel. Dis., 2000, 6(1): 21-33.
[29]Papadakis K A, Targan S R. Role of cytokines in the pathogenesis of inflammatory bowel disease[J]. Annu. Rev. Med., 2000, 51(1): 289-298.
[30]Wolk K, Kunz S, Witte E, et al. IL-22 increases the innate immunity of tissues[J]. Immunity, 2004, 21(2): 241-254.
[31]Lai K W, Koh K X, Loh M, et al. MicroRNA-130b regulates the tumour suppressor RUNX3 in gastric cancer[J]. Eur. J. Cancer, 2010, 46(8): 1456-1463.
[32]Colangelo T, Fucci A, Votino C, et al. MicroRNA-130b promotes tumor development and is associated with poor prognosis in colorectal cancer[J]. Neoplasia, 2013, 15(9): 1086-1099.
[33]Li B-L, Lu C, Lu W, et al. miR-130b is an EMT-related microRNA that targets DICER1 for aggression in endometrial cancer[J]. Med Oncol, 2013, 30(1): 484.
[34]Li S, Geng J, Xu X, et al. miR-130b-3p modulates epithelial-mesenchymal crosstalk in lung fibrosis by targeting IGF-1[J]. PLoS. ONE, 2016, 11(3): e0150418.
[35]Xiong S, Wu J, Jing J, et al. Loss of stat3 function leads to spine malformation and immune disorder in zebrafish[J]. Science Bulletin, 2017, 62(3): 185-196.
[36]Zhao G, Zhang J-G, Shi Y, et al. MiR-130b is a prognostic marker and inhibits cell proliferation and invasion in pancreatic cancer through targeting STAT3[J]. PLoS. ONE, 2013, 8(9): e73803.
[37]Atreya R, Mudter J, Finotto S, et al. Blockade of interleukin 6 trans signaling suppresses T-cell resistance against apoptosis in chronic intestinal inflammation: evidence in crohn disease and experimental colitis in vivo[J]. Nat. Med., 2000, 6(5): 583-588.
[38]Suzuki A, Hanada T, Mitsuyama K, et al. CIS3/SOCS3/SSI3 plays a negative regulatory role in STAT3 activation and intestinal inflammation[J]. J. Exp. Med., 2001, 193(4): 471-482.
[39]Lovato P, Brender C, Agnholt J, et al. Constitutive STAT3 activation in intestinal T cells from patients with Crohn’s disease[J]. J Biol Chem, 2003, 278(19): 16777-16781.
[40]Musso A, Dentelli P, Carlino A, et al. Signal transducers and activators of transcription 3 signaling pathway. An Essential Mediator of Inflammatory Bowel Disease and Other Forms of Intestinal Inflammation[J]. Inflamm. Bowel. Dis., 2005, 11(2): 91-98.
[41]Sugimoto K. Role of STAT3 in inflammatory bowel disease[J]. World. J. Gastroenterol., 2008, 14(33): 5110-5114.
[42]Koukos G, Polytarchou C, Kaplan J L, et al. MicroRNA-124 regulates STAT3 expression and is down-regulated in colon tissues of pediatric patients with ulcerative colitis[J]. Gastroenterology, 2013, 145(4): 842-852.
