金发草LEA3基因2个剪接体转化烟草的抗干旱胁迫能力分析
2018-06-05王文国陈晓仪
李 锐,王文国,赵 琦,陈晓仪,徐 莺
(1. 成都大学药学与生物工程学院,四川 成都 610106;2. 农业部沼气科学研究生物质能技术研究中心,四川 成都 610041;3. 四川大学生命科学学院,四川 成都 610064)
【研究意义】干旱是影响作物生长和限制农业生产的一个重要因素,现在全球范围内大约有1/3以上的土地处于干旱或半干旱状态,极大浪费了土地资源,并且植物在生长过程中经常会受到干旱的影响[1]。我国水资源短缺较严重,因此利用植物基因工程克隆抗旱基因,研究抗旱机理,培育耐旱作物新品系尤为重要。LEA3蛋白因其特殊的结构(含有11-氨基酸基元序列)可作为渗透调节蛋白和脱水保护剂来参与植物的渗透调节。干旱发生时,植物体内的LEA3蛋白大量表达可以缓解干旱造成的危害[2-4]。因此关于LEA3蛋白的抗旱功能研究广受关注,并通过转基因手段改良作物的抗逆功能[5-6]。金发草(Pogonatherumpaniceum)是一种耐旱性极强的植物,在我国及东南亚、大洋洲的热带、亚热带地区广泛分布,是进行抗旱基因克隆和抗旱机理研究的理想材料[7]。【前人研究进展】由于真核生物的可变剪接现象,金发草LEA3基因存在2个剪接体(PpLEA3.a和PpLEA3.b),与PpLEA3.a相比,PpLEA3.b保留了以疏水性为主的第2个内含子,该内含子的存在改变了LEA蛋白的亲水性,进而可能影响蛋白质的功能,鉴于这2个剪接体在氨基酸序列和预测的空间结构上都有较大的差异,笔者先前研究已经通过酿酒酵母表达系统鉴定了这些差异在细胞内产生的耐受性的差异,发现2个剪接体在不同非生物胁迫下抗逆能力存在差异,尤其在模拟干旱条件下,剪接体重组菌的生存能力大幅提高,且PpLEA3.a比PpLEA3.b表现出更强的耐受能力[8]。【本研究切入点】为了进一步鉴定金发草LEA3 2个剪接体在植物体内的功能以及功能之间的差异,本研究分别将2个剪接体基因构建到植物高效表达载体中,利用遗传转化的方法获得烟草的转基因植株,对其T2代纯合子的耐干旱能力进行研究,通过观察转基因烟草幼苗生长发育,测定保水力、丙二醛和叶绿素含量、相对电导率等与胁迫相关的生理指标,以检测2个剪接体基因在烟草中的过表达能否增强转基因植株对干旱胁迫的耐受能力。【拟解决的关键问题】以期深入了解金发草LEA3基因的抗旱能力及导致基因剪接体功能变化的原因,为进一步研究金发草LEA3基因异构体的剪接异构的生物学意义和金发草抗旱机理奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 植物材料与基因 烟草品种为本生烟(Nicotianabenthamiana),金发草LEA3基因2个剪接体由四川大学生物资源与生态环境教育部重点实验室克隆保存。
1.1.2 菌株、载体与试剂 大肠杆菌(Escherichiacoli)Top10、农杆菌LBA4404、植物表达载体pBI121由四川大学生物资源与生态环境教育部重点实验室保存。植物基因组DNA提取试剂盒、植物总RNA提取试剂盒购物天根生物科技公司。rTaq酶、反转录酶M-MLV以及DNA限制酶购于TaKaRa 。PCR引物(表1)合成和基因测序均由北京六合华大基因有限公司完成。其它试剂均为国产分析纯。
1.2 实验方法
1.2.1 植物表达载体pBI121-LEA3.a和pBI121-LEA3.b的构建及烟草的遗传转化 本研究采用pBI121载体进行转化烟草实验。利用引物L121-F和L121-R分别扩增四川大学生物资源与生态环境教育部重点实验室构建并保存的2个剪接体的重组质粒pMD19-T-PpLEA3.a和pMD19-T-PpLEA3.b,用XbaI和SmaI酶切PCR产物和pBI121质粒,胶回收后,用T4连接酶在16 ℃连接过夜,将连接产物转入E.coliTOP10,从而得到pBI121-PpLEA3.a和pBI121-PpLEA3.b植物表达载体,利用双酶切和PCR验证是否将目的基因插入到植物表达载体pBI121,最后测序验证重组质粒的正确性。将鉴定完全正确的重组Top10扩大培养提取质粒转化农杆菌,使用农杆菌介导叶盘法[9]进行烟草的遗传转化,经组织培养技术获得转基因烟草。T0代种子经消毒处理后用卡那霉素培养基进行抗性筛选,得到转基因T1后代株系。
1.2.2 转基因烟草的分子鉴定 提取T1代转基因烟草基因组DNA,用引物L121-F和L121-R进行PCR检测该基因是否整合到烟草基因组中。分别提取野生型烟草和T1代转基因烟草的总RNA,反转录为cDNA后进行RT-PCR扩增,内参基因为18S。选取筛选鉴定的阳性植株幼苗移栽到营养土中继续生长以收获T2代种子,从中筛选进而获得纯合转基因株系,以此作为后续耐干旱胁迫生理特性研究对象。
表1 引物信息Table 1 Primers used in this study
1.2.3 转基因烟草耐干旱胁迫处理 随机选取PpLEA3基因2个剪接体的T2代转基因3个株系,以种子作为出发材料,待其长至高约0.7 cm时,挑选叶片为绿色、长势一致的幼苗,移栽到含有甘露醇150 mM的MS培养基中进行胁迫处理,同期的野生型烟草幼苗为对照。40 d后调查烟草的高生长、幼苗鲜重情况,并进行各项生理指标测定,每个株系重复3次。
1.2.4 转基因烟草的相关生理指标检测 离体叶片保水率测验参照Klute[10]的方法进行;植物叶片相对电导率和丙二醛(MDA)含量的测定参照《现代植物生理学实验指南》[11]的方法;叶绿素含量采用丙酮提取法[12]测定。
2 结果与分析
2.1 转PpLEA3基因剪接体烟草的获得及分子检测
通过农杆菌介导叶盘法获得转基因烟草50株,其中PpLEA3.a转基因烟草26株,PpLEA3.b转基因烟草24株。对不同T0代株系种子进行卡那霉素抗性筛选,取阳性植株收获T1种子,进一步对其进行抗性筛选,待植株长大后分别提取叶片DNA,以野生型烟草为对照,进行目的基因的基因组整合检测分析(图1)。所选择的克隆株系均扩增出预期大小的特异性条带,而野生型烟草未扩增出相应片段,另外本研究还对这些株系进行了RT-PCR转录水平检测(图2),在烟草内参18S稳定表达的情况下,野生型烟草没有扩增出条带,而选择的克隆株系都扩增出了目标产物。以上结果说明PpLEA3基因的2个剪接体已分别整合入烟草基因组中,并通过稳定遗传在转基因后代中进行有效的转录表达。
2.2 转基因植株的耐干旱性胁迫分析
2.2.1 干旱胁迫对转基因烟草生长状况的影响 将转PpLEA3.a基因烟草株系Ta(Ta-1,Ta-3,Ta-5)、转PpLEA3.b基因烟草株系Tb(Tb-4,Tb-7,Tb-9)和野生型烟草(Wt)的T2代纯系种子分别播种于MS培养基上,28 ℃光照培养箱中生长30 d后(图3A,大约株高0.7 cm),移栽到含有甘露醇150 mM的MS培养基中进行胁迫处理40 d,观察其生长情况。由图3 B可以看出,野生植株相对矮小,叶片萎蔫,生长畸形,而转基因烟草的生长发育虽然也受到明显的抑制,但整体受损情况要好很多。初步确认2个剪接体基因的分别导入增加了转基因烟草的抗旱性。同时对不同株系的平均株高和平均鲜重进行了比较分析,转基因株系在含甘露醇150 mM的MS培养基上的平均株高和平均鲜重都比对照高(图4),且抵抗甘露醇能力大小为Ta>Tb>Wt。说明2个剪接体基因的分别导入改善了烟草在干旱胁迫下的生长状况。
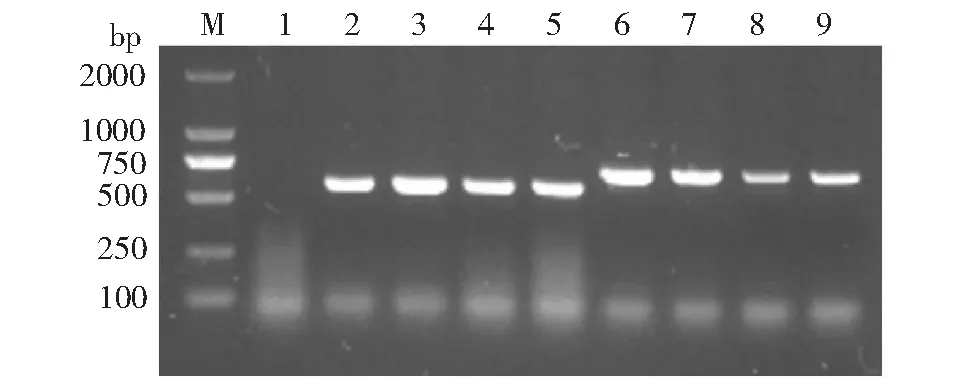
M:DNA 2000 marker;1:Wild type as the negative control;2-5: Transgenic type of PpLEA3.a;6-9: Transgenic type of PpLEA3.b图1 转PpLEA3基因2个剪接体烟草部分株系基因组DNA PCR鉴定Fig.1 DNA PCR detection in different transgenic tobacco lines
2.2.2 干旱胁迫对转基因烟草保水力、丙二醛含量、叶绿素含量和相对电导率的影响 利用甘露醇模拟干旱环境对经过胁迫后的各个烟草株系的叶片保水力进行了测定(图5A),与对照相比,转基因烟草叶片保水能力有着较大的提高,说明转化PpLEA3基因可提高植株的抗旱能力。转PpLEA3.a基因烟草的平均保水率要高于转PpLEA3.b基因烟草,表明2个剪接体对干旱抵抗力的大小为PpLEA3.a>PpLEA3.b。
在干旱等逆境因素作用下,植物细胞膜脂会由于胞内过氧化物的过量产生而导致氧化作用的出现。造成植物细胞膜脂氧化伤害的因子非常多,而丙二醛(MDA)在其中发挥了关键作用,MDA浓度的增加会损害植物细胞膜,并对植物细胞正常功能造成阻碍。研究表明,干旱胁迫可引起植物MDA含量显著提高,因此MDA浓度的多少以及变化幅度可被看作植物抗逆强弱的标准之一[13]。对在同样条件下胁迫生长的转基因株系和野生型对照测定结果显示(图5B),与野生型对照相比,转基因烟草的MDA浓度较低,表明LEA3基因使转基因烟草的抗旱性得到了提高,该基因的大量表达对细胞的膜系统起到了保护作用。很明显,转PpLEA3.a基因烟草的MDA平均浓度低于转PpLEA3.b基因烟草,说明PpLEA3.a比PpLEA3.b表现出较强的耐干旱能力。
植物干物质的积累主要来自叶片的光合作用,叶绿体作为光合作用的细胞器,是影响光合作用的主要因素之一,因此叶绿素含量可以直接反映植物的光合作用,也是衡量植物在干旱胁迫下耐干旱能力的重要生理指标之一[14]。比较转基因烟草和野生型烟草在150 mM甘露醇处理后的叶绿素含量可以发现(图5 C),转基因株系均显著高于野生型株系,转PpLEA3.a基因烟草的总体平均叶绿素含量比转PpLEA3.b基因烟草高27.4 %,表明干旱胁迫对转基因株系叶绿素合成的影响小于野生型株系,进一步说明转PpLEA3基因烟草的耐干旱能力强于野生型对照,并且转PpLEA3.a基因烟草拥有较强的干旱抵抗力。
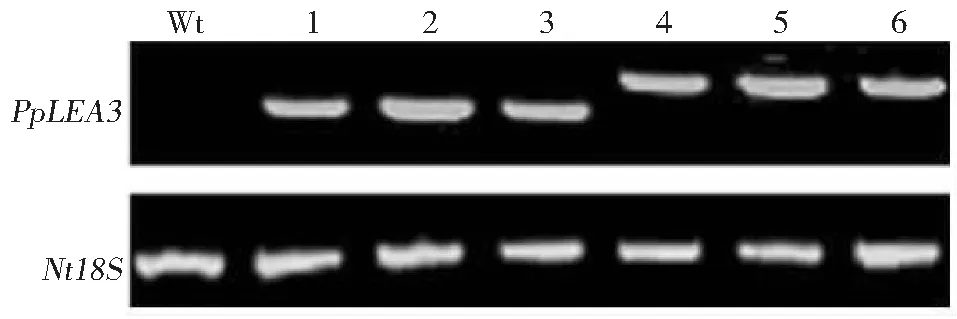
Wt:Wild type;1-3: Transgenic type of PpLEA3.a;4-6: Transgenic type of PpLEA3.b图2 转PpLEA3基因2个剪接体烟草随机株系RT-PCR检测Fig.2 RT- PCR detection in different transgenic tobacco lines

Wt:Wild type;Ta-1, Ta-3, Ta-5:Transgenic type of PpLEA3.a;Tb-4, Tb-7, Ta-9:Transgenic type of PpLEA3.b图3 T2代转基因株系抗干旱表型分析Fig.3 Phenotypes of 30-old seedlings of Wt and transgenic tobacco (A) treated with 150 mM Mannitol on MS medium at 28 ℃ for 40 days (B)
相对电导率是反映植物膜系统受伤害程度的一个重要的理化指标,植物在干旱条件下细胞膜容易破裂,膜蛋白受伤害导致细胞内电解质外渗而使相对电导率增大[15]。因此叶片的相对电导率可以作为衡量植物抗旱性的指标。从图5D可以看出,各转基因株系与野生型对照的相对电导率明显不同,各转基因株系均小于野生型株系,并且转PpLEA3.a基因烟草的相对电导率平均水平比转PpLEA3.b基因烟草低12.9 %。说明将PpLEA3基因导入烟草可在一定程度上维持细胞膜透性的稳定,提高烟草的抗旱能力。
3 讨 论
LEA蛋白是种子发育后期并伴随脱水干燥过程而产生的一类小分子特异多肽,其中的第3组LEA蛋白可以在干旱胁迫条件下得到大量积累从而提高植物的抗旱性[3]。大量实验表明LEA家族蛋白可以不同途径不同机制来发挥抗逆功能[16]。在本研究中,利用转基因的方法将来自金发草的LEA3基因2个剪接体分别转化烟草并获得了转基因植株,对转基因植株的抗旱性能进行分析发现2个剪接体的分别过表达改善了烟草的生长状况,并且各项生理指标都优于野生型对照烟草,表明转金发草LEA3基因2个剪接体可以提高烟草的耐旱能力。结合先前研究发现,金发草LEA3基因2个剪接体在重组的酿酒酵母中都对干旱、盐、冷等非生物胁迫具有一定的耐受能力[8]。因此,鉴于金发草LEA3蛋白存在可变剪接现象,本研究推测,当金发草遭遇干旱逆境时,LEA3蛋白可能通过可变剪接现象进行响应,依靠不同剪接体极强的亲水能力增强金发草对水分胁迫的耐受性,本研究为金发草的抗旱机能研究提供了实验依据。
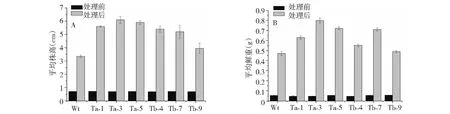
Wt:Wild type;Ta-1, Ta-3, Ta-5:Transgenic type of PpLEA3.a;Tb-4, Tb-7, Ta-9:Transgenic type of PpLEA3.b图4 转基因株系及野生型对照在含150 mM甘露醇的MS培养基上的生长量Fig.4 Growth analysis of transgenic tobacco lines and wild type tobacco
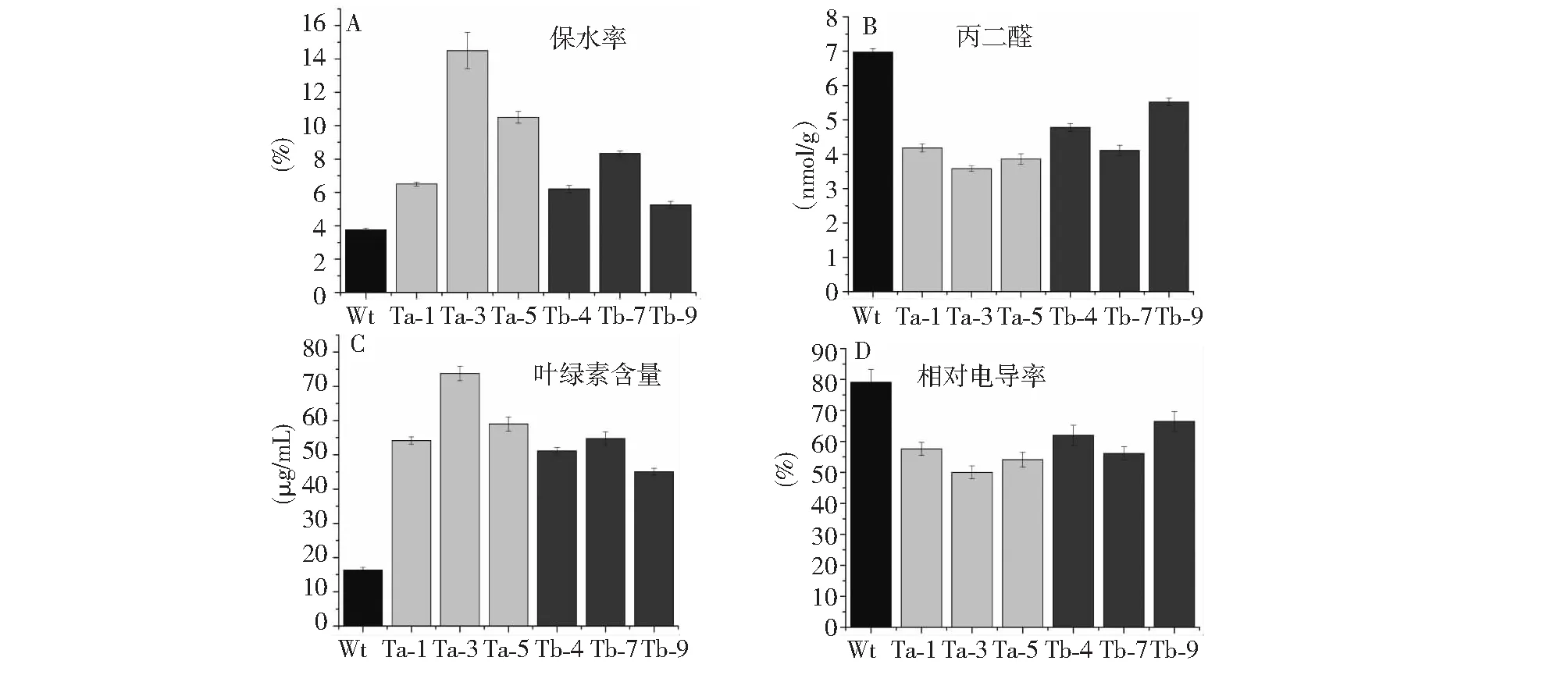
Wt:Wild type;Ta-1, Ta-3, Ta-5:Transgenic type of PpLEA3.a;Tb-4, Tb-7, Ta-9:Transgenic type of PpLEA3.b图5 干旱胁迫对转基因株系和野生型对照的相关生理指标分析 Fig.5 Detection of related physiological index between transgenetic tobacco line and wild type tobacco under drought stress
可变剪接作为真核生物控制基因表达的一种重要的转录后调控机制,可以使一个基因具有多个功能状态[17],就金发草LEA3蛋白而言,通过可变剪接产生的2个蛋白都具有抗旱功能,但抗旱能力存在差异,这可能是由于内含子的保留导致PpLEA3.b较PpLEA3.a相比蛋白的亲水能力降低所致,进一步说明序列的改变可以导致基因结构的改变,最终导致功能上产生一定的差异。已有研究表明,可变剪接的发生受不同的细胞环境如细胞类型、发育阶段和生理状态等调节,在不同的环境下可变剪接方式可能存在不同[18],本团队已经通过实验研究确定了金发草LEA3基因可变剪接的抗旱功能,但其具体的调控机制仍然未知。随着转录组、基因组等高通量实验技术的发展,我们将结合生物信息学及实验研究解析金发草LEA3基因可变剪接的调控机制,进而从分子水平揭示金发草抗旱机理。
4 结 论
本文首先利用转基因法获得了金发草LEA3基因2个剪接体的转基因烟草植株,并通过干旱相关生理指标检测法分析转基因植株的抗旱性能,结果显示2个剪接体基因均从不同程度上提高了烟草的干旱能力,且抗旱能力大小为PpLEA3.a>PpLEA3.b,进一步说明2个剪接体亲水能力和结构上的改变可能导致转基因烟草耐受力的不同。
参考文献:
[1]Tan Y, Peng J H. Research progress on mechanism and identification methods of drought resistance in plants[J]. Guangxi Agricultural Sciences, 2010:423-426.
[2]Ingram J, Bartels D. The molecular basis of dehydration tolerance in plants[J]. Annual Review of Plant Physiology & Plant Molecular Biology, 2003, 47(47):377.
[3]俞嘉宁,山 仑. LEA蛋白与植物的抗旱性[J]. 中国生物工程杂志, 2002, 22(2):10-14.
[4]Iturriaga G, Schneider K, Salamini F, etal. Expression of desiccation-related proteins from the resurrection plant Craterostigma plantagineum in transgenic tobacco[J]. Plant Molecular Biology, 1992, 20(3):555-558.
[5]Gal T, Glazer I, Koltai H. An LEA group 3 family member is involved in survival of C. elegans during exposure to stress[J]. Febs Letters, 2004, 577(1-2):21.
[6]Hu T Z. OsLEA3, a late embryogenesis abundant protein gene from rice, confers tolerance to water deficit and salt stress to transgenic rice[J]. Russian Journal of Plant Physiology, 2008, 55(4):530-537.
[7]中国植物志编辑委员会. 中国植物志.全套[M]. 1990.
[8]李 锐,王文国,范林洪,等. 金发草LEA3基因两个剪接体转化酿酒酵母的抗非生物胁迫功能分析[J]. 中国生物工程杂志, 2012, 32(8):30-35.
[9]Horsch R B. A simple and general method for transferring genes into plants[J]. Science, 1985, 227(4691):1229-1231.
[10]Klute A. Water retention: laboratory methods[J]. Methods of Soil Analysispartphysical & Mineralogical Methods, 1986:635-662.
[11]张志良,翟伟菁. 植物生理学实验指导. 三版[M]. 北京:高等教育出版社, 2003.
[12]杜咏梅,张怀宝,王晓玲,等. 光度法测定烟草中总类胡萝卜素的方法研究[J]. 中国烟草科学, 2003, 24(3):28-29.
[13]康宗利,杨玉红,张立军. 植物响应干旱胁迫的分子机制[J]. 玉米科学, 2006, 14(2):96-100.
[14]汪耀富,蔡寒玉. 烟草抗旱生理生化研究进展[J]. 安徽农业科学, 2005, 33(3):491-493.
[15]Jiao T Q, Sun H, Liu R N. Transformation of Saussurea involucrata SiPIP3 gene into tobacco and evalua tion of transgenic plant stress-resistance[J]. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(3):431-438.
[16]王艳蓉,张治国,吴金霞. LEA蛋白及其在植物抗逆改良中的应用[J]. 生物技术通报, 2015, 31(3):1-9.
[17]Graveley B R. Alternative splicing: increasing diversity in the proteomic world[J]. Trends in Genetics Tig, 2001, 17(2):100.
[18]Blencowe B J. Alternative splicing: new insights from global analyses[J]. Cell, 2006, 126(1):37.
