精神心理障碍及下丘脑-垂体-肾上腺轴对冠心病的影响
2018-06-04苏瑞综述肖践明张敏审校
苏瑞 综述 肖践明 张敏 审校
(昆明医科大学第一附属医院心内科,云南 昆明 650032)
随着社会经济的发展,尤其是人口老龄化及城镇化进程的加速,心血管疾病已经成为人类健康的头号杀手。在中国心血管病死亡率居首位,已高于肿瘤和其他疾病,占居民疾病死亡构成的40%以上[1]。现代医学认为,心脏疾病的发生、发展和转归与精神心理因素密切相关[2]。遗憾的是,精神心理障碍对心血管疾病的作用机制尚不清楚,过去的研究多集中在以下几方面:(1)下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)和交感神经系统功能亢进;(2)血小板受体改变和反应性增加;(3)心率变异性降低;(4)心电图校正的QT间期延长和QT离散度增大;(5)其他,如不良生活方式、抑制免疫功能、影响纤溶系统、诱发胰岛素抵抗等。
HPA链接精神心理障碍与心血管疾病的机制可能是:过分紧张、焦虑、压力、抑郁、恐惧、愤怒等情绪反应作为应激源可致使机体产生应激,进而导致HPA功能亢进,皮质醇长期分泌过度,可能引起高脂血症、高血压、水钠潴留及心肌钾减少、降低心室颤动阈值、增加冠状动脉α-肾上腺素受体对儿茶酚胺的敏感性等,继而导致各种心血管疾病。而最近越来越多的研究在HPA功能失调介导精神心理障碍所致冠心病这一领域进展明显,其作用机制逐渐清晰,现回顾相关文献,将其最新研究进展进行综述。
1 HPA概述
1.1 HPA及其产物
HPA是神经内分泌系统的重要组成部分,主要参与控制应激反应,并调节许多机体活动,是一个协调激素、腺体和部分中脑区域相互作用的枢纽。HPA激活的第一步是从下丘脑内神经元释放促肾上腺皮质激素释放激素(CRH)。然后CRH经垂体门脉血管到垂体前叶腺触发特定受体释放促肾上腺皮质激素(ACTH)。最后ACTH进入全身循环作用于肾上腺皮质,开始促进合成糖皮质激素。HPA对传入刺激的反应又可以被糖皮质激素调节,这些糖皮质激素作用于脑垂体和下丘脑,抑制CRH和ACTH的合成和释放,从而形成负反馈回路。HPA和它的产物糖皮质激素,与免疫系统相互作用,调节与控制应激反应[3]。各种应激源可以刺激淋巴细胞释放多种细胞因子,如肿瘤坏死因子-α(TNF-α)、白介素(IL)-1和IL-6等,这些细胞因子诱导下丘脑和垂体合成及释放CRH和ACTH,从而刺激肾上腺合成和分泌皮质醇。反过来,当皮质醇增多时又可负反馈地抑制细胞因子的合成和分泌。
糖皮质激素是由肾上腺皮质束状带分泌的一类甾体激素,主要为皮质醇,又称氢化可的松。糖皮质激素在体内发挥广泛的作用,在维持体内稳态和保持机体预防、应对和处理身体和情绪的压力中起至关重要的作用[3]。适度的应激是机体对外界防御相关过程所必需的,但当应激过度而导致组织损伤和炎症反应威胁到人体时,皮质醇的多重负反馈作用特性将起到保护作用。皮质醇的另一个特性是在健康成年人中显示出一种强烈的昼夜节律,在清晨6~8点的时候,肾上腺皮质的分泌活动最为强烈。觉醒后不久,皮质醇水平为峰值,随后稳步下降。皮质醇分泌的最低点在凌晨0~2点,此时只能检测出最低限度的皮质醇水平。皮质醇分泌速率的昼夜节律可以解释疾病相关免疫反应的日周变化,比如对糖皮质激素特别敏感的迟发性超敏反应,在晚上皮质醇分泌最低的时候其超敏反应最明显,在早上分泌高峰时最不明显[4]。
1.2 HPA的检测
HPA是一个复杂的调节系统,其功能的检测存在一定困难,易受环境的影响和干扰,如静脉穿刺等很小的应激也会影响其检测。HPA的活动通常是通过测量不同的刺激程序,如CRH试验、体力劳动或心理应激,所引起体内皮质醇水平的变化情况来评估[5]。在24 h尿样中对游离皮质醇的测量是一种综合测量全天游离皮质醇浓度的方法。此方法虽然可以反映血循环中游离皮质醇水平,但难以反映皮质醇的昼夜节律性分泌和脉冲分泌,并且由于24 h尿液收集的误差较大,所以容易存在偏倚[6]。而在血液中进行游离皮质醇的测量,可以很好地解决上述问题;但血浆总皮质醇测定受血浆皮质醇结合球蛋白水平的影响,且抽血穿刺也易引起应激,临床应用有一定限制。
研究表明,皮质醇从血液到唾液的转移速度很快,当血液中的皮质醇升高,5 min内唾液中皮质醇就会达到相应的平衡状态[7]。唾液中游离皮质醇能显示出与血液皮质醇相同的昼夜节律,且晨间高峰与午夜低谷间的差值比血浆皮质醇更明显。由于唾液皮质醇测定的几个优点,如能很好地反映皮质醇血浆游离的浓度及分泌的昼夜节律,不受皮质醇结合球蛋白的影响,无取血应激及尿收集不便和误差等缺点,是一项灵敏可靠、简便易行的反映肾上腺皮质分泌功能的指标,已经广泛应用于相关研究;但针对慢性心理应激,如慢性压力的研究,从唾液、尿液、血液中提取并检测皮质醇的方法就难以实现。然而最近研究者发现,大多数人的头发记录着近几个月的皮质醇变化情况,头发每月生长约 1 cm,因此通过检测头发中的皮质醇水平,可较为准确地获知被检测者当时和此前较长时间内的心理压力状况。所以相对前三种介质,头发皮质醇的测量凭借此优势而成为慢性压力研究的首选[8-9]。
2 精神心理障碍与HPA的关系
情绪异常与精神心理障碍导致神经-内分泌系统的紊乱,继而造成自主神经系统以及HPA系统的异常,这是精神心理障碍所致的各种心血管疾病的始动环节。多种情绪反应作为应激源可以导致机体的应激反应,在这些应激因素下造成HPA功能亢进。HPA功能亢进,是以CRH和ACTH以及皮质醇分泌增多为主要表现。皮质醇的持续升高又可破坏海马神经元。海马是HPA应激反应的高位调节中枢,是HPA的负反馈中枢,对HPA的活动有抑制影响。海马神经元凋亡、萎缩及神经再生减少等一系列损伤,又减弱中枢对HPA的抑制作用,从而使皮质醇分泌继续增加,形成恶性循环。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)分布在中枢及周围神经系统、内分泌系统、骨和软骨组织等区域内,也少量表达于心肌,主要是在中枢神经系统内表达,其中海马和皮质的含量最高,是体内含量最多的神经营养因子。海马功能与BDNF和皮质醇密切相关。当精神心理障碍和应激损害发生时,皮质醇增加,可减弱BDNF表达,导致海马损害。如抑郁症患者血清中BDNF含量明显降低,而使用抗抑郁药物后BDNF含量则升高[10]。研究发现BDNF还与血管内皮细胞存活、增殖、移行密切相关,并在动脉粥样硬化、缺血性心肌病等疾病中表达。BDNF表达缺陷会使血管内皮细胞间信号传导异常和心肌血管内皮细胞凋亡[11]。综上所述,当皮质醇分泌增加,可导致BDNF表达减少,继而损害海马,并加速动脉粥样硬化患者的病情进展。
3 HPA与冠心病
3.1 HPA与冠心病的关系
最新研究证据表明HPA失调介导了精神心理障碍导致的冠心病。HPA的失调表现为,皮质醇释放量的增加和HPA对压力反应的减弱。后者的特征是昼夜皮质醇变化率的降低,即一天中呈现出较平坦的昼夜坡度,其结果可能是由于长期的HPA过度刺激导致的[12-14]。Nijm等[15]在比较冠心病患者皮质醇分泌昼夜变化的研究中,采用连续3个工作日分别在醒后30 min和睡觉前测量唾液中的皮质醇。早晨患者的皮质醇水平和对照组之间没有差别,而夜晚的皮质醇水平明显增高,这表明在冠心病患者一天中皮质醇分泌曲线较平。当冠心病患者暴露于急性物理应力,如活动平板训练,其皮质醇反应显著低于同年龄和性别匹配的对照组。同样,在标准化的实验室压力测试的皮质醇反应,冠心病患者也显著低于对照组。即使在调整可能的混杂因素,如吸烟和β受体阻滞剂或他汀类药物治疗后,患者和对照组之间的差异仍然很显著[16]。综上可知冠心病患者HPA反应相对迟钝。这种皮质醇昼夜节律的减低此前已被提议为衡量疾病进展的标志物。如在癌症患者中,如转移性乳腺癌患者的昼夜皮质醇节律趋于扁平化,死亡率提前[17]。同样的,在一个横断面研究中指出,病理状态的HPA与心血管疾病风险因素和预后紧密相关,其特征是昼夜皮质醇变化率降低[18]。而最近Ronaldson等[19]的研究也发现,冠心病患者在冠状动脉旁路移植术后的数年内,使用每日皮质醇曲线预测手术后死亡率,斜率更平坦的患者不良后果的风险也就越高。
一项前瞻性队列研究显示,在清晨血液样本中,皮质醇/睾酮比例增加,冠心病死亡率和发病率也增加[20]。在一项横断面研究中,从中年人中收集了从觉醒到就寝的6个唾液皮质醇样本,结果显示皮质醇水平越高,冠状动脉钙化的可能性就越大[13]。此外,Rosmond等[14]发现,与正常的激素水平相比,皮质醇水平升高的男性,5年心血管事件发病率显著上升。而且最近一项研究,测定了24 h尿液收集的总皮质醇输出量,发现分别与同年龄和性别的健康受试者相比,稳定性冠心病患者的总皮质醇输出量显著增加[15]。然而,在皮质醇浓度和冠心病的病程进展的严重程度方面,部分数据也并不一致。通过血管造影的评估,早晨的血浆皮质醇浓度和冠心病的严重程度之间的正相关关系已经得到证实[21],但并没有研究发现清晨皮质醇与冠状动脉病变支数的关系。
3.2 HPA与冠心病的机制
目前认为动脉粥样硬化是由一系列细胞及分子参与的慢性炎症性血管反应性疾病。精神心理障碍促进动脉粥样硬化发生发展的可能机制见图1,可见HPA在其中起到了重要的链接作用,以下将目前主要考虑的三方面机制进行简要阐述。
3.2.1 HPA抗炎症活动减弱
反应迟钝的HPA不能抑制炎症活动。在慢性压力下,心脑血管系统是儿茶酚胺的直接目标,促使机体启动一些促炎分子级联反应,如在体循环的单核细胞中,激活核因子κB,进而激活一些促炎细胞因子,如TNF-α、IL-1和IL-6等。这些炎症相关因子能在下丘脑、垂体和肾上腺皮质三个水平上直接激活皮质醇的分泌。皮质醇反过来又可以抑制TNF-α、IL-1和IL-6的产生。这种HPA与免疫系统之间的相互作用是一种负反馈的保护机制。然而,HPA或糖皮质激素水平的任何紊乱都可能导致系统的不平衡和对感染、炎症、自身免疫性疾病的易感性增强。由于过于扁平的皮质醇昼夜节律与免疫系统对皮质醇介导信号的反应减弱,换言之,由于皮质醇抑制炎症控制途径的能力减弱,导致炎症生物标志物的浓度增加。如在冠心病患者中,发现血清IL-6和C反应蛋白(CRP)与夜间唾液皮质醇浓度密切相关,而与早晨唾液皮质醇浓度或24 h尿皮质醇总量无关。此外,基质金属蛋白酶-9,一种在炎症反应中发挥重要作用的基质金属蛋白酶类,它的水平与晚上皮质醇水平显著相关[15,22]。这些发现均提示冠心病患者的低度全身炎症与平坦的每日皮质醇分泌斜率有关。同样,钝性HPA与自身免疫性和炎症性疾病易感性的关系已经在许多动物模型中得到了明确的证实:例如比较两个高度自交系大鼠系,Fischer大鼠和Lewis大鼠,Lewis大鼠表现出迟钝的HPA反应,Fischer大鼠HPA反应则较敏感。Lewis大鼠对多种自身免疫或炎症性疾病高度敏感,而Fischer大鼠对这些疾病有抵抗力。接受低剂量地塞米松或从Fischer大鼠侧脑室移植下丘脑组织的Lewis大鼠,则对炎症性疾病的抵抗力增强[23]。
3.2.2 糖皮质激素抵抗
糖皮质激素抵抗[24],糖皮质激素主要通过细胞膜进入细胞质,与胞质中的糖皮质激素受体结合,通过增加或减少基因转录从而发挥相应作用。不同的个体对激素的反应状况有差异,部分个体对糖皮质激素反应性明显降低或者无反应,称为糖皮质激素抵抗。细胞因子如TNF-α、IL-1和IL-6等的升高会进一步干扰负反馈机制,从而增加下丘脑和垂体中糖皮质激素受体的抵抗性。此时虽然糖皮质激素水平很高,但不能与受体结合发挥相应的作用,导致HPA进一步被刺激,产生更多的糖皮质激素。糖皮质激素抵抗不仅使外源性糖皮质激素治疗不能达到预期的效果,也会使患者的内源性糖皮质激素不能完全发挥其相应的作用,这也成为冠状动脉疾病发生发展的一个重要诱因。
3.2.3 血管内皮损伤
实验发现[25],慢性应激会导致HPA激活,皮质醇分泌过量,以及血管内皮的损伤。Rogers等[26]在牛冠状动脉内皮培养细胞中加入皮质醇,发现皮质醇可以通过激活糖皮质激素受体,减少一氧化氮合酶的生成和降低细胞内Ca2+的流动,从而抑制NO的生成,使血管内皮细胞受损。在抑郁症患者中,观察到IL-1、IL-6和其他细胞因子血浆水平的升高,也可加重内皮细胞的损伤。此外,这些细胞因子也可激活CRP及细胞黏附分子等合成。CRP可以促进血管内皮炎症活动,上调细胞黏附分子的表达,促进巨噬细胞对低密度脂蛋白的摄取,然后变为泡沫细胞。此外,受损内皮细胞,进一步促进血小板的黏附,诱导白细胞在内皮细胞受损处的聚集,促进纤维原细胞、血管平滑肌细胞在内皮细胞受损处分裂增殖,加重内皮细胞受损。通过这些恶性循环过程的不断作用,促使动脉粥样硬化的发展。
除此之外,HPA的失调也与冠心病各种相关风险因素有关,如腹部肥胖、高胆固醇血症、高三酰甘油血症、高血压、葡萄糖耐受不良等,而这些属于冠心病的传统危险因素,与以上新发现的机制共同参与影响冠心病的发生发展。
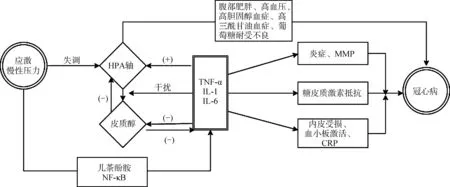
注:NF-κB:核因子κB;MMP:基质金属蛋白酶。
4 结语与展望
综上所述,HPA功能失调可能是精神心理障碍与冠心病之间的纽带。精神心理障碍导致HPA功能失调,包括皮质醇增多,以及平坦的昼夜节律。而HPA功能失调引起冠心病的病理生理机制,考虑为功能不良的HPA未能抑制应激诱导的炎症活动、糖皮质激素抵抗,以及皮质醇导致血管内皮损伤等多种因素共同作用。在应激刺激下,炎症细胞因子如TNF-α、IL-1和IL-6等的升高,伴随着CRP、基质金属蛋白酶-9等标志物的显著增加共同推进动脉粥样硬化的进展;但是HPA功能失调是否只是积极参与冠心病的发病机制,还是由于长期炎症过程,引起它们互为因果,目前尚待研究。而且,HPA在动脉粥样硬化中的作用机制也必须要在大量动物模型中才能得到证实。相信随着研究的不断深入,以及“心身医学”的蓬勃发展,对于这种“心身疾病”将会有更全面的了解,为未来在临床工作中应对这类多学科交叉疾病,提供新的思路。
[ 参 考 文 献 ]
[1] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告2016》概要[J].中国循环杂志,2018,33(1):1-8.
[2] Pogosova N,Kotseva K,de Bacquer D,et al.Psychosocial risk factors in relation to other cardiovascular risk factors in coronary heart disease:results from the EUROASPIRE Ⅳ survey.A registry from the European Society of Cardiology[J].Eur J Prev Cardiol,2017,24(13):1371-1380.
[3] Nicolaides NC,Charmandari E,Kino T,et al.Stress-related and circadian secretion and target tissue actions of glucocorticoids:impact on health[J].Front Endocrinol(Lausanne),2017,8(70):1664-2392.
[4] Geiger SS,Fagundes CT,Siegel RM.Chrono-immunology:progress and challenges in understanding links between the circadian and immune systems[J].Immunology,2015,146(3):349-358.
[5] Allen AP,Kennedy PJ,Cryan JF,et al.Biological and psychological markers of stress in humans:focus on the Trier Social Stress Test[J].Neurosci Biobehav Rev,2014,38(1):94-124.
[6] El-Farhan N,Rees DA,Evans C.Measuring cortisol in serum,urine and saliva—are our assays good enough?[J].Ann Clin Biochem,2017,54(3):308-322.
[7] Mezzullo M,Fanelli F,Fazzini A,et al.Validation of an LC-MS/MS salivary assay for glucocorticoid status assessment:evaluation of the diurnal fluctuation of cortisol and cortisone and of their association within and between serum and saliva[J].J Steroid Biochem Mol Biol,2016,163(1):103-112.
[8] Russell E,Koren G,Rieder M,et al.Hair cortisol as a biological marker of chronic stress:current status,future directions and unanswered questions[J].Psychoneuroendocrinology,2012,37(5):589-601.
[9] Janssens H,Clays E,Fiers T,et al.Hair cortisol in relation to job stress and depressive symptoms[J].Occup Med(Lond),2017,67(2):114-120.
[10] Munno D,Sterpone S,Fania S,et al.Plasma brain derived neurotrophic factor levels and neuropsychological aspects of depressed patients treated with paroxetine[J].Panminerva Med,2013,55(4):377-384.
[11] Macedo IC,Rozisky JR,Oliveira C,et al.Chronic stress associated with hypercaloric diet changes the hippocampal BDNF levels in male Wistar rats[J].Neuropeptides,2015,51(1):75-81.
[12] Tang AR,Rabi DM,Lavoie KL,et al.Prolonged hypothalamic-pituitary-adrenal axis activation after acute coronary syndrome in the GENESIS-PRAXY cohort[J].Eur J Prev Cardiol,2017,25(1):65-72.
[13] Matthews K,Schwartz J,Cohen S,et al.Diurnal cortisol decline is related to coronary calcification:CARDIA study[J].Psychosom Med,2006,68(5):657-661.
[14] Rosmond R,Wallerius S,Wanger P,et al.A 5-year follow-up study of disease incidence in men with an abnormal hormone pattern[J].J Intern Med,2003,254(4):386-390.
[15] Nijm J,Kristenson M,Olsson AG,et al.Impaired cortisol response to acute stressors in patients with coronary disease.Implications for inflammatory activity[J].J Intern Med,2007,262(3):375-384.
[16] Nijm J,Jonasson L.Inflammation and cortisol response in coronary artery disease[J].Ann Med,2009,41(3):224-233.
[17] Wan C,Couture-Lalande ME,Lebel S,et al.The role of stressful life events on the cortisol reactivity patterns of breast cancer survivors[J].Psychol Health,2017,32(12):1485-1501.
[18] Rosmond R,Bjorntorp P.The hypothalamic-pituitary-adrenal axis activity as a predictor of cardiovascular disease,type 2 diabetes and stroke[J].J Intern Med,2000,247(2):188-197.
[19] Ronaldson A,Kidd T,Poole L,et al.Diurnal cortisol rhythm is associated with adverse cardiac events and mortality in coronary artery bypass patients[J].J Clin Endocrinol Metab,2015,100(10):3676-3682.
[20] Smith GD,Ben-Shlomo Y,Beswick A,et al.Cortisol,testosterone,and coronary heart disease:prospective evidence from the Caerphilly study[J].Circulation,2005,112(3):332-340.
[21] Alevizaki M,Cimponeriu A,Lekakis J,et al.High anticipatory stress plasma cortisol levels and sensitivity to glucocorticoids predict severity of coronary artery disease in subjects undergoing coronary angiography[J].Metabolism,2007,56(2):222-226.
[22] Lundberg AK,Jonsson S,Stenmark J,et al.Stress-induced release of matrix metalloproteinase-9 in patients with coronary artery disease:the possible influence of cortisol[J].Psychoneuroendocrinology,2016,73(1):117-124.
[23] Karalis K,Crofford L,Wilder RL,et al.Glucocorticoid and/or glucocorticoid antagonist effects in inflammatory disease-susceptible Lewis rats and inflammatory disease-resistant Fischer rats[J].Endocrinology,1995,136(7):3107-3112.
[24] Pariante CM.Why are depressed patients inflamed? A reflection on 20 years of research on depression,glucocorticoid resistance and inflammation[J].Eur Neuropsychopharmacol,2017,27(6):554-559.
[25] Aschbacher K,Derakhshandeh R,Flores AJ,et al.Circulating angiogenic cell function is inhibited by cortisol in vitro and associated with psychological stress and cortisol in vivo[J].Psychoneuroendocrinology,2016,67(1):216-223.
[26] Rogers KM,Bonar CA,Estrella JL,et al.Inhibitory effect of glucocorticoid on coronary artery endothelial function[J].Am J Physiol Heart Circ Physiol,2002,283(5):H1922-H1928.
