原发性二尖瓣反流外科术后的左室功能障碍
2018-06-04温美琴综述张庆陈晓婧审校
温美琴 综述 张庆, 陈晓婧 审校
(1.四川大学临床医学院研究生院,四川 成都 610041; 2.四川大学华西医院心内科,四川 成都 610041)
二尖瓣反流(mitral regurgitation,MR)是最常见的心脏瓣膜病之一[1],可分为原发性和继发性,原发性MR是由二尖瓣复合体病变所导致,病因包括二尖瓣脱垂(瓣膜退行性变、黏液样变性)、风湿性心脏病、感染性心内膜炎等。目前认为对原发性MR进行早期有效的手术干预(二尖瓣成形术或二尖瓣置换术)可改善其远期预后。2014年ACC/AHA《瓣膜病管理指南》第一次推荐原发性MR出现左室收缩功能下降[左室射血分数(LVEF)<60%]或左室扩张[左室收缩末期内径(left ventricular end-systolic diameter,LVESD)>40 mm]即应进行手术治疗(Ⅰb类),2017年该指南更新中也延用此推荐[2-3]。
然而,即便是在早期干预的情况下,原发性MR术后早期及长期的随访中仍可出现左室功能障碍(LVEF<50%),并可伴随有临床心力衰竭的症状和体征。现主要分析原发性MR外科手术后左室功能障碍的发生率及其预测因素。
1 术后左室功能障碍的发生率
1994年,Enriquez-Sarano等[4]发现原发性MR术后左室功能障碍的发生率为32%,其中38%的患者行换瓣术,另外62%为二尖瓣成形术。原发性MR患者行二尖瓣成形术后早期(术后3~7 d)左室功能障碍(LVEF<50%)的发生率为18.4%~38.3%[5-11],经1~3年的随访后,其发生率降至10%~12%[12-14]。上述发生率的得出大多基于对术前左室功能保留(LVEF≥50%)患者的研究,并且术前LVEF≥60%的患者占总人数的70%~80%。Tribouilloy等[15]对335例原发性MR患者的研究表明,在术前LVEF≥64%且LVESD<37 mm的患者中,术后左室功能障碍的发生率为9%,术前LVEF<64%或LVESD≥37 mm的患者术后左室功能障碍发生率为21%,而在LVEF<64%且LVESD≥37 mm的患者中,术后左室功能障碍的发生率为33%,这说明术后左室功能障碍的发生与患者术前左室功能密切相关。由此看来,前期报道的MR患者术后左室功能障碍远期发生率(10%~12%)低估了各阶段原发性MR术后左室功能障碍的发生率,尤其是术前即出现左室功能障碍的人群。1995年,Enriquez-Sarano等[16]对于原发性及缺血性MR的研究发现术后充血性心力衰竭的发生率在术后5年、10年、14年分别为(23±2)%、(33±3)%、(37±3)%,其中2/3心力衰竭发生原因是术后的左室功能障碍,该发生率较高的原因可能与当时技术的相对落后、手术时机的滞后及纳入了缺血性MR人群等有关。另外在术前尚未达到手术指征的患者中,仍有11.6%的患者在二尖瓣成形术后早期亦发生了左室功能障碍[7]。
目前超声心动图测得的术前LVEF大多未排除收缩期流向阻力较低的左房反流束的影响,且由于前负荷的增加,使得LVEF的测量值高于实际的左室收缩功能。故目前认为术后早期LVEF降低可归因于以下两方面:LVEF的轻度降低(5%~10%)可以解释为术后反流束的基本消失及前负荷的降低而导致;但降低过多的EF则与长期慢性反流所致的心肌纤维化、肥厚及心室重构等有关[17-18]。
一项纳入1 705例重度退行性MR患者的研究表明,患者的LVEF在术后长期随访中会升高,但不能完全恢复到术前水平。在术后早期出现EF<50%的患者中仅有1/3在长期随访中LVEF可恢复到正常水平(LVEF>60%),而在术后早期无左室功能障碍的患者中2/3可恢复到该水平。并且,多因素数据分析表明术后早期LVEF<40%的患者术后远期死亡率较术后LVEF≥40%的患者增加70%(HR1.7,95%CI1.03~2.92,P=0.037)[7]。因此,术后早期左室功能障碍的发生,尤其是术后早期LVEF<40%,可能是此类患者远期不良预后的危险因素之一。
2 术后左室功能障碍的预测因素
原发性MR手术治疗后出现左室功能障碍的预测因素有:(1)MR程度;(2)因容量负荷增加导致的左心长大;(3)反映心脏收缩或舒张功能的指标,包括LVEF、收缩功能储备、应变、Tei指数、左室射血指数(left ventricular ejection index,LVEI)等;(4)心房颤动及肺动脉高压等并发症;(5)手术方式。
2.1 MR程度
评估MR程度的指标主要有:MR容积、反流分数及有效反流口面积(ERO)等,常用定量多普勒、近端等速表面积法等定量方法测得[19]。Yamano等[5]对174例单纯原发性MR患者的研究发现术前的MR容积是术后早期发生左室功能障碍(术后4 d内)的独立预测因素,在69例尚未达到手术指征的患者中,MR容积是唯一的独立预测因素。反流容积≥80 mL时术后发生左室功能障碍风险将增加,若反流容积达到80 mL,在技术成熟的心脏中心尽早行手术治疗被认为是有益的,其灵敏度和特异度分别为86%(95%CI67%~100%)、89%(95%CI81%~97%)。二尖瓣反流分数在术后有无左室功能障碍的两组患者中也有统计学差异,ROC曲线分析得出二尖瓣反流分数的曲线下面积(area under curve,AUC)为0.80(95%CI73%~87%);但该研究仅仅是一个回顾性分析,因此仅以该研究来证明MR容积对术后左室功能障碍的预测价值仍有一定局限性。而另一个研究中单因素分析得出较大的ERO患者术后早期发生左室功能障碍的风险是较小的ERO患者的3.52倍(OR3.52,95%CI2.15~5.76,P<0.011)[7],但多因素分析未表明其预测价值。
2.2 左室大小
左室大小,尤其是LVESD可较好地反映MR患者的左室内径,该指标也是预测MR患者远期生存率的重要因素。现有研究表明,MR患者左室大小与术后左室功能障碍的发生密切相关[7,9,12-13]。其中,Quintana等[7]的多因素Logistic回归分析表明术前LVESD增大是术后左室功能障碍的独立预测因素。Magne等[6]将单位体表面积的左室舒张末期容积指数纳入了研究,且发现其与术后的LVEF相关(r=-0.27,P<0.000 1),相关性较低但较LVESD高(r=-0.25,P<0.000 1)。尽管LVESD对术后左室功能障碍预测价值已被证实;但目前尚无统一界值可预测术后左室功能障碍的发生。Kitai等[13]的一项回顾性研究表明术前LVESD≥39 mm是预测二尖瓣修补术后远期左室功能障碍(3年)的最佳界值(AUC 0.724,P<0.001)。而Quintana等[7]的研究则表明,重度退行性MR患者若术前LVESD>36 mm,则术后早期LVEF<40%的风险增加6.5倍,并且这与术后远期生存率密切相关。另外,亦有研究发现左室收缩末期容积(left ventricular end-systolic volume,LVESV)及左房内径也是术后左室功能障碍的独立预测因素[9]。
由此看来,因长期容量负荷增加所致的左室扩张,尤其是LVESD/LVESV是MR患者术后是否发生左室功能障碍的重要预测因素。目前最新的ACC/AHA指南推荐在LVESD≥40 mm时应行手术治疗;但是否应以更小的LVESD作为手术指征尚需进一步的研究证实。
2.3 术前左室收缩或舒张功能障碍
目前常用LVEF来评估左室收缩功能,但在MR患者中,大多正常的LVEF可能掩盖已受损的左室功能。因此,目前很多研究对准确评估原发性MR术前的左室收缩及舒张功能进行了探索,并发现了以下可较真实地反映左室收缩或舒张功能的指标:包括术前收缩功能储备、应变/应变率、舒张早期二尖瓣环运动速度(early diastolic mitral annular velocity,E’)、Tei指数、LVEI等新指标。
2.3.1 术前LVEF
前面已经提到原发性重度MR患者LVEF会高估实际的左室功能,因此看似正常的LVEF可能掩盖了已下降的左室功能。
在20世纪末Enriquez-Sarano等[16]发现LVEF是术后充血性心力衰竭发生的预测因素;2003年,Matsumura等[14]发现,退行性MR患者行二尖瓣修补术后,左室功能障碍的发生与术前的LVEF及LVESD独立相关,并表明 左室功能障碍的发生率在术前LVEF<55%的患者中为38%,而总体的左室功能障碍的发生率为12%;但近年来,仅有为数不多的研究表明术前LVEF与术后左室功能障碍的发生有关。Kitai等[13]的研究经多因素回归分析发现LVEF是术前LVEF≤63%或LVESD≥39 mm的MR患者术后远期左室功能障碍发生的独立预测因子,并且ROC曲线分析表明术前LVEF≤63%是预测术后远期(3年)左室功能障碍的界值之一(AUC 0.725,P<0.001)。Quintana等[7]研究发现术前LVEF>60%的患者中术后仍有18.4%在术后早期出现了左室功能障碍。早期及近期研究的结果差异可能与基线LVEF水平的不一致有关。在MR患者中,LVEF将高估左室的收缩功能,因此术前即出现LVEF下降时表明其左室收缩功能受损已非常明显,故LVEF对术后出现左室功能障碍的预测价值大;而在LVEF保留的人群中,正常的LVEF可能掩盖已受损的左室收缩功能,因此对术后左室功能障碍的预测价值较低。所以在MR患者中,对左室收缩功能的评价应以较高的LVEF作为界值,目前指南以60%作为评估MR患者是否需手术治疗的指征。
2.3.2 术前左室收缩功能储备
左室的收缩功能储备可揭示隐匿性左室功能障碍[20-22]。Lee等[20]的队列研究对71例中重度MR患者进行了术前静息及负荷状态下的超声心动图,并且在术后进行了(3±1)年的随访。其中收缩功能储备被定义为达到最大活动耐量时LVEF较静息时的变化,运动后LVEF比静息时升高4%或以上即考虑为收缩功能储备保留。该研究发现收缩功能储备是随访期间LVEF及左室功能障碍的独立预测因素。在另一个研究中,Lancellotti等[21]发现左室整体轴向应变(global longitudinal strain,GLS)的变化幅度是术后左室功能障碍发生的独立预测因素并有较高的预测价值,运动诱导的GLS增加<1.9%对预测术后左室功能障碍的灵敏度及特异度分别为92.3%及70.6%。这表明左室收缩储备功能可较真实地反映左室的收缩功能,破除LVEF正常的假象。
2.3.3 术前左室斑点追踪应变分析
心脏斑点追踪技术应变分析是近年来发展的新技术,它根据心动周期中心肌的形变能力以评估整体或局部心肌的收缩及舒张功能。目前应变已应用于多种心脏疾病患者心肌舒缩功能的评估中,且其准确性已被证实[23]。
Witkowski等[12]采用心脏斑点追踪技术对MR患者术前的GLS进行了分析,并探究GLS与术后左室功能障碍的关系。其中,单因素分析表明GLS与左室功能障碍的相关性最高(r=0.583,P<0.001),且在多元回归分析中,纳入术前的LVEF、LVESD、心房颤动及GLS的模型对术后左室功能障碍有很高的预测价值。GLS的ROC曲线下面积为0.88(95%CI0.83~0.93),其最佳界值为>-19.9%时,其灵敏度和特异度分别达到了90%和79%。而另一项研究表明,术前室间隔局部的轴向应变及应变率是术后LVEF下降超过10%的独立预测因子,其预测价值高于左室容积、LVEF及左室内压力变化率(dp/dt)[24]。
在上一部分提到的一个研究中,Lancellotti等[21]对71例退行性变性MR患者(LVEF>60%,LVESD≤45 mm)术前的静息及负荷超声心动图进行了分析。在随访中进行了手术干预的30例患者中,术前静息时及最大运动耐量所测得的GLS是术后左室功能障碍的独立预测因子,而运动导致GLS的变化幅度的预测价值则更高。该研究表明了术前静息状态下的GLS、运动后GLS及术前左室收缩功能储备的降低是左室功能障碍的预测因素,但该研究结果基于较小的样本量,存在一定的选择偏倚。
以上研究均表明原发性MR术前进行心脏斑点追踪技术应变分析可更准确地评估左室收缩功能,有助于最佳手术时机的选择。
2.3.4 术前舒张早期E’
组织多普勒测得的e′可较可靠地反映左室舒张功能,相对E/A,其受心室前负荷的影响较小[25]。而目前认为心脏疾病中心肌舒张功能不全的发生早于收缩功能不全,舒张功能不全出现时心肌已出现一定程度的损伤。
基于上述结论,Suehiro等[8]应用组织多普勒对63例重度MR患者术后左室功能障碍的预测因素进行了分析,结果表明e′与围手术期LVEF的变化相关(P=0.019,r=0.293),但相关性偏低。其ROC曲线下的面积为0.777(95%CI0.644~0.911),最佳界值为6.5 cm/s。在多因素Logistic回归分析中,纳入术前LVEF<65%、LVESD>32 mm、E’<6.5 cm/s后预测左室功能障碍的发生率为88.9%;但尚需大样本高质量的研究来进一步证实该结论的正确与否。
2.3.5 术前的Tei指数
Tei指数也叫做心肌功能指数,在1996年被Tei等提了出来,有简单、无创、可重复性好等优点,并被证实可同时反映心肌的收缩及舒张功能。Tei指数是指左心室等容收缩期及等容舒张期时间之和除以射血时间[Tei 指数=(等容收缩期时间+等容舒张期时间)/射血时间]。如图1所示,射血时间通过左室流出道速度曲线的持续时间(B)测得,而从二尖瓣关闭到下一次开放的时间相当于左室等容收缩时间、等容舒张时间及射血时间之和(A),因此等容收缩时间与等容舒张时间之和等于(A-B)[26]。近年来在MR中已对其展开了研究,其中Al-Mukhaini等表明在中重度MR患者中,术前的Tei指数是发生围手术期死亡及心力衰竭的重要预测因素[26-29]。Nasr等[30]的研究表明在LVEF正常的风湿性MR中心肌功能指数对于揭示无症状的左室功能障碍有重要价值。由于Tei指数对于评价心脏功能的重要价值,且具有揭示隐匿性或早期心肌功能不全的作用,Takasaki等[9]连续纳入了108例LVEF≥50%的慢性MR患者并在术前测得Tei指数。他们发现术前的左房内径、LVESV、LVEDV、LVEF及Tei指数均与术后的LVEF相关,其中Tei指数(r=-0.64,P<0.000 1)及LVESV(r=-0.64,P<0.000 1)相关性最强。经过多因素数据分析得出Tei指数、LVESV及左房内径是术后LVEF的独立预测因子。Tei指数>0.5作为界值时其预测术后左室功能障碍的灵敏度、特异度及准确性分别是89%、85%及86%。
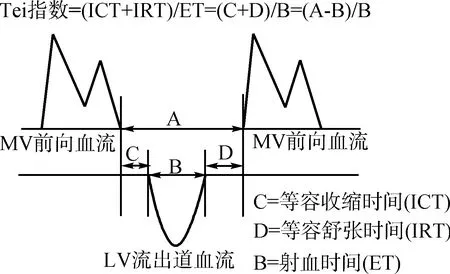
图1 Tei指数及相关多普勒时间间隔示意图
目前Tei指数已经成为一个评价心脏舒缩功能的可靠指标,对评估早期或隐匿性心肌损害有较高的价值,因此运用Tei指数评估原发性MR术前的心脏功能将使得对术前的心脏收缩和舒张功能的评估更准确、简便。
2.3.6 术前的LVEI
2015年,LVEI被Magne等[6]提出,该指标是通过多普勒超声心动图测得,并根据以下公式计算得出:LVEI=LVESD指数/左室流出道时间与速度积分(LVOTtvi),该指标综合了左室前负荷增加所致的左室扩张及左室收缩功能受损两方面内容。他们纳入了1991—2010年的278例原发性MR患者,并通过超声心动图计算出LVEI。该研究经多因素分析发现术前的LVEI及LVESD/LVOTtvi是术后左室功能障碍的独立预测因子。
Delling[31]认为LVEI是一个新颖且易得的指标,综合考虑了左室扩张及左室收缩功能这两方面的内容,目前有初步的回顾性研究证实其对术后左室功能障碍的预测价值;但他还认为LVEI纳入的是LVESD,是一个二维参数,不能准确地反映MR所造成的心脏结构变化,因此有其局限性。若以三维彩色超声心动图下的LVESV指数作为LVEI的左室扩张部分是否有更高的预测价值,尚需进一步研究证实。
2.4 术前的心房颤动及肺动脉高压
心房颤动及肺动脉高压是慢性MR的并发症,反映心脏及肺部血管由MR引起的继发性损害。较多研究已证实心房颤动及肺动脉高压是术后左室功能障碍的独立预测因子[7,11,13,32-33]。Varghese等[11]研究发现术前合并心房颤动或肺动脉高压的患者,围手术期发生左室功能障碍的风险将增加2倍。另外,Quintana等[7]的研究发现,术前的右室收缩压>49 mm Hg(1 mm Hg=0.133 3 kPa),术后LVEF<40%出现的风险增加4.4倍。因此,心房颤动及肺动脉高压对术后左室功能障碍的发生有重要的预测价值。
2.5 手术方式
Enriquez-Sarano等[16]研究发现行二尖瓣成形术后发生心力衰竭的风险较二尖瓣置换术低,其中2/3患者出现心力衰竭的原因是术后左室功能障碍的发生。因为换瓣术将影响二尖瓣复合体的完整性,故术后出现左室功能障碍的概率较成形术高。David等[34]研究发现行MR置换术时保留腱索及乳头肌与传统的二尖瓣置换术相比更有利于术后左室功能的保留,且与二尖瓣成形术相当,但此结论的得出仅基于对17例患者的观察,选择偏倚很大。另外,Imasaka等[35]发现,在二尖瓣成形术治疗二尖瓣后叶脱垂所致的MR患者中,腱索保留者术后早期LVEF的下降幅度较瓣叶切除者小。
2.6 与术后左室功能不全相关性较小的因素
目前研究已证实术前的心功能分级、糖尿病、高血压等合并症、麻醉时间、手术时间、主动脉阻断时间及术后残留的MR均与术后左室功能障碍的发生无确切关系[7,12]。其中心功能分级与术后左室功能障碍相关性较小的原因考虑与近几年所纳入人群的基础心功能较好有关。
综上,原发性MR患者手术(主要为二尖瓣修补术)后左室功能障碍的远期发生率较低,术后早期左室功能障碍的发生率较远期高。其预测因素包括:反流程度、左室大小、心脏收缩或舒张功能、心房颤动及肺动脉高压等并发症、手术方式等。由于前负荷的增加、反流束的存在,术前LVEF将高估左室收缩功能,而左室收缩功能储备、应变、Tei指数、LVEI及E’等指标可更好地反映术前早期隐匿性的心脏功能不全。因此,为原发性MR患者选择合适手术时机时,可应用上述技术或指标准确地评估左室功能,并综合考虑反流程度、左心大小、有无心房颤动肺动脉高压等并发症后做出判断;但上述指标的预测价值尚需高质量的研究证实。
[ 参 考 文 献 ]
[1] Nkomo VT,Gardin JM,Skelton TN,et al.Burden of valvular heart diseases:a population-based study[J].Lancet,2006,368(9540):1005-1011.
[2] Nishimura RA,Otto CM,Bonow RO,et al.2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease:A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines[J].J Am Coll Cardiol,2017,DOI:10.1016/j.jacc.2017.03.011.
[3] Nishimura RA,Otto CM,Bonow RO,et al.2014 AHA/ACC guideline for the management of patients with valvular heart disease:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].J Thorac Cardiovasc Surg,2014,148(1):e1-e132.
[4] Enriquez-Sarano M,Tajik AJ,Schaff HV,et al.Echocardiographic prediction of left ventricular function after correction of mitral regurgitation:results and clinical implications[J].J Am Coll Cardiol,1994,24(6):1536-1543.
[5] Yamano T,Gillinov AM,Wada N,et al.Doppler-derived preoperative mitral regurgitation volume predicts postoperative left ventricular dysfunction after mitral valve repair[J].Am Heart J,2009,157(5):875-882.
[6] Magne J,Szymanski C,Fournier A,et al.Clinical and prognostic impact of a new left ventricular ejection index in primary mitral regurgitation because of mitral valve prolapse[J].Circ Cardiovasc Imaging,2015,8(9):e003036.
[7] Quintana E,Suri RM,Thalji NM,et al.Left ventricular dysfunction after mitral valve repair—the fallacy of “normal”preoperative myocardial function[J].J Thorac Cardiovasc Surg,2014,148(6):2752-2760.
[8] Suehiro K,Tanaka K,Matsuura T,et al.Detection of left ventricular dysfunction using early diastolic mitral annular velocity in patients undergoing mitral valve repair for mitral regurgitation[J].J Cardiothorac Vasc Anesth,2014,28(1):25-30.
[9] Takasaki K,Gillinov AM,Yamano T,et al.Detection of left ventricular dysfunction with Tei index in normal ejection fraction patients with mitral regurgitation before mitral valve surgery[J].Am J Cardiol,2009,103(7):1011-1014.
[10] Arunamata A,Selamet Tierney ES,Tacy TA,et al.Echocardiographic measures associated with early postsurgical myocardial dysfunction in pediatric patients with mitral valve regurgitation[J].J Am Soc Echocardiogr,2015,28(3):284-293.
[11] Varghese R,Itagaki S,Anyanwu AC,et al.Predicting early left ventricular dysfunction after mitral valve reconstruction:the effect of atrial fibrillation and pulmonary hypertension[J].J Thorac Cardiovasc Surg,2014,148(2):422-427.
[12] Witkowski TG,Thomas JD,Debonnaire PJ,et al.Global longitudinal strain predicts left ventricular dysfunction after mitral valve repair[J].Eur Heart J Cardiovasc Imaging,2013,14(1):69-76.
[13] Kitai T,Okada Y,Shomura Y,et al.Timing of valve repair for severe degenerative mitral regurgitation and long-term left ventricular function[J].J Thorac Cardiovasc Surg,2014,148(5):1978-1982.
[14] Matsumura T,Ohtaki E,Tanaka K,et al.Echocardiographic prediction of left ventricular dysfunction after mitral valve repair for mitral regurgitation as an indicator to decide the optimal timing of repair[J].J Am Coll Cardiol,2003,42(3):458-463.
[15] Tribouilloy C,Rusinaru D,Szymanski C,et al.Predicting left ventricular dysfunction after valve repair for mitral regurgitation due to leaflet prolapse:additive value of left ventricular end-systolic dimension to ejection fraction[J].Eur J Echocardiogr,2011,12(9):702-710.
[16] Enriquez-Sarano M,Schaff HV,Orszulak TA,et al.Congestive heart failure after surgical correction of mitral regurgitation.A long-term study[J].Circulation,1995,92(9):2496-2503.
[17] Suri RM,Schaff HV,Dearani JA,et al.Determinants of early decline in ejection fraction after surgical correction of mitral regurgitation[J].J Thorac Cardiovasc Surg,2008,136(2):442-447.
[18] Witkowski TG,Thomas JD,Delgado V,et al.Changes in left ventricular function after mitral valve repair for severe organic mitral regurgitation[J].Ann Thorac Surg,2012,93(3):754-760.
[19] Zoghbi WA,Enriquez-Sarano M,Foster E,et al.Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography[J].J Am Soc Echocardiogr,2003,16(7):777-802.
[20] Lee R,Haluska B,Leung DY,et al.Functional and prognostic implications of left ventricular contractile reserve in patients with asymptomatic severe mitral regurgitation[J].Heart,2005,91(11):1407-1412.
[21] Lancellotti P,Cosyns B,Zacharakis D,et al.Importance of left ventricular longitudinal function and functional reserve in patients with degenerative mitral regurgitation:assessment by two-dimensional speckle tracking[J].J Am Soc Echocardiogr,2008,21(12):1331-1336.
[22] Leung DY,Armstrong G,Griffin BP,et al.Latent left ventricular dysfunction in patients with mitral regurgitation:feasibility of measuring diminished contractile reserve from a simplified model of noninvasively derived left ventricular pressure-volume loops[J].Am Heart J,1999,137(3):427-434.
[23] Reisner SA,Lysyansky P,Agmon Y,et al.Global longitudinal strain:a novel index of left ventricular systolic function[J].J Am Soc Echocardiogr,2004,17(6):630-633.
[24] de Isla LP,de Agustin A,Rodrigo JL,et al.Chronic mitral regurgitation:a pilot study to assess preoperative left ventricular contractile function using speckle-tracking echocardiography[J].J Am Soc Echocardiogr,2009,22(7):831-838.
[25] Sohn DW,Chai IH,Lee DJ,et al.Assessment of mitral annulus velocity by Doppler tissue imaging in the evaluation of left ventricular diastolic function[J].J Am Coll Cardiol 1997,30(2):474-480.
[26] Tei C,Dujardin KS,Hodge DO,et al.Doppler index combining systolic and diastolic myocardial performance:clinical value in cardiac amyloidosis[J].J Am Coll Cardiol,1996,28(3):658-664.
[27] Arnlov J,Ingelsson E,Riserus U,et al.Myocardial performance index,a Doppler-derived index of global left ventricular function,predicts congestive heart failure in elderly men[J].Eur Heart J,2004,25(24):2220-2225.
[28] Bruch C,Schmermund A,Marin D,et al.Tei-index in patients with mild-to-moderate congestive heart failure[J].Eur Heart J,2000,21(22):1888-1895.
[29] Tei C,Nishimura RA,Seward JB,et al.Noninvasive Doppler-derived myocardial performance index:correlation with simultaneous measurements of cardiac catheterization measurements[J].J Am Soc Echocardiogr,1997,10(2):169-178.
[30] Nasr G,Moselhy MS,Elattar G,et al.Usefulness of Tei index in patients with rheumatic mitral regurgitation and apparently normal left ventricular ejection fraction[J].J Saudi Heart Assoc,2011,23(3):147-150.
[31] Delling FN.Left ventricular ejection index as a marker of early myocardial dysfunction in primary mitral regurgitation:novel or old in disguise?[J].Circ Cardiovasc Imaging,2015,8(9):e003995.
[32] Szymanski C,Magne J,Fournier A,et al.Usefulness of preoperative atrial fibrillation to predict outcome and left ventricular dysfunction after valve repair for mitral valve prolapse[J].Am J Cardiol,2015,115(10):1448-1453.
[33] Yang H,Davidson WR Jr,Chambers CE,et al.Preoperative pulmonary hypertension is associated with postoperative left ventricular dysfunction in chronic organic mitral regurgitation:an echocardiographic and hemodynamic study[J].J Am Soc Echocardiogr,2006,19(8):1051-1055.
[34] David TE,Uden DE,Strauss HD.The importance of the mitral apparatus in left ventricular function after correction of mitral regurgitation[J].Circulation,1983,68(3 Pt 2):Ii76-82.
[35] Imasaka K,Tayama E,Tomita Y.Left ventricular performance early after repair for posterior mitral leaflet prolapse:Chordal replacement versus leaflet resection[J].J Thorac Cardiovasc Surg,2015,150(3):538-545.
