中国骶骨肿瘤外科治疗的进步
2018-06-02郭卫尉然
郭卫尉然
(北京大学人民医院骨与软组织肿瘤治疗中心,北京100044)
骶骨肿瘤为少见肿瘤,其中原发肿瘤更为少见。骶骨原发肿瘤病理类型中以脊索瘤最多见,其次为骨巨细胞瘤及骶骨部位的神经源性肿瘤;同时,骶骨亦为继发性肿瘤好发部位之一,主要为转移癌[1]。骶骨肿瘤的治疗以外科手术治疗为主,由于骶骨解剖结构复杂,同时其与大血管、重要脏器毗邻,术中出血汹涌,手术风险高。由于在骶骨部位难以达到广泛切除边缘,因而,骶骨肿瘤术后的局部复发率也较高。骶骨肿瘤的外科治疗一直是骨与软组织肿瘤外科治疗领域的难题之一[2]。
为解决骶骨肿瘤外科治疗这一世界性难题,我国学者在实践中不断总结、探索。在国内,对骶骨肿瘤的报道始自1932年,早期多为个案报道或少数病例报告[3],自二十世纪七、八十年代开始出现对若干骶骨肿瘤外科治疗病例的描述性研究[4-8],至本世纪已可检索到大量大宗病例临床研究报告[1,2,9]。在对于骶骨肿瘤外科治疗的研究中,我国学者针对于外科分区[10-12]、手术技术[13-19]、手术风险控制[20-24]、骶神经保护[25-28]、切除后重建[29-33]等具体问题进行了深入研究,做了大量的工作。通过在中国知网(CNKI)、万方数据库检索中文文献及在PubMed数据库检索中国学者发表的英文文献,本文从骶骨肿瘤外科分区、手术技术、术中出血控制、骶神经保护、切除后重建及术后并发症的防治六方面对骶骨肿瘤外科治疗领域中我国学者的研究成果进行综述。
1 外科治疗分型
骶骨肿瘤的治疗以外科治疗为主,而手术方式的选择需根据肿瘤的类型、生长部位确定,这就需要外科分型法对骶骨肿瘤进行分型并指导进一步的手术方式。然而,外科分型的形成需要大量临床病例的积累,由于骶骨肿瘤少见,难以在单中心积累足够数量的外科治疗病例,国际上亦几无相关报道。
郭卫等[12]在2007年率先提出了骶骨肿瘤的外科分区方式,其以S2/3椎间盘为界将骶骨分为上位(Ⅰ区)及下位(Ⅱ区)骶椎,肿瘤累及腰椎定义为Ⅲ区,上位骶椎以椎管中心为界分为前(a)、侧(b)、后(c)3个部位。研究认为,累及Ⅰ区的肿瘤如果为良性或转移瘤,可以考虑行刮除术或边缘性切除;如果为恶性肿瘤,需切除一侧或双侧骶髂关节,经骶髂关节前方腹膜后钝性分离肿瘤,争取完整切除肿瘤。对于累及Ⅲ区的骶骨肿瘤,无论良恶性肿瘤均可行整块切除术。Ⅱ区肿瘤的切除方式与Ⅲ区相似,手术应尽可能经后路完成,这能够有效降低术后并发症的发生率。如骶前肿瘤包块巨大可行前后联合入路进行手术切除。
张治宇等[11]在其研究中提出了针对骶骨肿瘤手术入路选择的分型方法,其亦以S2/3椎间盘为界将骶骨分为上位(Ⅰ型)和下位(Ⅱ型);Ⅰ型再分为前区(1区)、骶髂关节区(2区)和后区(3区),Ⅱ型分为前区(1区)和后区(3区);同时还设置了独立参数D,定义为骶前包块最前点至相应水平骶骨前缘的距离,D<5 cm定义为a亚型,D≥5 cm定义为b亚型。单纯前路手术适用于仅1区受累或仅位于骶前的肿瘤,单纯后路适用于仅累及3区或累及1、2、3区但骶前包块不大的患者,前后联合入路适用于累及1、2、3区且形成巨大包块的患者。
骶骨原发恶性肿瘤少见,需行整块切除,但由于骶骨解剖结构复杂,更需外科分型以指导手术方式的选择。李大森等[10]在其研究中提出了针对骶骨原发恶性肿瘤的en bloc切除分型法,其以S1/2椎间盘和S2/3椎间盘为界将骶骨分为上位(S1/2椎间盘以上,1区)、中位(S1/2、S2/3椎间盘之间,2区)和下位(S2/3椎间盘以下3区)三个区域,各定义为Ⅰ、Ⅱ、Ⅲ型,Ⅳ型定义为仅累及半侧骶骨的肿瘤,Ⅴ型定义为累及L5椎体的肿瘤。Ⅰ型需行全骶骨切除术(经前后联合入路),Ⅱ型需行经S1椎体的en bloc切除术(单纯后路),Ⅲ型需行经S2椎体的en bloc切除术(单纯后路),Ⅳ型需行矢状位半侧骶骨及相邻髂骨的en bloc切除术(前后联合入路),Ⅴ型需在Ⅰ型的切除范围中包含S5椎体(图1)。
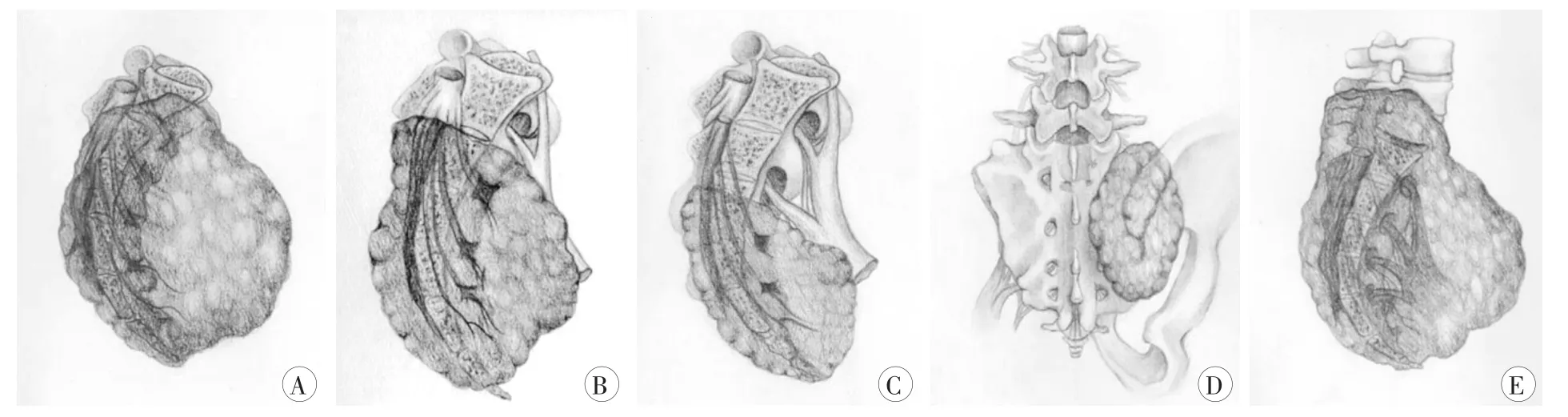
图1 骶骨原发恶性肿瘤的en bloc切除分型
骶骨肿瘤外科分型的制订需要大量病例的积累、总结,同时亦需要大量病例对其效果进行验证。我国学者的研究是基于较大宗病例的临床研究,提出了相应的骶骨肿瘤外科分期方法,并以其为原则对骶骨肿瘤进行手术治疗,效果良好,对骶骨肿瘤的分类及外科治疗方式的选择起到了一定的指导作用。
2 手术技术
骶骨肿瘤外科治疗方式的选择因肿瘤的类型、累及范围不同而异,手术入路可分为单纯前方入路、后方入路、前后联合入路等,详细的入路选择原则可参考前文对于骶骨肿瘤外科分型的阐述。传统上讲,单纯前方入路多用于肿瘤仅累及高位骶骨前方且包块位于骶前的患者[11];单纯后方入路多用于累及低位骶骨的肿瘤、累及高位骶骨的良性或转移性肿瘤、累及高位骶骨包块较小的恶性肿瘤[15],随着外科技术的发展,研究者认为即使是肿瘤较大的患者,仅单纯后方入路亦可完成手术[2,34];前后联合入路适用于肿瘤较大、累及骶骨节段较高的肿瘤的手术切除[17,35-38]。
骶骨肿瘤手术切除方式的选择亦根据肿瘤的位置、病理类型而有所不同,手术切除方式可大致分为切刮术、边缘/广泛切除。概括来说,对于累及低位骶骨的肿瘤,无论其病理类型,研究者大多认为可直接行肿瘤的边缘或广泛切除[2,39,40];对于累及高位骶骨肿瘤,良性肿瘤或转移性肿瘤多行切刮术[9,41],而对于原发恶性肿瘤,较早的研究认为其手术风险高、术后获益低,建议行瘤内手术以保留骶神经[15,42],但瘤内手术的高复发率仍十分令人担忧[34],随着外科技术的进步,对累及高位骶骨的原发恶性肿瘤,全骶骨切除以达到边缘/广泛切除已成为成熟的手术方案[16,17,43,44]。
2.1 不同肿瘤类型的手术原则及预后
2.1.1 脊索瘤:脊索瘤为骶骨原发肿瘤中最常见的病理类型,在郭卫等报道的单中心原发骶骨肿瘤790例的报告中占24.4%[1],亦为国内最早报道的骶骨肿瘤病理类型[3]。其为低度恶性肿瘤,5年生存率81.0%~90.1%[13,45-48],生存期较长。肿瘤复发为骶骨脊索瘤最大的问题,文献报道的复发率为23.6%~64.7%[13,45-48],同时亦可发生转移,转移率相对较低,文献报道为5.0%~17%[13,45-48],局部复发会增加转移率,进而影响患者的预后[46,47]。为了降低局部复发率,所有研究者均认为在初次手术时应尽可能对骶骨脊索瘤进行彻底切除以降低局部复发率,进而改善患者的预后[46,49]。
脊索瘤大多位于低位骶骨,对位于低位骶骨的脊索瘤整块切除更易实现,国内文献中对位于低位骶骨的脊索瘤的外科治疗的报道自始即以整块切除为主要手术方式[8,13,48,50]。而对于累及高位骶骨的脊索瘤外科治疗方式则存在争议。由于累及高位骶骨的脊索瘤多与S1、S2神经根分界不清,如行整块切除则会牺牲上位骶神经功能,影响患者生活质量,同时,整块切除手术创伤大,术中出血多,损伤邻近器官、组织的风险较高。因而部分国内研究者在其早期研究报告中认为,对于累及上位骶骨的脊索瘤可行切刮术,亦即广泛切除S2以下肿瘤病灶,近端病灶行刮除术以尽可能保全上位骶神经[13,15,45]。然而,随着对疾病本身理解的逐步深入,许多研究者认为在骶骨脊索瘤患者术后较长的生存期内,其反复复发会对患者造成更严重的伤害[46]。多项研究均证实,瘤内手术明显增加了骶骨脊索瘤术后复发的几率,而广泛/边缘切除能够有效降低复发率,同时亦可显著改善患者的预后[46,47,49,51,52]。同时,随着外科技术的发展,对累及上位骶骨的脊索瘤进行广泛/边缘切除的手术风险逐步降低,对骶神经保留的相关研究亦使患者术后生活质量较前有一定改善,郭卫等[16,17]在2013年和2015年关于前后路联合和单纯后路全骶骨切除的2份研究报告(19例)中纳入了7例累及高位骶骨的脊索瘤的患者,在接受全骶骨切除术后随访期内患者均无复发、转移。这均说明,对于骶骨脊索瘤,无论其部位、大小,初次手术时均应力争达到整块切除,以达到肿瘤长期控制的目的。
2.1.2 神经源性肿瘤:神经源性肿瘤理论上并非起源于骶骨,但骶骨仍为其好发部位之一,在郭卫等报道的单中心原发骶骨肿瘤790例的报告中占19.0%[1]。骶骨神经源性肿瘤包括良性神经源性肿瘤(神经纤维瘤、神经鞘瘤)及恶性神经源性肿瘤(恶性神经鞘瘤、神经纤维肉瘤)。我国文献中对于骶骨神经源性肿瘤的专题报道相对较少,其中良性骶骨神经源性肿瘤的预后良好,复发率在7.3%~12.5%[53-55],恶性神经源性肿瘤的报道较少。
郭卫等[54]在2009年对48例骶骨神经源性肿瘤患者的外科治疗经验进行了总结,率先根据肿瘤生长模式提出了骶骨神经源性肿瘤的分型方法:Ⅰ型,肿瘤生长限于骶管内,骶管膨胀扩大(图2A);Ⅱ型,肿瘤出骶神经孔向前生长,形成巨大骶前肿块(图2B);Ⅲ型,肿瘤向前、向后均生长,骶骨前后均形成肿块(图2C);Ⅳ型,肿瘤生长只限于骶前,骶管内没有肿瘤(图2D)。对Ⅰ型及Ⅱ、Ⅲ型中骶前包块低于骶1水平的患者行单纯后路手术;对Ⅱ、Ⅲ型中骶前包块高于S1水平的患者行前后联合入路手术,自后路切除骶管内肿瘤并扩大骶孔,自前路切除剩余肿瘤;对Ⅳ型患者行单纯前路手术。研究结果显示,通过该分型对良性神经源性肿瘤进行外科治疗基本可达边缘切除,预后良好;恶性神经源性肿瘤患者预后不佳(5/7例患者发生术后复发,3/7例患者出现转移),作者认为恶性神经源性肿瘤应根据肿瘤部位、累及范围选取适宜的手术方式进行广泛切除。
孙伟等[53]在2016年对64例良性骶骨神经源性肿瘤患者进行了报告,其中38例为神经鞘瘤、26例为神经纤维瘤,手术入路根据前文张治宇等[11]提出的骶骨肿瘤外科分区进行选择,8例(12.5%)术后出现了肿瘤复发。对于骶骨巨大良性神经源性肿瘤,郭卫等[56]在2016年发表文章对其手术效果进行了研究。188例患者中,仅9例行整块切除,余179例患者均行分块完整切除,术后复发率为8.5%,提示对于骶骨良性神经源性肿瘤亦可行分块切除,在保证较低复发率的同时降低手术风险,缩短手术时间。
2.1.3 骨巨细胞瘤:骶骨骨巨细胞瘤是骶骨原发肿瘤中第二好发的的肿瘤类型,其占骶骨原发肿瘤的17.8%[1]。其多位于高位骶骨,且其性质非恶性肿瘤,因而瘤内手术应为其合理的外科治疗方式,但由于骨巨细胞瘤血供丰富,术中出血较多影响刮除操作;同时骶骨解剖结构复杂,刮除过程中存在肿瘤残留可能,因而部分研究者亦认为应对骶骨骨巨细胞瘤行整块切除。
整块切除的文献多为早期研究,究其原因可能为早期降低术中出血的相关措施(如术前肿瘤血管栓塞、术中腹主动脉球囊临时阻断等)发展不完善,若行瘤内切除其出血汹涌,无法做到彻底刮除,而整块切除可明显降低复发率[57-59],但术后伤口并发症发生风险较高,且手术对骶神经功能影响较大。随着外科治疗技术、减少术中出血的措施(如术前肿瘤血管栓塞、术中腹主动脉/髂动脉阻断或腹主动脉球囊阻断等)的进步,切刮术逐步成为了骶骨骨巨细胞瘤的主流外科治疗方式。文献中对于少数仅累及S3以下水平的骨巨细胞瘤采取整块切除,而对大多数累及高位骶骨的肿瘤采取瘤内刮除,同时强调采用减少术中出血的措施(如术前肿瘤血管栓塞、术中腹主动脉/髂动脉阻断或腹主动脉球囊阻断等等)以进一步降低手术风险,并提高彻底刮除肿瘤的可能性。局部复发率为 14.3%~37.5%[41,60-67],其中郭卫等[67]在2016年发表的文献中对采用血管阻断措施与未采用血管阻断措施的骶骨骨巨细胞瘤患者的术中出血情况及术后复发率进行了比较,结果显示非血管阻断组的术中出血量及术后复发率均显著高于血管阻断组,提示减少术中出血措施在降低骶骨骨巨细胞瘤手术风险及术后复发率方面起到了重要作用。

图2 骶骨神经源性肿瘤分型
为进一步改善骶骨骨巨细胞瘤的手术效果,国内研究者还进行了一些尝试。许炜等[68]在其研究中发现双膦酸盐对降低骶骨骨巨细胞瘤术后复发率具有一定的作用。迪诺单抗对于骨巨细胞瘤的作用已被大量研究所证实,姬涛等[69]在其研究中报道了2例骶骨巨大骨巨细胞瘤应用迪诺单抗联合多次肿瘤血管栓塞治疗,最终达到了肿瘤控制的目的,还成功对其中1例进行了手术切除;杨毅等[70]在其研究中对12例复发或难治性骶骨肿瘤患者进行了迪诺单抗的治疗,效果良好。目前国内尚无针对于骶骨骨巨细胞瘤迪诺单抗术前用药与手术效果关系的相关研究。
2.1.4 原发高度恶性肿瘤:骶骨原发高度恶性肿瘤(骨肉瘤、软骨肉瘤、尤文肉瘤/PNET等)发病率低,占骶骨原发肿瘤的13.0%[1]。由于其恶性程度高,如采取边缘/瘤内切除其复发率极高,预后不良,因而建议在规范的综合治疗的前提下行广泛性手术切除。对于骶骨原发高度恶性肿瘤,国内专题文献报道较少。李晓等[71]在2014年报告了15例接受外科治疗的骶骨尤文肉瘤患者,其5年总生存率为47%,2年、5年无病生存率分别为60%、33.3%;9例分块切除,6例整块切除,共9例患者发生复发,其中整块切除组1例复发、1例复发伴肺转移,提示对骶骨尤文肉瘤应行整块切除。尉然等[72]在其研究中对34例接受外科治疗的骶骨软骨肉瘤患者进行了总结,术后5年总生存率、无病生存率分别为59.4%、25.5%;34例患者中11例接受了整块切除手术,23例接受了分块切除手术,整块切除组患者的无病生存率显著优于分块切除组患者。王毅飞等[73]报告了26例接受手术治疗的骶骨骨肉瘤患者,其5年总生存率为38.7%,共10例患者发生复发,其中取得满意的外科边界的患者复发率及无病生存率显著优于未取得满意外科边界的患者。
2.1.5 转移癌:除原发肿瘤外,转移癌亦在骶骨肿瘤中占有很大的比例。对于骶骨转移癌,明确把握手术适应证及其选择适宜的手术方式显得尤为重要,骶骨转移癌的手术适应证可概括为:①严重的骶尾部疼痛及肿瘤压迫神经造成的神经性疼痛;②放疗后疼痛症状缓解不满意,或放疗后肿瘤进展;③肿瘤累及腰骶椎导致腰骶或骶髂关节不稳定;④累及S3以下的单发骨转移。手术方式的选择上,如肿瘤仅累及S3以下水平则可行全切术,累及S3以上水平则应行切刮术,并在术中尽可能保证骶神经的完整性[9,74]。
郭卫等[9]在其研究中对61例接受外科治疗的骶骨转移癌患者进行了总结,症状缓解率分别为疼痛89.5%(51/57)、大小便功能异常66.7%(8/12),90.2%的患者在术后2周均恢复了完全的行走功能。杜志业等[74]在其对154例接受外科治疗的骶骨转移癌患者的研究中针对于患者术后生活质量进行了评估,结果显示通过严格把握手术适应证及选择适宜的手术方式,骶骨转移癌患者可在术后明确改善生活质量。此外,对于仅限于骶椎内、并未引起神经症状而仅有局部严重疼痛症状的转移病灶,吴春根等[75]、孙刚等[76]及冯飞等[77]在其研究中均认为经皮骶骨骨水泥成形术可取得满意的疗效。
2.2 骶骨肿瘤的整块切除
对于骶骨肿瘤的整块切除,由于骶骨复杂的解剖形态及周围特殊的解剖结构一直以来均为骨肿瘤专业医师所忌惮。我国学者在这一领域不断探索、创新,提出、改良了许多术式。
2.2.1 全骶骨切除术:主要应用于累及高位骶骨的恶性肿瘤的整块切除,亦即李大森等提出的骶骨原发恶性肿瘤整块切除分型中的Ⅰ型[10]。该术式是对于骶骨肿瘤最彻底的切除术式,由于骶骨复杂的解剖形态及周围毗邻的重要组织、脏器,其一直被认为是难度高、风险大的术式。早期研究者认为该手术会严重损害术后患者生活质量,同时术中风险较高,无论肿瘤类型均不建议行全骶骨切除手术[15]。随着外科技术的进步以及减少术中出血措施的逐步发展,全骶骨切除术已日趋成熟,逐渐广泛应用于累及高位骶骨的恶性肿瘤治疗中。国内学者的研究成果也充分记录了该手术技术的发展历程。
郭卫等[78]2010年在国内率先报道了Ⅰ期前后联合入路全骶骨切除术:前方腹部双侧“倒八字”切口,经腹膜外间隙进入。结扎双侧髂内动脉并用球囊暂时阻断腹主动脉血流,游离双侧髂血管并结扎其小分支。分离肿瘤前方软组织,尽可能切除L5/S1椎间盘。分离坐骨大孔及骶髂关节上缘,分别于坐骨大孔及骶髂关节上缘用粗穿刺针向背侧导入硅胶管的两端,以备后路切除肿瘤时经塑料管导入线锯锯断两侧髂骨。在其2013年发表的对9例经该术式切除骶骨肿瘤的文章中,其平均手术时间为9.5 h,平均术中出血量为3500 ml,2例(22.2%)出现切口相关并发症;在中位时间为19.7个月的随访期内,2例(22.2%)发生局部复发,术后9例患者双侧踝关节跖屈消失、背伸存在,持续留置尿管,大便存在不同程度的失禁,但均未行造瘘[17](图3)。郑国权等[79]2014年报道的研究中亦采用类似的Ⅰ期前后联合入路全骶骨切除术,区别在于其在骶骨切除后对已切断的双侧S1~S3神经进行吻合;5例患者平均手术时间为8.1 h,平均术中出血量为4832 ml,1例(20.0%)出现切口相关并发症;术后5例患者双侧踝关节跖屈消失,背伸减弱,膀胱/直肠功能部分或完全丧失;术后1年2例患者神经功能部分恢复。
臧杰等[16]在2015年描述了Ⅰ期单纯后路全骶骨切除术的手术方式:患者取俯卧位,取腰骶部倒“Y”形切口,纵行切口止于低位关节处并沿臀大肌纤维走行方向向两侧延伸。逐层切开各层组织,分离骶脊肌、臀肌以充分显露下位腰椎棘突及椎板、骶骨后方骨质以及双侧髂后。根据需要在下位腰椎的双侧椎弓根处预先拧入适宜的椎弓根钉。切断骶骨侧方附着的梨状肌等肌肉及骶棘韧带、骶结节韧带以显露骶前间隙,游离骶骨前方,以湿纱布将直肠等盆腔脏器推向前方并保护,钝性分离骶前肿瘤包块至S1水平。切除肿瘤水平以上的骶骨椎板以及L5下关节突以显露硬膜囊和双侧L5神经根。切断并结扎L5神经根水平以下的硬膜囊,分离保护双侧L5神经根。自后方尽可能清除L5/S1椎间盘。切除双侧L5横突,自双侧骶髂关节上下缘以手指钝性分离骶髂关节前方间隙,分离过程中填入纱布以将腰骶干、髂血管推向前方加以保护(图4A)。分离完毕后,向骶髂关节前方间隙引入硅胶管,通过硅胶管导入线锯,确认双侧线锯位置均位于骶髂关节外侧以获得满意的外科边界(图4B)。10例患者平均手术时间为4.7 h,术中平均出血量为2595 ml,4例(40.0%)出现术后并发症(3例切口相关并发症、1例深静脉血栓),2例(20.0%)出现局部复发;术后二便功能均有不同程度的丧失,9例患者双侧踝关节背伸、跖屈均保留,该发现再次证实S1神经根切断对踝关节背伸、跖屈功能不会产生大的影响。孙伟等[80]亦报道了采取类似单纯后路全骶骨切除术的病例,5例患者平均手术时间6.5 h,术中平均出血量3700 ml,术后1例(20.0%)发生局部复发,3例患者发生并发症(1例术中直肠损伤行临时造瘘,2例切口相关并发症);5例患者均出现不同程度的二便功能丧失,4例患者出现双踝关节跖屈减弱。
2.2.2 半侧骶骨切除术:累及一侧骶髂关节且肿瘤的安全边界距对侧骶神经孔有一定距离的骶骨肿瘤在进行整块切除的同时存在保留对侧骶神经的可能。郭卫等于2015年、2016年先后在国内外率先报道了保留对侧骶神经孔的部分骶骨及骶髂关节整块切除术式[18,81]。该术式适用于李大森等[10]报道的骶骨原发恶性肿瘤整块切除分型中的Ⅳ型。手术采用Ⅰ期前后联合入路进行,患者先取俯卧位,腰骶部后正中切口显露骶骨及髂骨后部,打开骶管,分离硬膜,切断患侧骶神经根,临时缝合伤口。患者再取侧卧位,患侧在上。倒“八字”切口向上循髂嵴延伸与后方切口相连。腹膜外分离至骶骨前方,分离结扎肿瘤表面的髂血管分支。在肿瘤骶骨侧的安全边界外显露骶骨前方,自前方最大可能切除L5/S1椎间盘。拆除后方切口缝线,骨盆外剥离臀肌至坐骨大孔。显露坐骨大孔,保护神经、血管,自坐骨大孔导入线锯,在肿瘤髂骨侧的安全边界外锯断髂骨。将硬膜拉向健侧,在肿瘤骶骨侧的安全边界外纵向锯断骶骨,整块切除肿瘤。15例患者平均手术时间为6.1 h,平均术中出血量为3600 ml,术后4例(26.7%)出现并发症(均为切口相关并发症)。15例患者健侧骶神经均被保留,其中3例患侧S1神经根被保留,余12例患者术后患侧踝关节跖屈肌力减退或消失,所有患者术后均可恢复行走功能。15例患者的括约肌功能均被部分保留,无病例需永久留置尿管或造瘘[18]。
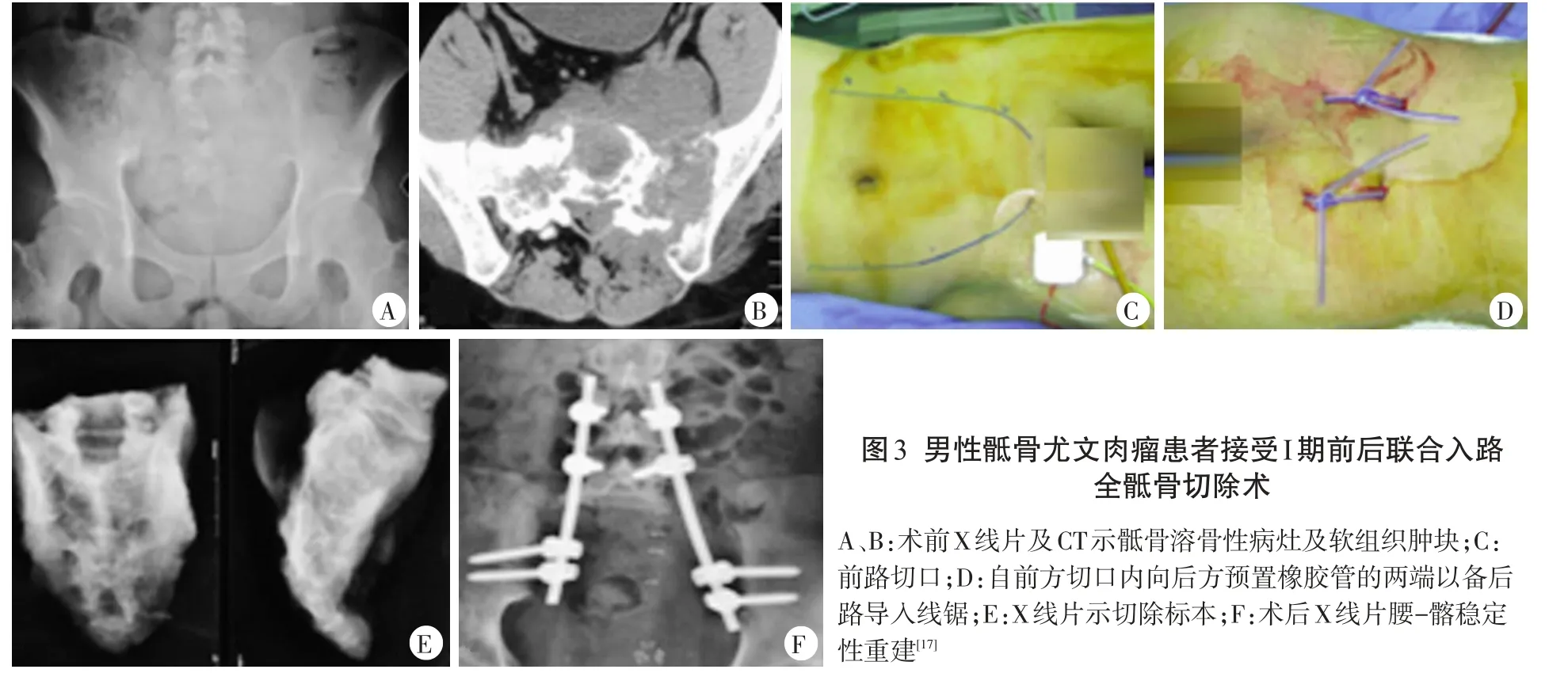
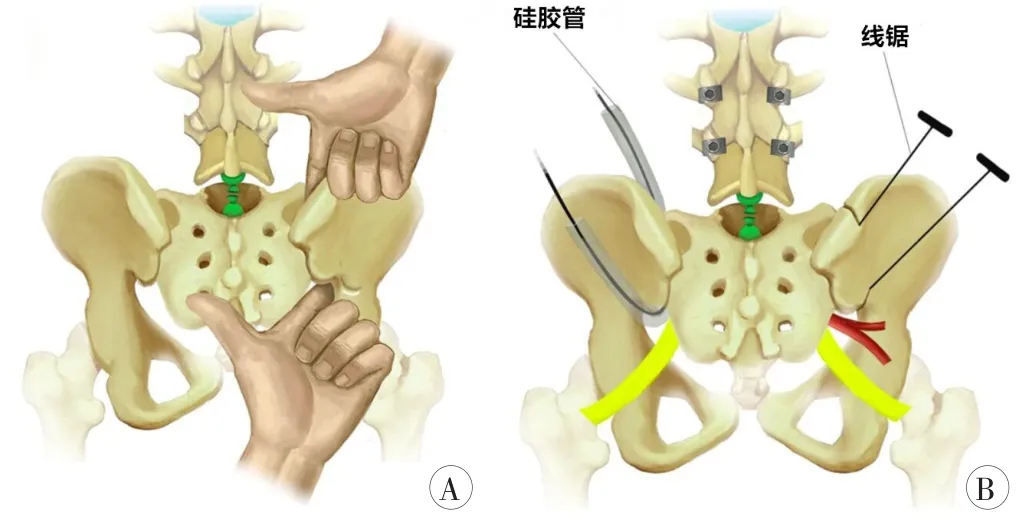
图4 Ⅰ期单纯后路全骶骨切除术手术技术示意图
2.2.3 低位骶骨切除:对于位于低位骶骨原发肿瘤的切除,大多研究者均认为,无论其病理性质,手术方式均应为整块切除,这是由于整块切除能够有效降低肿瘤的复发率,同时其切除对骶神经功能影响较小。我国研究者报道的低位骶骨肿瘤整块切除的术后复发率为0~15.8%,术后患者的骶神经功能恢复情况令人满意[39,40,82]。
3 术中出血控制
术中出血是骶骨肿瘤外科治疗无法回避的问题。由于骶骨局部解剖结构复杂,术中出血量往往过多,这会导致术野不清,肿瘤不易彻底切除,同时会因大量失血发生失血性休克,最终导致围手术期死亡率、术中及术后并发症发生率及肿瘤局部复发率增高,显著影响手术的安全性及手术效果。汤小东等[83]对173例骶骨肿瘤手术患者的总失血量(术中出血量和术后第1天引流量的总和)进行了回顾,总失血量平均为(2922.49±1844.93)ml,其中 69例(39.9%)失血量超过3000 ml,肿瘤累及高位骶骨、肿瘤瘤体较大、血供丰富为骶骨肿瘤外科治疗大量失血的独立危险因素。为减少失血,降低手术风险,改善手术效果,国内研究者对多种减少术中出血措施进行了尝试。
3.1 术中腹主动脉临时阻断技术
早期文献报道的骶骨肿瘤术中减少出血措施多为在前路手术过程中结扎单侧或双侧髂内动脉、骶正中动脉[4,6,7,84],其对减少术中出血有一定的效果,但虽然骶骨部位的血供主要来自于双侧髂内动脉和骶正中动脉,但其与周围其他血管(如臀上动脉)存在广泛的吻合支,该措施效果往往十分有限。许多研究者尝试临时阻断腹主动脉的措施以减少术中出血,其阻断方法为应用阻断带、硅胶管组成阻断装置置于腹主动脉分叉处上方1~3 cm处。罗怀灿等[85]在1998年报道了该技术在骶骨肿瘤切除中的应用,其阻断时间平均为1.6 h,术中出血量平均1100 ml。李鼎锋等[24]比较了采用腹主动脉临时阻断技术和未采用该技术的骶骨肿瘤患者术中出血量,结果显示采取腹主动脉临时阻断技术的患者术中平均减少出血1600 ml。其他研究报道采取该技术的骶骨肿瘤手术切除患者术中出血量平均为900~3100 ml,平均阻断时间50~100 min,术后均未报告血管阻断相关并发症[86-89]。这提示该技术减少术中出血效果较好,且应用安全。然而,该技术需要前方切口以显露腹主动脉置入阻断装置,对于包括前方入路的骶骨肿瘤手术,尚可在手术过程中进行阻断,而对于可单纯自后路手术切除的骶骨肿瘤,相当于增加了1次前方入路的手术,明显增加了手术的复杂性。
3.2 术前选择性动脉栓塞
随着放射介入手段的逐步成熟,术前选择性动脉栓塞技术亦被广泛地应用于减少骶骨肿瘤术中出血之中。吴学建等[90]和杨惠林等[91]分别在1998年报道了对骶骨肿瘤外科治疗患者术前应用选择性动脉栓塞技术,其平均术中出血量分别为800 ml和890 ml。此后多篇文献均对该技术在骶骨肿瘤外科治疗过程中的应用进行报道,其平均术中出血量为1163.8~2700 ml[22,92-96]。术前选择性动脉栓塞技术能够有效减少术中出血量,且能够使肿瘤内部发生坏死,稍缩小肿块,有利于完整切除肿瘤。但是,由于骶骨周围血管存在大量共干、吻合的情况,栓塞会增加切口周围血运不佳的风险,提高切口相关并发症发生的风险[96,97];栓塞后手术时机的选择亦会影响术中出血量,栓塞与手术间隔时间过长会导致血管再通及侧支循环建立,影响栓塞效果。术前选择性动脉栓塞虽可减少手术整体的失血量,但对于短时大量出血则无明确作用。
3.3 腹主动脉球囊临时阻断技术
受球囊导管在血管外科应用的启发,2003年起,国内文献开始报道在骶骨肿瘤术前置入腹主动脉球囊导管,术中一过性阻断腹主动脉血流,以降低骶骨肿瘤术中出血量。朱杰诚等[98]在2003年报告22例应用腹主动脉球囊临时阻断技术的骶骨肿瘤外科治疗患者,平均出血量为760 ml,其阻断方式为自切皮前充盈球囊,每次充盈持续时间45 min,间歇10 min;该组病例虽未出现球囊相关术后并发症(如下肢缺血坏死、动静脉血栓等),但其阻断时段自手术开始直至结束,阻断时间较长,出现球囊相关并发症的风险较高。米川等[20]于2005年率先于国际期刊报告了3例应用腹主动脉球囊临时阻断技术辅助骶骨肿瘤外科治疗的病例,3例病例中腹主动脉球囊仅于切刮肿瘤过程中加压,球囊充盈时间分别为65 min、40 min及143 min(分3次,3次时间分别为60 min、48 min、35 min,球囊充盈间隔时间15 min),3例患者术中出血量均小于200 ml,术后均未出现明确并发症(图5)。此后,我国研究者于国内外多次报道腹主动脉球囊临时阻断技术在骶骨肿瘤外科治疗中的应用,术中平均出血量为280~2650 ml,术后球囊相关并发症发生率为0~6.7%[21,99-102]。
汤小东等[21]在2010年发表了国际上最大宗的在骶骨肿瘤外科治疗中应用腹主动脉球囊临时阻断技术的报告,其对应用和未应用腹主动脉球囊临时阻断技术的骶骨肿瘤外科治疗患者进行了比较,结果显示,前者的术中出血量和总失血量显著低于后者,证实了该技术在减少骶骨肿瘤术中失血中的价值。孔金海等[103]在骶骨肿瘤外科治疗患者中对应用腹主动脉球囊临时阻断和术前选择性动脉栓塞导致术后切口愈合不佳及皮肤坏死进行了比较,结果显示,前者切口相关并发症的发生率显著低于后者,提示其对于骶骨肿瘤外科治疗患者来说更为安全。
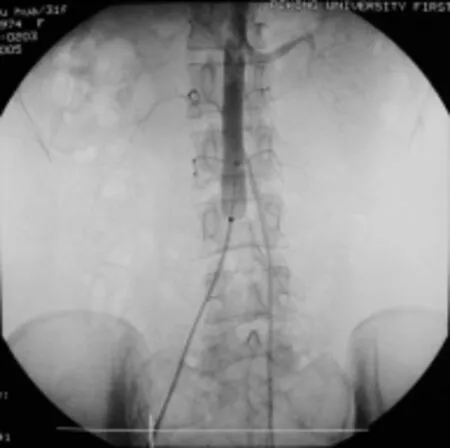
图5 腹主动脉球囊临时阻断造影图,可见球囊充盈后腹主动脉远端血运已阻断[20]
4 骶神经功能评估
骶骨肿瘤切除过程中,骶神经存在损伤风险,而在一些整块切除的手术中,部分或全部骶神经需被牺牲以达到满意的外科边界。骶神经功能损伤是骶骨肿瘤切除术后最常见的并发症之一,显著影响患者的生活质量。范胜利等[104]在2005年对58例骶骨肿瘤患者骶神经切除后大小便功能的恢复情况进行了描述,结果显示,至少保留1侧S3神经根对于骶骨肿瘤外科治疗患者的大小便功能恢复至关重要。朱烨等[105]在2009年对48例骶骨肿瘤术后大小便功能的回顾研究亦得出同样的结论。孙馨等[28]在其研究中回顾了142例接受骶骨手术患者术后二便情况,结果显示至少保留一侧S3神经根的患者术后二便功能明显好于未保留S3神经根的患者,保留单侧S3的患者一半没有二便困难,80%保留双侧S3的患者能保留正常的二便功能。黎承军等[26]对骶骨肿瘤手术患者骶神经切除水平对男性勃起及射精功能影响进行了回顾性分析,研究纳入47例患者,结果显示至少保留一侧的S3神经根对患者术后阴茎勃起及射精功能的保存是至关重要的。黄林等[25]提出了对骶骨肿瘤切除后骶神经功能状态的评分系统,并将其应用于170例骶骨肿瘤外科治疗患者的术后骶神经功能评估中,结果显示评分系统能够有效地描述术后骶神经功能状态,其中保留双侧S1神经根在保留下肢运动及感觉功能中起决定性作用;保留双侧S3神经根患者的尿失禁和膀胱感觉异常情况均优于保留单侧S3神经根的患者,而保留单侧S3神经根患者的排尿困难、便秘、大便失禁及直肠感觉异常情况均优于双侧S3神经根牺牲的患者。另外,保留尾骨患者的骶神经功能整体优于未保留尾骨者。
5 腰-髂稳定性重建
在累及高位骶骨的骶骨肿瘤的外科治疗中,肿瘤切除会影响脊柱、骨盆环的稳定性,如不进行重建,会导致患者卧床时间延长,而在肿瘤切除后对腰-髂稳定性进行重建有利于患者早期下床活动[2]。国内文献报道的腰-髂稳定性重建方案以腰椎-骨盆固定为主,其主要方式为通过腰椎椎弓根钉、髂骨螺钉、钛棒组成钉棒系统进行重建(图6A),部分联合腰髂部颗粒性植骨以诱导骨融合,重建操作简便,文献中报道所有患者术后腰-髂部均获得满意的稳定性,
机械性并发症发生率0~25.0%[14,31,60,106-108]。吴强等[109]在2013年对高位骶骨肿瘤切除后重建进行了分类:肿瘤切除后仍能保留半个S1椎体者,行单侧腰髂椎弓根内固定,骨缺损处与髂骨间行植骨融合;累及单侧高位骶骨及骶髂关节和部分髂骨者,行单侧腰髂椎弓根内固定,L5与残留髂骨间行异体腓骨结构性植骨;累及高位骶骨及双侧骶髂关节者,行双侧腰髂椎弓根内固定,L5椎体下缘与双侧髂骨间行异体腓骨支撑于双侧髂骨间(图6B)。其据此分类法对11例患者行腰-髂稳定性重建,术后未见明确机械性并发症发生。
此外,国内学者还曾报道过其他腰-髂重建方式。李众利等[32]报道应用异体管状骨直接重建骶骨肿瘤切除后骨盆环,在肿瘤切除后将异体股骨或胫骨中段横向置于骨缺损内,两端与双侧髂骨紧密接触,并应用哈氏棒、张力带钢丝将异体骨与双侧髂骨牢固固定,并与L5椎体下面接触;该研究报道5例患者,2例患者出现机械性并发症,其中1例异体骨半脱位、1例哈氏棒松动,余3例患者均可观察到异体骨与髂骨部分融合。丁焕文等[110]对4例骶骨肿瘤患者依据术前CAD技术设计的模型精确设计肿瘤切除范围,术中采用截骨导板切除肿瘤后,根据CAD模型制作外形匹配的异体骨,应用接骨板-螺钉或椎弓根钉-钛棒系统将其固定于骨缺损内进行重建(图6C);术后平均随访时间10个月,患者均恢复行走功能,未见明确机械性并发症发生。尉然等[29]报道1例应用3D打印技术制造人工假体重建全骶骨切除后骨缺损,其根据患者术前影像学检查确定骨缺损形状,应用3D打印技术设计、制造了全骶骨假体并以其进行腰-髂稳定性重建(图6D),术后患者腰-髂稳定性恢复良好,且可在假体-骨接触面观察到骨长入。
6 术后并发症的防治
骶骨肿瘤术后并发症是骶骨肿瘤外科治疗中不可忽视的问题。文献中报道的由于骶骨解剖位置特殊,肿瘤切除后往往会残留空腔,同时手术过程中可能损伤盆腔脏器及营养骶尾部皮肤的血管、神经,且手术部位毗邻会阴,会导致术后并发症发生率增高。骶骨肿瘤外科治疗的并发症可大致分为切口相关并发症(切口感染、切口延迟愈合、皮缘坏死)、出血、脑脊液漏、血栓栓塞性并发症、神经功能障碍。出血相关并发症、神经功能障碍已在前文论及,此处不加赘述;术后脑脊液漏多可经非手术治疗(抬高床尾、局部加压、抗生素应用等)缓解[2,111],对于效果不佳者,亦可应用持续腰椎穿刺引流方法治疗[112]。本节主要综述国内研究者对骶骨肿瘤外科治疗切口相关并发症的研究。
切口相关并发症为骶骨肿瘤外科治疗最常见的并发症,发生率15.4%~42.3%[2,15,38,113-116]。其中切口延迟愈合、皮缘坏死可经换药等保守治疗好转,但切口感染多需行清创手术,会显著增加患者的住院时间、治疗费用,同时,治疗感染本身亦可引起许多相关并发症,明显影响骶骨肿瘤外科治疗的治疗效果。国内多位研究者均对骶骨肿瘤外科治疗切口感染的危险因素进行了研究。李大森等[117]对387例骶骨肿瘤外科治疗患者切口相关并发症的危险因素进行了分析,结果显示切口相关并发症发生率为29.2%,切口感染发生率为13.2%,发生切口相关并发症的独立危险因素为高龄、糖尿病、术前局部放疗史、瘤体巨大(≥10 cm)、应用内植物以及合并直肠破裂,而发生切口感染的独立危险因素为术前局部放疗史、合并直肠破裂、手术时间长、脑脊液漏。陈康武等[118]对45例骶骨脊索瘤患者进行了回顾性研究,结果显示术后切口感染发生率为35.6%,术前白蛋白水平低(<30 g/L)、局部手术史以及手术时间长(≥6 h)为切口感染的独立危险因素。孔金海等[97]对81例接受术前选择性动脉栓塞及手术的骶骨肿瘤患者术后出现切口相关并发症的危险因素进行了研究,结果显示切口相关并发症发生率为18.5%,术前局部放疗史、糖尿病为发生切口相关并发症的独立危险因素。据此,对拟接受手术治疗的骶骨肿瘤患者,术前应详细了解患者病史,改善患者营养状况;术前做好胃肠道准备,如肿瘤与直肠关系紧密,术中破裂风险极高者,可预先行结肠造瘘;术中尽可能缩短手术时间以预防切口并发症发生。对存在以上危险因素的患者,更应勤加观察,及时处理。

图6 骶骨肿瘤切除后腰-髂稳定性重建
综上,我国学者在骶骨肿瘤外科治疗领域进行了大量研究,在外科治疗分区、手术技术、术中出血控制、骶神经保护、切除后重建及术后并发症方面均取得了丰硕的研究成果,亦在国际上多次介绍了来自中国的研究成果,从而将骶骨肿瘤外科治疗的中国经验推广至国际舞台。然而,对于骶骨肿瘤外科治疗方式和评价方式的标准化仍有待加强,这需要进一步加强国内各中心的协作、交流,从而力争进一步提高骶骨肿瘤外科治疗的效果和安全性。
[1] 郭卫,李大森,尉然,等.单中心原发骶骨肿瘤790例的流行病学分析.中国脊柱脊髓杂志,2014,24(11):971-978.
[2] 郭卫,徐万鹏,杨荣利,等.骶骨肿瘤的手术治疗.中华外科杂志,2003,41(11):827-831.
[3] 刘世杰,等.脊索瘤(附6例报告).天津医药杂志骨科附刊,1956,9(3):228-231.
[4] 北京积水潭医院创伤骨科骨肿瘤组.原发性骶骨肿瘤的诊断和治疗.中华外科杂志,1978,16(3):150-152.
[5] 郭世绂,张义修,刘松年,等.脊柱肿瘤及肿瘤样变.天津医药肿瘤学附刊,1981,(2):88-90.
[6] 刘植珊,李光业,陈永裕,等.骶骨部巨大肿瘤的手术治疗.第二军医大学学报,1982,3(1):33-35.
[7] 胡云洲.原发性骶骨肿瘤(附15例临床分析).中华骨科杂志,1983,3(1):6.
[8] 罗怀灿,张寿熙,刘基仁,等.骶骨脊索瘤切除手术的改进.同济医科大学学报,1987,(2):147-152.
[9] 郭卫,曲华毅,杨荣利,等.骶骨转移瘤的外科治疗评价.中国脊柱脊髓杂志,2008,18(6):415-419,Ⅱ.
[10] Li D,Guo W,Tang X,et al.Surgical classification of different types of en bloc resection for primary malignant sacral tumors.Eur Spine J,2011,20(12):2275-2281.
[11] Zhang Z,Hua Y,Li G,et al.Preliminary proposal for surgical classification of sacral tumors.J Neurosurg Spine,2010,13(5):651-658.
[12] 郭卫,汤小东,杨毅,等.骶骨肿瘤的分区与手术方法探讨.中国脊柱脊髓杂志,2007,17(8):605-610.
[13] 郭卫,燕太强,汤小东,等.骶骨脊索瘤的手术治疗结果评价.中华外科杂志,2009,47(16):1224-1227.
[14] 蔡郑东,李国东,张寅权,等.高位骶骨肿瘤的外科切除与重建.第二军医大学学报,2007,28(9):1032-1034.
[15] 徐万鹏,宋献文,乐守玉,等.骶骨肿瘤及其外科治疗(123例手术分析).中华骨科杂志,1994,14(2):67-71.
[16] Zang J,Guo W,Yang R,et al.Ⅰs total en bloc sacrectomy using a posterior-only approach feasible and safe for patients with malignant sacral tumors?J Neurosurg Spine,2015,22(6):563-570.
[17] Guo W,Tang X,Zang J,et al.One-stage total en bloc sacrectomy:a novel technique and report of 9 cases.Spine,2013,38(10):E626-E631.
[18] Li D,Guo W,Tang X,et al.Preservation of the contralateral sacral nerves during hemisacrectomy for sacral malignancies.Eur Spine J,2014,23(9):1933-1939.
[19] Niu XH,Yang YK,Chan CM,et al.Computer navigationaided resection of sacral chordomas.Chin Med J(Engl),2016,129(2):162.
[20] Mi C,Lu H,Liu H.Surgical excision of sacral tumors assisted by occluding the abdominal aorta with a balloon dilation catheter:a report of 3 cases.Spine,2005,30(20):E614-E616.
[21] Tang X,Guo W,Yang R,et al.Use of aortic balloon occlusion to decrease blood loss during sacral tumor resection.J Bone Joint SurgAm,2010,92(8):1747-1753.
[22] Chen K,Zhou M,Yang H,et al.Pre-operative embolization facilitating a posterior approach for the surgical resection of giant sacral neurogenic tumors.Oncol Lett,2013,6(1):251-255.
[23] Zhang L,Gong Q,Xiao H,et al.Control of blood loss during sacral surgery by aortic balloon occlusion.Anesth Analg,2007,105(3):700-703.
[24] 李鼎锋,崔秋,乐守玉,等.腹主动脉血流阻断技术在行骨盆、骶骨肿瘤切除中的临床评价.中国癌症杂志,2003,13(3):259-262.
[25] Huang L,Guo W,Yang R,et al.Proposed scoring system for evaluating neurologic deficit after sacral resection:functional outcomes of 170 consecutive patients.Spine,2016,41(7):628-637.
[26] 黎承军,流小舟,周光新,等.骶骨肿瘤骶神经根切除对男性勃起及射精功能影响的临床研究.中华男科学杂志,2015,21(3):251-255.
[27] 黄林,郭卫,杨荣利,等.164例骶骨原发肿瘤患者术后骶神经功能评价.骨科临床与研究杂志,2017,2(1):42-49.
[28] 孙馨,郭卫,杨荣利,等.骶骨肿瘤术后残留骶神经功能的评估.中国肿瘤临床与康复,2010,(2):111-114.
[29] Wei R,Guo W,Ji T,et al.One-step reconstruction with a 3D-printed,custom-made prosthesis after total en bloc sacrectomy:a technical note.Eur Spine J,2017,26(7):1902-1909.
[30] 杨墨松,肖建如,马俊明,等.TSRH-3D在高位骶骨肿瘤切除和腰椎骨盆稳定性重建中的作用.临床骨科杂志,2008,11(5):400-402.
[31] 李国东,蔡郑东,侯铁胜,等.ⅠSOLA脊柱内固定系统在高位骶骨肿瘤切除重建中的应用.中国矫形外科杂志,2008,16(17):1298-1302.
[32] 李众利,王继芳,王岩,等.异体骨重建骶骨肿瘤段切除后骨盆环.中国肿瘤临床,2002,29(6):423-425.
[33] 刘桂华,陈锦标,蔡宏华,等.脊柱通用钉棒系统重建骶骨肿瘤切除后腰骶关节功能及稳定性.遵义医学院学报,2016,39(1):66-69.
[34] 张余,柯晋,黄华扬,等.骶尾部肿瘤手术治疗的中远期评价.中国骨与关节杂志,2012,1(2):123-127.
[35] 范清宇,马保安.原发性骶骨肿瘤的外科治疗.中国脊柱脊髓杂志,1993,122(1):1-3.
[36] 陈晓亮,胡有谷,陈伯华,等.原发性骶骨肿瘤的手术治疗.中国脊柱脊髓杂志,1998,8(2):16-18.
[37] 于秀淳,刘晓平,宋若先,等.原发骶骨肿瘤手术治疗应注意的有关问题.中国骨肿瘤骨病,2007,6(5):257-261.
[38] 宋飞,马庆军,刘忠军,等.原发性骶骨肿瘤的手术治疗.中国脊柱脊髓杂志,2010,20(8):629-634.
[39] 杨兴海,肖建如,吴志鹏,等.En-bloc切除术治疗中低位骶骨肿瘤.中华外科杂志,2010,48(12):953-954.
[40] Yin X,Fan WL,Liu F,et al.Technique and surgical outcome of total resection of lower sacral tumor.Ⅰnt J Clin Exp Med,2015,8(2):2284-2288.
[41] Guo W,Ji T,Tang X,et al.Outcome of conservative surgery for giant cell tumor of the sacrum.Spine,2009,34(10):1025-1031.
[42] 范清宇,马保安,周勇,等.骶骨肿瘤的综合治疗.中华骨科杂志,2002,22(8):44-47.
[43] 叶招明,杨迪生,范顺武,等.原发性骶骨肿瘤的外科治疗.实用肿瘤杂志,1999,(4):233-234.
[44] 邵卫,戴尅戎,孙月华,等.原发性骶骨肿瘤的诊断和多学科综合治疗.临床骨科杂志,2004,7(2):121-126.
[45] 曹东,肖建如,马俊明,等.骶骨脊索瘤的临床特点及综合治疗.脊柱外科杂志,2007,5(6):350-353.
[46] Ji T,Guo W,Yang R,et al.What are the conditional survival and functional outcomes after surgical treatment of 115 patients with sacral chordoma?Clin Orthop Relat Res,2017,475(3):620-630.
[47] Yang Y,Niu X,Li Y,et al.Recurrence and survival factors analysis of 171 cases of sacral chordoma in a single institute.Euro Spine J,2017,26(7):1910-1916.
[48] 张清,牛晓辉,郝林,等.骶骨脊索瘤外科治疗长期随访.中国骨与关节杂志,2012,1(2):105-110.
[49] Chen KW,Yang HL,Lu J,et al.Prognostic factors of sacral chordoma after surgical therapy:a study of 36 patients.Spinal Cord,2010,48(2):166-171.
[50] 陈由芝,林道贤.骶骨脊索瘤的外科治疗及其效果(附2例报告).癌症,1988,(1):62-63.
[51] 周磊,孟通,杨兴海,等.骶骨脊索瘤的临床特点及预后因素分析.脊柱外科杂志,2015,13(5):280-284.
[52] Yang H,Zhu L,Ebraheim NA,et al.Analysis of risk factors for recurrence after the resection of sacral chordoma combined with embolization.Spine J,2009,9(12):972-980.
[53] Sun W,Ma XJ,Zhang F,et al.Surgical treatment of sacral neurogenic tumor:a 10-year experience with 64 Cases.Orthop Surg,2016,8(2):162-170.
[54] Wei G,Xiaodong T,Yi Y,et al.Strategy of surgical treatment of sacral neurogenic tumors.Spine,2009,34(23):2587-2592.
[55] 孙伟,马小军,张帆,等.骶骨神经源性肿瘤的外科治疗.中国骨与关节杂志,2012,1(2):115-118.
[56] 郭卫,臧杰,杨毅,等.骶骨巨大良性神经源性肿瘤的手术治疗策略.中国脊柱脊髓杂志,2016,26(10):865-869.
[57] 张新生,于世民.高位骶骨截除术治愈骶骨巨细胞瘤一例报告.吉林医学,1989,(4):245.
[58] 罗先正,赵治中.骶骨骨巨细胞瘤10例报道.中华外科杂志,1990,28(5):272-273.
[59] Ming Z,Kangwu C,Huilin Y,et al.Analysis of risk factors for recurrence of giant cell tumor of the sacrum and mobile spine combined with preoperative embolization.Turk Neurosurg,2013,23(5):645-652.
[60] 高博,蔡郑东,郑龙坡,等.原发性骶骨巨细胞瘤的切除与重建:22例分析.中国骨肿瘤骨病,2010,9(3):196-201.
[61] 郭卫,唐顺,燕太强,等.切刮术治疗骶骨骨巨细胞瘤的结果评价.中国脊柱脊髓杂志,2010,20(8):635-639.
[62] 李国东,蔡郑东,付东,等.骶骨骨巨细胞瘤的外科治疗.中华骨科杂志,2011,31(6):646-651.
[63] Li G,Fu D,Chen K,et al.Surgical strategy for the management of sacral giant cell tumors:a 32-case series.Spine J,2012,12(6):484-491.
[64] 杨荣利,郭卫,汤小东,等.骶骨骨巨细胞瘤的外科治疗.中国骨与关节杂志,2010,1(1):60-63.
[65] 于秀淳,刘晓平,付志厚,等.反复选择性动脉栓塞及刮除术治疗高位骶骨骨巨细胞瘤的远期疗效.中华肿瘤杂志,2013,35(3):233-235.
[66] 连鸿凯,刘继军,黄金承,等.手术治疗骶骨巨细胞瘤临床疗效的观察.中国矫形外科杂志,2014,22(11):1040-1044.
[67] 郭卫,杨毅,姬涛,等.骶骨骨巨细胞瘤的外科治疗方法及结果评价.中国骨与关节杂志,2016,5(1):9-13.
[68] Xu W,Wang Y,Wang J,et al.Long-term administration of bisphosphonate to reduce local recurrence of sacral giant cell tumor after nerve-sparing surgery.J Neurosurg Spine,2017,26(6):716-721.
[69] Ji T,Yang Y,Wang Y,et al.Combining of serial embolization and denosumab for large sacropelvic giant cell tumor:Case report of 3 cases.Medicine(Baltimore),2017,96(33):e7799.
[70] 杨毅,郭卫,杨荣利,等.地诺单抗治疗复发或难治骨巨细胞瘤疗效和安全性的初步观察.中国骨与关节杂志,2016,5(1):19-23.
[71] 李晓,郭卫,杨荣利,等.骶骨原发尤文肉瘤15例分析.中国骨与关节杂志,2014,3(2):100-104.
[72] 尉然,郭卫,杨荣利.整块切除与分块切除治疗骶骨软骨肉瘤的预后分析.中国脊柱脊髓杂志,2014,24(11):979-983.
[73] Wang Y,Guo W,Shen D,et al.Surgical treatment of primary osteosarcoma of the sacrum:a case series of 26 patients.Spine,2017,42(16):1207-1213.
[74] Du Z,Guo W,Yang R,et al.What is the value of surgical intervention for sacral metastases?PloS One,2016,11(12):e0168313.
[75] Zhang J,Wu CG,Gu YF,et al.Percutaneous sacroplasty for sacral metastatic tumors under fluoroscopic guidance only.Korean J Radiol,2008,9(6):572-576.
[76] Sun G,Jin P,Li M,et al.Three-dimensional C-arm computed tomography reformation combined with fluoroscopicguided sacroplasty for sacral metastases.Supportive Care in Cancer,2011,20(9):2083-2088.
[77] 冯飞,陈浩,贾璞,等.经皮骶骨成形术治疗骶骨转移瘤患者的临床疗效.实用骨科杂志,2017,23(8):728-732.
[78] 郭卫,汤小东,李大森,等.全骶骨切除术治疗骶骨多节段恶性肿瘤.中国脊柱脊髓杂志,2010,20(6):472-476.
[79] Zheng G,Xiao S,Zhang Y,et al.A case study using total en bloc sacrectomy and neuroanastomosis for sacral tumor.Eur Spine J,2014,23(9):1963-1967.
[80] 孙伟,陈泉池,马小军,等.单纯后路全骶骨切除治疗骶骨恶性肿瘤.中华骨科杂志,2014,34(11):1097-1102.
[81] 郭卫,李大森,孙馨,等.保留对侧骶神经孔的部分骶骨及骶髂关节整块切除术.中华骨科杂志,2012,32(11):1005-1009.
[82] 李立志,吕智.低位骶骨肿瘤的外科治疗.实用骨科杂志,2016,22(11):1028-1030.
[83] Tang X,Guo W,Yang R,et al.Risk factors for blood loss during sacral tumor resection.Clin Orthop Relat Res,2008,467(6):1599-1604.
[84] 陶松年,丁训诏,蔡青,等.原发性骶骨肿瘤的诊断和治疗体会(附11例手术治疗报告).江苏医药,1986,(6):305-307.
[85] 罗怀灿,赖传善,邵增务,等.暂时阻断腹主动脉行骶骨肿瘤切除术.中华实验外科杂志,1998,(4):380-381.
[86] 肖莉莉,张怡元,林焱斌,等.低位腹主动脉临时阻断技术在骶骨肿瘤手术中的应用(附23例分析).福建医药杂志,2008,30(4):20-22.
[87] 王飞,张元豫.低位腹主动脉间歇性阻断技术与控制性降压麻醉控制骶骨肿瘤手术失血.新疆医学,2009,39(9):22-26.
[88] 许建波,肖砚斌,孙洪瀑,等.低位腹主动脉阻断技术在高位骶骨肿瘤切除重建的研究.昆明医学院学报,2010,31(9):104-108.
[89] 张晋煜,许建波,袁涛,等.腹主动脉阻断联合内固定治疗高位骶骨肿瘤的临床观察.临床肿瘤学杂志,2011,16(8):732-735.
[90] 吴学建,陈书连,王利民,等.选择性动脉栓塞后骶骨肿瘤切除6例.河南医科大学学报,1998,(2):84-85.
[91] 杨惠林,倪才方,唐天驷,等.靶血管栓塞后手术治疗骶骨肿瘤.中华骨科杂志,1998,18(11):7-9.
[92] 纪方,孙庆斌,叶华,等.数字减影造影术介入后手术切除骶骨肿瘤.临床骨科杂志,2001,4(2):92-94.
[93] 李守强,徐微尘,李妹,等.术前动脉栓塞在骶骨肿瘤治疗中的价值.中国矫形外科杂志,2004,12(13):977-979.
[94] 王季,蔡郑东,朱晓东,等.术前DSA在骶骨肿瘤外科治疗中的应用价值.中国骨肿瘤骨病,2007,6(2):96-98.
[95] Yang HL,Chen KW,Wang GL,et al.Pre-operative transarterial embolization for treatment of primary sacral tumors.J Clin Neurosci,2010,17(10):1280-1285.
[96] 齐典文,扈文海,张国川,等.术前动脉栓塞在高位骶骨肿瘤手术中的疗效及并发症.中国骨与关节杂志,2013,2(11):606-609.
[97] 孔金海,肖辉,孙正望,等.骶骨肿瘤选择性靶血管栓塞后切口并发症的相关性因素分析.中国骨与关节杂志,2015,(10):795-798.
[98] 朱杰诚,镇万新,徐万鹏,等.球囊导管腹主动脉阻断在骶骨肿瘤术中的初步应用.中国骨肿瘤骨病,2003,2(3):133-136.
[99] 唐顺,董森,郭卫,等.腹主动脉球囊阻断控制骶骨肿瘤切除术中出血的效果.中国脊柱脊髓杂志,2009,19(2):85-89.
[100] Yang L,Chong-Qi T,Hai-Bo S,et al.Appling the abdomi nal aortic-balloon occluding combine with blood pressure sensor of dorsal artery of foot to control bleeding during the pelvic and sacrum tumors surgery.J Surg Oncol,2008,97(7):626-628.
[101] 马翔,张漾杰,王操,等.术中低位腹主动脉内球囊阻断术治疗骶骨肿瘤效果分析.中国矫形外科杂志,2016,24(9):851-854.
[102] 罗翼,段宏,黄斌,等.超长时间腹主动脉内球囊阻断技术在骨盆及骶骨肿瘤切除术中的应用.中国循证医学杂志,2015,(8):878-882.
[103] 孔金海,肖辉,孙正望,等.两种阻断方式对骶骨肿瘤切除术后伤口影响的比较.脊柱外科杂志,2015,13(1):37-40.
[104] 范胜利,杨惠林,徐华中,等.骶骨肿瘤骶神经切除后肛门直肠及膀胱排便功能的观察.中国肿瘤临床,2005,32(8):466-468.
[105] 朱烨,叶招明,杨迪生,等.原发性骶骨肿瘤的手术切除与术后神经功能评价(附48例报告).实用肿瘤杂志,2009,24(5):466-468.
[106] 颉强,王臻,王岭,等.脊柱通用钉棒系统在骶骨肿瘤切除重建中的初步应用.中国修复重建外科杂志,2003,17(1):13-15.
[107] 肖建如,贾连顺,陈华江,等.高位骶骨肿瘤切除与重建方式探讨.中华外科杂志,2003,41(8):575-577.
[108] 田纪伟,王雷,董双海,等.腰椎骨盆重建内固定术在骶骨肿瘤切除后的应用.中国矫形外科杂志,2007,15(23):1798-1800.
[109] 吴强,邵增务,杨述华,等.高位骶骨肿瘤切除后的外科重建策略.中国骨与关节杂志,2013,2(10):580-583.
[110] 丁焕文,贾军锋,沈健坚,等.计算机辅助下高位骶骨肿瘤的精确切除与缺损部位的重建.中国骨与关节杂志,2013,2(9):484-489.
[111] 高嵩涛,蔡启卿,姚伟涛,等.骶骨肿瘤切除术后脑脊液漏临床分析.中国实用神经疾病杂志,2011,14(23):15-17.
[112] 熊燕,杨红胜,屠重棋,等.持续腰椎穿刺引流治疗高位骶骨肿瘤术后脑脊液漏.中国骨与关节杂志,2013,2(11):610-613.
[113] 俞猛,徐万鹏,张林,等.骶骨肿瘤术后切口并发症的相关因素分析.中国骨肿瘤骨病,2009,8(6):321-323.
[114] 李国东,蔡郑东,傅强,等.骶骨肿瘤术后常见并发症的临床分析与防治.中国骨肿瘤骨病,2006,5(5):257-261.
[115] 孙伟,张帆,马小军,等.骶骨肿瘤手术并发症及处理(附78例病例报道).中国骨与关节杂志,2012,1(4):344-348.
[116] 曲华毅,郭卫,杨荣利.骶骨肿瘤伤口相关并发症的危险因素分析与对策.中国矫形外科杂志,2010,18(3):212-215.
[117] Li D,Guo W,Qu H,et al.Experience with wound complications after surgery for sacral tumors.Eur Spine J,2013,22(9):2069-2076.
[118] Chen KW,Yang HL,Lu J,et al.Risk factors for postoperative wound infections of sacral chordoma after surgical excision.J Spinal Disord Tech,2011,24(4):230-234.
