沉默lncRNA PVT1对鼻咽癌细胞C666-1增殖、侵袭转移的影响
2018-06-01万仁强林勇肖平龚平桂
万仁强 林勇 肖平 龚平桂
1广东省第二人民医院耳鼻咽喉头颈外科(广州510317);2喀什地区第一人民医院耳鼻咽喉科(新疆喀什844000)
长链非编码 RNA(long noncoding RNA,lncRNA)是一类长度大于200个核苷酸,不具有蛋白质编码功能的RNA分子。研究表明lncRNA与基因表达、胚胎发育、物质代谢等有着密切的联系,因此被称为基因组学的富矿。近年来大量研究[1-2]表明lncRNA在多种疾病中扮演了重要的角色,并且作为调节因子通过多种途径参与细胞增殖、分化、凋亡、药物抵抗、上皮间质转化等[3-6]。
变异性浆细胞瘤异位1(plasmacytoma variant translocation 1,PVT1)是最近被发现的一种特异性的lncRNA,全长1 716 bp,位于人类染色体8q24,原癌基因MYC下游,其转录产物属于基因间的lncRNA[7]。近年来研究[8-11]表明,PVT1 在多种肿瘤中高表达,例如肝癌、胃癌、结直肠癌、非小细胞肺癌等,并且与预后相关。然而,目前国内外关于PVT1在鼻咽癌中的研究还比较少,因此本研究通过检测PVT1在鼻咽癌细胞中的表达,利用siRNA干扰技术研究降低PVT1后对鼻咽癌细胞增殖、迁移侵袭的影响,为进一步研究PVT1在鼻咽癌发生发展过程中的作用机制提供初步的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞株鼻咽癌细胞5-8F、C666-1、CNE-1、6-10B、CNE-2、HNE-1、HONE-1及鼻咽永生化上皮细胞NP69购自中科院上海细胞库。
1.1.2 主要试剂RNA提取试剂盒Rneasy MiNi Kit购自美国Qiagen公司;逆转录试剂盒iScript cDNA synthesis kit购自美国Bio-Rad公司;荧光定量PCR试剂盒SYBR®Premix Ex TaqTM购自TakaRa公司;Keratinocyte-SFM培养基、RPMI-1640培养基、胎牛血清、0.25%胰蛋白酶购自美国Gibco公司;LipofectamineTM2000转染试剂购自美国Invitrogen公司;噻唑蓝(MTT)购自上海碧云天公司;Traswell小室、细胞培养瓶、细胞培养板购自Corning公司。
1.2 方法
1.2.1 细胞培养人鼻咽永生化上皮细胞NP69接种于含10%胎牛血清的新鲜Keratinocyte-SFM中培养。人鼻咽癌细胞5-8F、C666-1、CNE-1、6-10B、CNE-2、HNE-1及HONE-1接种于含10%胎牛血清的RPMI-1640培养基中,培养基加青霉素与链霉素,两抗生素最终浓度分别为100 U/L及100 mg/L,置于37℃、饱和湿度、5%CO2的培养箱中培养。
1.2.2 荧光定量PCR检测PVT1的表达按照RNA提取试剂盒提取鼻咽癌细胞及NP69细胞中总RNA,测定浓度,-80℃保存。采用SYBR Green法检测PVT1的相对表达,反应条件:95℃15 min,95℃30 s,60℃60 s,共40个循环,最后72℃延伸10 min。siPVT1 F:5′-GCUUCUCCUGUUGCUGCUATT-3′;R:5′-UAGCAGCAACGGAGAAGCTT-3′;siNC F:5′-UUCUCCGAACGUGUGUCACGUTT-3′;R:ACGUGACACGUUCGGAGAATT-3′;PVT1 上游引物5′-GTCTTGGTGCTCTGTGTTC-3′,下游引物5′-CCCGTTATTCTGTCCTTCT-3′;GAPDH上游引物5′-CGCTGAGTACGTCGTGGAGTC-3′,下游引物 5′-GCTGATGATCTYGAGGCTGTGTTGTC-3′。
1.2.3 细胞转染及RT-PCR检测运用LipfectamineTM2000转染试剂盒转染siPVT1及对照siRNA,分别于24及48 h后收集细胞,提取总RNA并逆转录为cDNA,RT-PCR检测PVT1的表达。PVT1干扰RNA(siPVT1)及阴性对照(siNC)序列由吉玛公司合成提供;siPVT1上游序列:5′-GCUUCUCCUGUUGCUGCATT-3′,下游序列:5′-UAGCAGCAACAGGAGAAGCTT-3′;siNC上游序列:5′-GCUACGAUCUGCCCAAGAUTT-3′,下游序列:5′-AUCUUAGGCAFGAUCGUCGCTT-3′。
1.2.4 MTT比色实验将对数期生长的siPVT1/C666-1细胞按1×103个/孔接种至96孔板内,重复5孔。常规培养24、48、72 h后,弃培养基,每孔加入20 μL的MTT(5 mg/mL),继续培养 4 h后,加入150 μL DMSO溶解,酶标仪570 nm处检测各孔OD值,取平均值绘制细胞增殖曲线。
1.2.5 Transwell细胞迁移与侵袭实验将细胞制成单细胞悬液并用无血清培养基漂洗3遍,细胞计数。在Boyden小室上室加入(或不加)200 μL稀释的Matrigel胶,过夜干燥。在Transwell小室上室接种1× 105个细胞(200 μL),在小室的下室加入300 μL含10%胎牛血清的RPMI-1640培养基作为趋化因子。37℃、5%CO2培养箱培养24 h,取出小室,PBS浸泡洗涤2次。95%乙醇浸泡固定Transwell上室穿膜细胞,PBS洗涤2次,以新鲜配制的苏木素染液,浸染3~5 min,然后用棉签擦除上室中未通过滤膜的细胞,显微镜下观察拍照、计数。
1.2.6 Western blot检测EMT标记物的表达转染后24 h收集细胞,RIPA裂解液裂解细胞提取总蛋白,BCA法测定蛋白质浓度。10%SDS-PAGE胶电泳分离蛋白质,转膜,用5%脱脂奶粉室温封闭1 h,一抗(N-cadherin、Vimentin、E-cadherin、β-actin抗体1∶2 000稀释)4℃过夜孵育,TBST洗膜3次,每次7 min,二抗(抗兔1∶3 000稀释)室温孵育1 h,TBST洗膜3次,每次7 min,暗室加入ECL发光液后曝光显影。
1.3 统计学方法应用SPSS 20.0统计软件分析。计量资料以均数±标准差表示,采用两样本t检验统计学方法,P<0.05为差异有统计学意义。
2 结果
2.1 PVT1在人鼻咽癌细胞中的表达实时定量PCR检测PVT1在鼻咽癌细胞CNE-1、CNE-2、5-8F、C666-1、HNE-1、6-10B及HONE-1中的表达。结果显示,与NP69细胞相比,PVT1在鼻咽癌细胞中表达上调,差异均具有统计学意义(P<0.05),见图1。
2.2 转染siPVT1后PVT1的表达实时定量PCR结果显示,C666-1细胞转染siPVT1后PVT1的相对表达量显著降低,见图2。
2.3 细胞增殖率检测MTT结果显示,转染siPVT1 24 h后实验组细胞的OD值为(0.34±0.05),对照组细胞的OD值为(0.59±0.06),经两独立样本t检验差异具有统计学意义(P<0.05)。转染48、72 h后,实验组细胞的OD值分别为(0.53± 0.04)、(1.15± 0.12),对照组细胞的OD值为(0.90±0.09)、(1.67±0.13),差异均具有统计学意义(P<0.05),见图3。
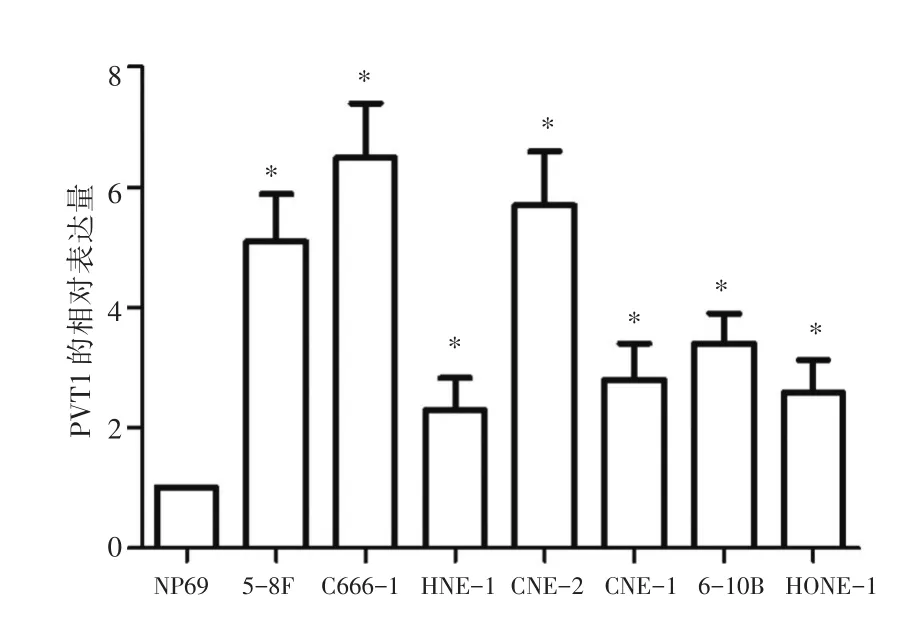
图1 PVT1在人鼻咽癌细胞中的表达Fig.1 Expression of PVT1 in human nasopharyngeal carcinoma cells
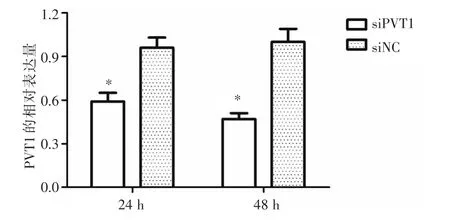
图2 转染siPVT1后C666-1细胞中PVT1的表达Fig.2 Expression of PVT1 in C666-1 cells after transfection of siPVT1
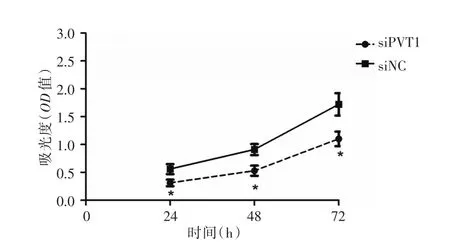
图3 siPVT1能抑制鼻咽癌细胞生长Fig.3 SiPVT1 can inhibit the growth of nasopharyngeal carcinoma cells
2.4 下调PVT1对C666-1迁移、侵袭能力的影响Transwell迁移实验显示(图4A),siPVT1组细胞穿膜数为(54±6.3)个,siNC组的细胞穿膜数为(110±8.9)个,差异具有统计学意义(P<0.05)。侵袭实验(图4B)结果示:siPVT1组细胞穿膜数为(41±5.8)个,siNC组的细胞穿膜数为(72±7.3)个,差异具有统计学意义(P<0.05)。表明下调PVT1后可抑制鼻咽癌细胞C666-1的迁移及侵袭。
2.5 下调PVT1对鼻咽癌细胞EMT的影响荧光定量RT-PCR和Western blot结果显示,下调PVT1可升高鼻咽癌细胞E-cadherin的表达,降低N-cadherin和Vimentin的表达,见图5。
3 讨论
鼻咽癌是我国南方及东南亚地区常见的一种恶性肿瘤,其分布具有明显的地域性和种族性。放疗是治疗鼻咽癌的主要方法,目前放疗同步化疗是鼻咽癌的标准治疗方法[12]。然而经过标准治疗后仍有约20%~30%鼻咽癌患者出现局部复发或者远处转移[13]。出现远处转移后缺乏有效的治疗手段,这也是造成鼻咽癌患者死亡的最主要原因。因此,寻找鼻咽癌发病机制中的关键分子作为有效的治疗靶点,对于治疗及预防鼻咽癌细胞转移、延长患者的生存期和提高生存质量具有非常重要的意义。
lncRNA PVT1位于原癌基因MYC下游,已被证明与多种肿瘤的发生、发展密切相关,具有癌基因的作用;有报道称,MYC与PVT1一同扩增,形成“伙伴”关系,PVT1可帮助增强MYC蛋白的致癌作用[7];另一研究[14]表明,在乳腺癌中PVT1和MYC可协同作用调控RSPO1的表达,增加乳腺癌癌变前的特性,促进癌症形成。高表达的PVT1与前列腺癌的级别相关,并且导致前列腺癌的激素抵抗[15],降低PVT1的表达可抑制多种肿瘤细胞增殖、迁移等[16-17]。
本研究首先利用荧光定量RT-PCR检测鼻咽癌细胞中PVT1的表达,检测结果显示5-8F、C666-1、CNE-1、6-10B、CNE-2、HNE-1及HONE-1等多种人鼻咽癌细胞中PVT1的表达均较对照组增高,但瘤细胞各组间也有一定的差异,考虑可能跟不同的鼻咽癌细胞生物学特性有关,如生长增殖及迁徙等能力,另外,不同组细胞经过多次不同传代培养后生物学特性发生改变,从而造成不同组人鼻咽癌细胞中PVT1的表达存在差异;然后,利用RNA干扰技术,设计合成PVT1-siRNA,将此siRNA序列与对照siRNA转染C666-1细胞,采用实时定量RT-PCR检测沉默效果,发现转染24及48 h后,PVT1表达显著下降。采用MTT法检测沉默PVT1对细胞增殖的影响,结果显示,沉默PVT1可显著抑制C666-1细胞增殖。Transwell迁移及侵袭实验显示,沉默PVT1后C666-1细胞的透膜细胞数少于阴性对照组,证实PVT1具有促进鼻咽癌细胞迁移及侵袭的能力。

图4 Transwell细胞迁移与侵袭实Fig.4 Transwell cell migration and invasion experiment
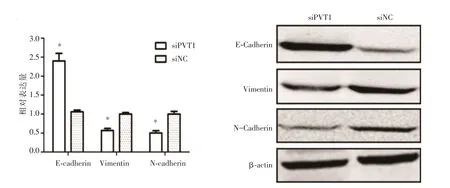
图5 下调PVT1逆转鼻咽癌细胞EMTFig.5 Down regulation of PVT1 to reverse nasopharyngeal carcinoma cell EMT
上皮间质转化(EMT)现象与肿瘤的浸润转移密切相关。在此过程中上皮细胞的极性丧失,与周围细胞和基质接触减少,迁移和运动能力增强,同时上皮表型丢失而逐渐获得间质表型。EMT的特征性改变为其上皮标志物表达量下降(如E钙黏素、角丝蛋白),而间质标志物表达量升高(如N钙黏素、波形蛋白等),同时EMT转录相关因子表达量也增加(如snail)。为研究沉默PVT1是否能抑制EMT,本研究检测了E-cadherin、N-cadherin和Vimentin的表达,结果显示,下调PVT1可升高鼻咽癌细胞E-cadherin的表达,降低N-cadherin和Vimentin的表达,提示下调PVT1表达对鼻咽癌细胞EMT有逆转作用,研究结果与文献报道一致[17-18]。
综上所述,PVT1在鼻咽癌细胞的增殖和侵袭转移过程中起着重要的作用,提示PVT1有可能是与鼻咽癌形成和进展相关的一个重要基因,本研究的完成为鼻咽癌的治疗提供了一个新的潜在的治疗靶点。
[1]LIU J Y,YAO J,LI X M,et al.Pathogenic role of lncRNAMALAT1 in endothelial cell dysfunction in diabetes mellitus[J].Cell Death Dis,2014,5:e1506.
[2]OUNZAIN S,PEZZUTO I,MICHELETTI R,et al.Pedrazzini functional importance of cardiac enhancer-associated noncoding RNAs in heart development and disease[J].Mol Cell Cardiol,2014,76:55-70.
[3]XU T P,HUANG M D,XIA R,et al.Decreased expression of the long non-coding RNA FENDRR is associated with poor prognosis in gastric cancer and FENDRR regulates gastric cancer cell metastasis by affecting fibronectin expression[J].Hematol Oncol,2014,7:63.
[4]VIKRAM R,RAMACHANDRAN R,ABDUL K S.Functional significance of long noncoding RNAs in breast cancer[J].Breast Cancer,2014,21(5):515-521.
[5]CHENG N,LI X,ZHAO C,et al.Microarray expression profile of long non-coding RNAs in EGFR-TKIs resistance of human nonsmall cell lung cancer[J].Oncol Rep,2015,33(2):833-839.
[6]TONG Y S,WANG X W,ZHOU X L,et al.Identification of the long non-coding RNA POU3F3 in plasma as a novel biomarker for diagnosis of esophageal squamous cell carcinoma[J].Mol Cancer,2015,14:3.
[7]TSENG Y Y,MORIARITY B S,GONG W,et al.PVT1 dependence in cancer with MYC copy-number increase[J].Nature,2014,512(7512):82-86.
[8]DING C,RANG Z,LV Z,et al.Long non-coding RNA PVT1 is associated with tumor progression and predicts recurrence in hepatocellular carcinoma patients[J].Oncol Lett,2015,9(2):955-963.
[9]KONG R,ZHANG E B,YIN D D,et al.Long noncoding RNA PVTI indicates a poor prognosis of gastric cancer and promotes cell proliferation through epigenetically regulating p15 and p16[J].Mol Cancer,2015,14:82-95.
[10]YANG Y R,ZANG S Z,ZHONG C L,et al.Increased expression of the lncRNA PVT1 promotes tumorigenesis in non-small cell lung cancer[J].Int J Clin Exp Pathol,2014,7(10):6929-6935.
[11]TAKAHASHI Y,SAWADA G,KURASHIGE J,et al.Amplification of PVT1 is involved in poor prognosis via apoptosis inhibition in colorectal cancers[J].Br J Cancer,2014,110(1):164-171.
[12]LIU J Y,YAO J,LI X M,et al.Pathogenic role of lncRNAMALAT1 in endothelial cell dysfunction in diabetes mellitus[J].Cell Death Dis,2014,5:e1506.
[13]OUNZAIN S,PEZZUTO I,MICHELETTI R,et al.Pedrazzini functional importance of cardiac enhancer-associated noncoding RNAs in heart development and disease[J].Mol Cell Cardiol,2014,76:55-70.
[14]SARVER A L,MURRAY C D,TEMIZ N A,et al.MYC and PVT1 synergize to regulate RSPO1 levels in breast cancer[J].Cell Cycle,2016,15(7):881-885.
[15]MEYER K B,MAIA A T,O'REILLY M,et al.A functional variant at a prostate cancer predisposition locus at 8q24 is associated with PVT1 expression[J].PLoS Genet,2011,7(7):e1002165.
[16]郑婵丽,刘革俢,陈盛亭,等.长链非编码RNA PVT1沉默对K562细胞增殖的影响[J].广东医学,2017,38(10):1473-1476.
[17]张行行,赵义,王珏,等.下调长链非编码RNA PVT1表达对胰腺癌BxPC-3细胞凋亡、侵袭及转移的影响[J].基础医学与临床,2016,36(1):73-79.
[18]ZHENG X,HU H,LI S.High expression of lncRNA PVT1 promotes invasion by inducing epithelialto-mesenchymal transition in esophageal cancer[J].Oncol Lett,2016,12(4):2357-2362.
