重庆地区山羊痘病毒分离鉴定及其动物模型构建
2018-06-01丁玉春张成刚
丁玉春,林 玲,罗 林,张成刚,吴 梦
(重庆市畜牧科学院,重庆 402460)
山羊痘是由山羊痘病毒引起的一种急性、热性、高度接触性传染病,病原为痘病毒科、脊椎动物痘病毒亚科、山羊痘病毒属,是一种大型病毒[1-3]。山羊痘又称“羊天花”,可感染多个年龄段、不同品种的山羊,多发于羔羊,无明显季节性,但冬末春初最易流行[4]。感染该病毒后羊只多见全身性的丘疹、结节或水泡,并伴随内脏性病变,严重者出现死亡,给养殖业造成巨大的经济损失[5-6]。整个病程经丘疹、水泡和结痂一般可持续3~4周,病羊痊愈后可以获得终身免疫[7]。山羊痘对宿主具有一定的特异性,自然感染多发生于山羊,其特异性与毒株自身特性密切相关,仅有少量毒株使绵羊发病,偶尔感染人[8-9]。
目前,羊痘疫苗多为弱毒苗,由于国内疫苗产品质量参差不齐,弱毒苗常出现返强,导致羊只发病,严重者造成疫病的流行[10-13]。并且,山羊痘病毒地区差异性较大,疫苗产品在不同地区的应用效果各有差异[11],因此,对山羊痘病毒新毒株的研究十分必要,尤其对地方毒株的研究更加重要。笔者等对重庆地区山羊痘病毒进行了分离鉴定,并构建了动物模型,为羊痘致病机理的研究奠定了基础,也为羊痘疫苗新产品的研发提供了依据。
1 材料与方法
1.1 试剂
病毒DNA提取试剂盒、DNA胶回收试剂盒、DL 2000 DNA Marker、2×Taq PCR Master Mix 均 购 自Solarbio公司;依据NCBI中公布的山羊痘病毒P32基因设计特异性引物F1/F2,序列由上海生工生物工程有限公司合成,引物序列信息见表1。
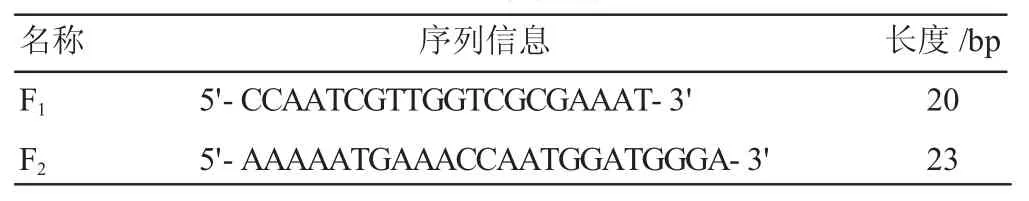
表1 引物序列信息
1.2 病料及实验动物
病料及实验动物均由重庆市荣昌区某羊场提供。
1.3 方法
1.3.1 病料的处理 对疑似山羊痘感染羊只进行临床诊断,采集病变部位丘疹或痂皮,按1∶5的比例加入含有双抗的PBS溶液,用研钵研磨,收集研磨液,反复冻融3次后,3 000 r/min离心30 min,将上清经0.45 μm滤器过滤,收集滤液,-20℃保存备用。
1.3.2 P32基因序列PCR鉴定及测序分析 参照病毒DNA提取试剂盒说明书,提取1.3.1中收集的样本DNA。利用特异性引物F1/F2进行羊痘病毒P32基因序列的PCR扩增。PCR反应体系:2×Taq PCR Master Mix 25 μL,引物 F1/F2各 0.5 μL,模板 5 μL,ddH2O 19 μL。PCR反应条件:94℃预变性2 min;95℃变性45 s,58℃退火 45 s,72℃延伸 45 s,30个循环,72℃延伸 10 min。反应结束后,进行1%琼脂糖凝胶电泳鉴定,PCR产物经DNA胶回收试剂盒回收后,送往生工生物工程(上海)股份有限公司进行测序分析。
1.3.3 遗传进化分析 将测序结果在NCBI中进行BLAST比对,分析其与羊痘病毒P32基因的同源性,利用N-J法将分离株序列与其相关性较好的序列进行比对,借助MEGA5.软件构建系统进化发育树。
1.3.4 病毒的纯化培养
1.3.4.1 病毒细胞培养 将鉴定为阳性的病料研磨液接种单层BHK21细胞,接毒量与维持液的比例为1∶10,置于37℃、5%CO2培养箱中培养,观察记录细胞病变情况。若细胞在接种病料后5 d内未出现病变则连续盲传3代,若第5代仍未出现病变则视为阴性,出现病变的反复冻融3次后收毒,置-80℃保存。
1.3.4.2 病毒TCID50测定 将BHK21在96孔板中培养,待细胞长成单层时,将病毒液按照10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10浓度连续 10 倍稀释后,接种于96孔板细胞培养板,每一稀释浓度接种一列,第11、12列作为细胞空白对照,每孔接种100 μL,37℃、5%CO2培养箱中培养,每天观察细胞产生病变孔数,记录结果,根据Reed-Muench氏法计算病毒TCID50值。
1.3.5 动物模型的构建 选取未免疫山羊痘疫苗的3月龄健康羔羊2只,用皮下划痕和多点皮内注射法,将山羊痘病毒接种健康羔羊1只,接种量为0.5 mL,另外1只羔羊接种生理盐水作为对照组,均正常饲喂,逐日观察记录羔羊发病情况,同时记录羔羊体重、体温(直肠温度)变化。
2 结果与分析
2.1 山羊痘病毒PCR鉴定及测序结果
PCR鉴定结果表明,在约800 bp的位置出现特异性条带(见图 1),经测序,其大小为 815 bp(见图 2),与预期结果一致。

图1 山羊痘病毒P32基因PCR鉴定结果
2.2 进化树
将所得基因序列在NCBI中进行BLAST比对后,发现其与山羊痘病毒(登录号AY881707.1)P32基因序列同源性最高(99%),在系统进化发育树中也与其聚为一簇。结果见图3。

图2 山羊痘病毒P32基因测序结果

图3 基于山羊痘病毒P32基因序列构建的系统进化发育树(Isolate strain为分离株序列)
2.3 山羊痘病毒细胞培养
病毒接种BHK21细胞盲传至F4代时,细胞开始出现病变,培养至48 h时,细胞出现拉丝结网、固缩变圆和脱落的现象,72 h时出现空斑,结果见图4~6。对稳定传代的病毒进行TCID50检测,结果为1×10-4.5/mL。
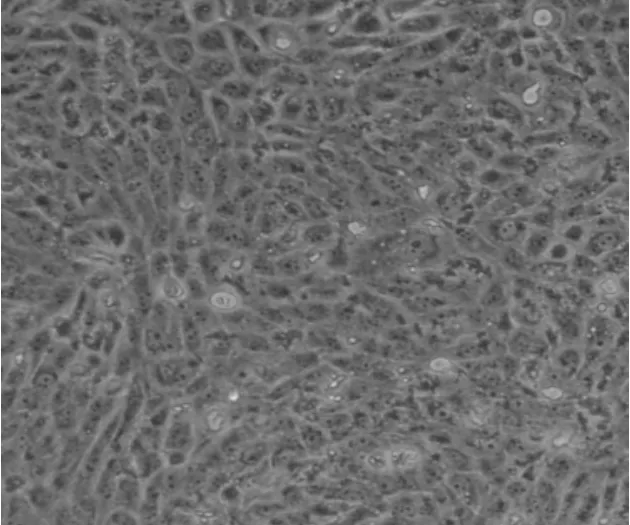
图4 正常BHK21细胞形态

图5 接毒山羊痘病毒48 h BHK21细胞形态
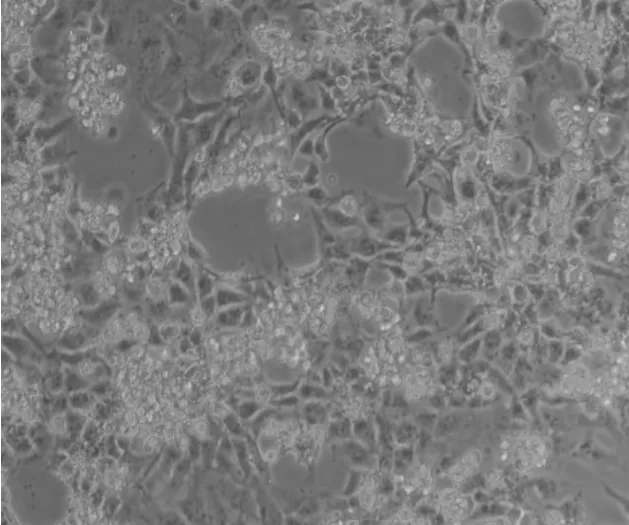
图6 接毒山羊痘病毒72 h BHK21细胞形态
2.4 动物模型
2.4.1 发病情况 通过对羔羊人工感染山羊痘病毒发现,羔羊在接毒10 d后,唇部和尾根部出现红色丘疹和水泡(见图7~8),食欲开始减退,精神不振,出现羊痘初期症状,第15天形成痂皮,进入结痂期,第28天结痂开始脱落,第35天时,羔羊病情好转。整个病程中,羔羊体重变化差异不大,未出现死亡。
2.4.2 体温变化 通过对攻毒后羔羊直肠温度进行检测发现,接种部位划痕在第4天愈合,第7天开始出现体温升高,第16天达到最高(42℃),第26天时体温趋于正常,体温变化见图9。

图7 人工感染山羊痘病毒羔羊唇部初期症状
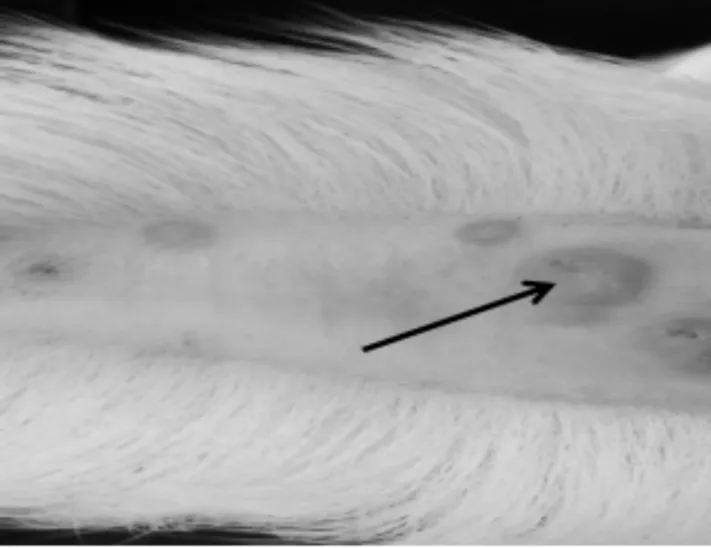
图8 人工感染山羊痘病毒羔羊尾根部初期症状
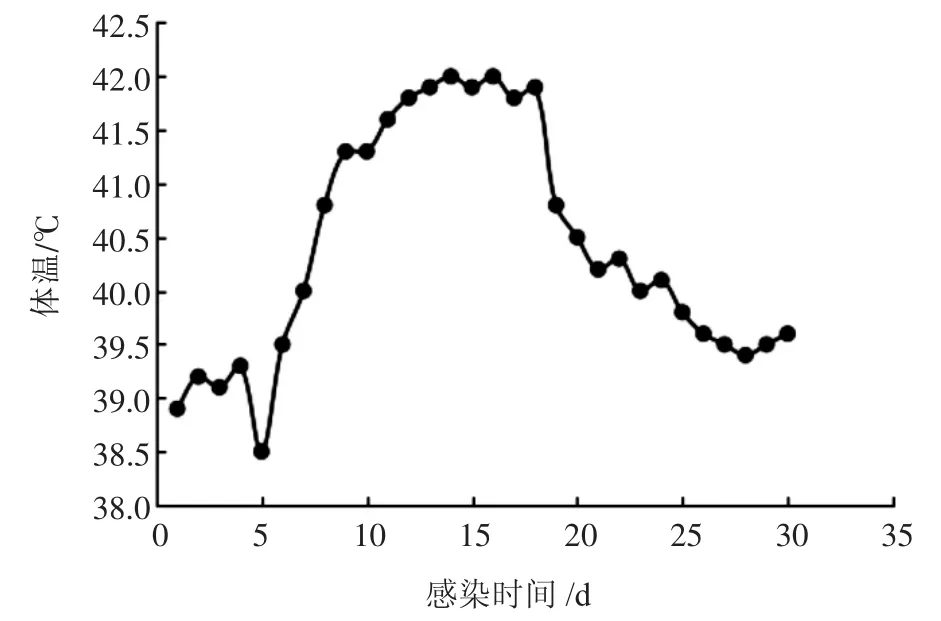
图9 人工感染山羊痘病毒羔羊体温变化
3 讨论
本研究应用临床诊断、分子鉴定、细胞培养、遗传进化分析和构建动物模型等方法,分离到一株重庆地区山羊痘病毒,并对其细胞培养特性和致病性进行了初步研究,结果表明,分离纯化到的山羊痘病毒可以在BHK21细胞中稳定增殖,并出现典型的细胞病变,这为该病毒的进一步研究奠定了基础。研究表明,不同山羊痘病毒在攻毒家兔、豚鼠和鸡胚时,表现出的症状各有差异,仅有部分毒株可以使家兔和豚鼠形成局部痘斑,少数毒株可以在鸡胚尿囊膜上出现典型的痘斑[14-16],说明不同的山羊痘病毒存在较大差异,也表明本研究的必要性。将山羊痘病毒接种3月龄健康羔羊后,羔羊在攻毒第7天时,开始出现体温升高、精神不振等症状,在第16天时体温达到42℃;攻毒第10天,羔羊表现出山羊痘的初期症状,第35天时病情好转,整个病程中,羔羊体重变化差异不大。通过动物模型的构建,发现羔羊未出现皮肤全身性的病理变化,也未出现死亡。目前,关于山羊痘重庆地区分离株的报道相对较少,本研究为山羊痘地方株疫苗的研究奠定了基础,也为重庆地区山羊痘的防控提供了理论依据。
[1]安维雪,庞方圆,王艳杰,等.羊痘病毒实时荧光定量PCR检测方法的建立[J].中国兽医学报,2016,36(4):572-578.
[2]Zhao Z,Wu G,Yan X,et al.Development of duplex PCR for differential detection of goatpox and sheeppox viruses [J].BMC Veterinary Research,2017,13(1):278-283.
[3]Yang Y,Qin X,Zhang X,et al.Development of real-time and lateral flow dipstick recombinase polymerase amplification assays for rapid detection of goatpox virus and sheeppox virus [J].Virology Journal,2017,14(1):131-137.
[4]Tulman E R,Afonso C L,Lu Z,et al.The genomes of sheeppox and goatpox viruses[J].Journal of Virology,2002,76(12):6054-6062.
[5]赵志荀,吴国华,颜新敏,等.羊痘病毒及其疫苗研究进展[J].动物医学进展,2010,31(4):77-81.
[6]Hosamani M,Bhanuprakash V,Kallesh D J,et al.Cell culture adapted sheeppox virus as a challenge virus for potency testing of sheeppox vaccine[J].Indian Journal of Experimental Biology,2008,46(10):685-689.
[7]颜新敏,张强.羊痘病毒免疫学研究进展[J].动物医学进展,2009,30(12):67-70.
[8]Stanford MM,Mcfadden G,Karupiah G,et al.Immunopathogenesis of poxvirus infections:forecasting the impending storm[J].Immunology&Cell Biology,2007,85(2):93-102.
[9]Liu S W,Katsafanas G C,Liu R,et al.Poxvirus decapping enzymes enhance virulence by preventing the accumulation of dsRNA and the induction of innate antiviral responses [J].Cell Host&Microbe,2015,17(3):320-326.
[10]Zhou T,Jia H,Chen G,et al.Phylogenetic analysis of Chinese sheeppoxand goatpoxvirus isolates[J].VirologyJournal,2012,9(1):1-8.
[11]颜新敏,吴国华,李健,等.羊痘在中国的流行现状分析[J].中国农学通报,2010,26(24):6-9.
[12]Hosamani M,Nandi S,Mondal B,et al.A Vero cell-attenuated goatpox virus provides protection against virulent virus challenge[J].Acta Virologica,2004,48(1):15-19.
[13]Wang W J,Yin S J,Guo R Q.Corrigendum PKR and HMGB1 expression and function in rheumatoid arthritis[J].Genetics&Molecular Research Gmr,2016,15(2):17864-17870.
[14]何亚鹏,张琪,史怀平,等.绵羊痘病毒、山羊痘病毒及羊口疮病毒多重PCR检测方法的建立和应用[J].动物医学进展,2017,38(3):11-15.
[15]郝宝成,梁剑平,王学红,等.山羊痘的流行及防治措施[J].中国畜牧兽医,2011,38(5):152-154.
[16]颜新敏,张强,吴国华,等.两种用于鉴别山羊痘病毒和绵羊痘病毒方法的应用与比较研究[J].华北农学报,2009,24(6):50-53.
