锐钛矿TiO2纳米球的低温微波法制备及其光催化性能
2018-05-31张彩云邢彦军
张彩云,王 芳,李 戎,邢彦军
(1. 东华大学 a.化学化工与生物工程学院;b. 国家染整技术工程研究中心,上海201620;2. 南华大学 化学化工学院,湖南 衡阳 421001)
作为一种新型氧化技术,半导体光催化引起了人们的关注[1-2]。光催化反应中产生的强氧化性羟基自由基(·OH),可将难以降解的有机污染物分解为二氧化碳和水,因此被广泛应用于有机污水处理。在各种半导体光催化剂中,二氧化钛(TiO2)因其无毒、化学性质稳定、催化活性高、价格低廉等优点,成为研究最多的光催化半导体材料之一。
锐钛矿型TiO2因其优良的光催化性能而被广泛应用,其制备通常采用400 ℃以上的高温煅烧。高温虽然可促进TiO2由非晶态向锐钛矿晶体的转变,但也可能会向周围环境中排放CO2(来源于溶胶中的有机溶剂和钛醇盐等)等污染环境的副产物[3-4]。高温(低于250 ℃)水热法虽然也可以制备锐钛矿型TiO2,然而需要密闭的环境,对设备要求较高[5]。
传统的液相沉积法所需要的时间较长(从几小时到几天不等),TiO2结晶度不高且所需前驱体的浓度也较高。微波加热可实现分子水平加热,加热均匀、快速且温度梯度小,可对混合组分进行选择性加热,可以有效地缩短反应时间,并且很多反应在前驱体浓度很低的情况下也可以发生[6]。然而,由于大多数的微波反应都是在高压釜中或消解罐中进行的高温反应[7-8],体系具有较高的压力,对设备要求高,且操作比较危险,近年来的研究成果不是太多。低温常压下微波辅助法的操作更为安全,且对反应器皿没有要求,再加上微波加热所具有的优点,这种方法已显示出十分诱人的发展前景和广阔的发展潜力[9-11]。
本文以六氟钛酸铵为钛源和硼酸为硼源,在低于100 ℃的开放体系下,微波辅助制备得到粒径均一的锐钛矿型TiO2纳米微球,并研究其对罗丹明B的光降解催化性能。
1 试验部分
1.1 试剂与仪器
六氟钛酸铵((NH4)2TiF6,分析纯)由上海仕梵化学有限公司提供;硼酸(H3BO3,分析纯)由国药集团化学试剂有限公司提供;罗丹明B(分析纯)由上海晶纯试剂有限公司提供。
MAS-3普及型微波合成反应仪,上海新仪微波化学科技有限公司;BL-GHX-V型光化学反应仪,上海比朗仪器有限公司;D/max 2550 PC型X射线衍射仪,日本Rigaku公司;S-4800型场发射扫描电子显微镜,日本Hitachi公司;JEM-2100F型场发射透射电子显微镜,日本JEOL公司。
1.2 微波法制备TiO2纳米球
将0.02 mol/L的(NH4)2TiF6和0.04 mol/L的H3BO3混合配制成100 mL溶液,在90 ℃微波加热反应一定时间。待反应结束后,进行减压抽滤和洗涤,并于80 ℃烘箱中烘干得到TiO2粉末。将微波加热15、25、45和120 min制备得到的TiO2分别记为样品a、b、c和d。将1.5×10-3mol/L的(NH4)2TiF6和3×10-3mol/L的H3BO3混合配制成100 mL溶液,微波加热15 min制备得到的TiO2记为样品e。将0.02 mol/L的(NH4)2TiF6和0.04 mol/L的H3BO3混合配制成100 mL溶液,在70 ℃微波加热45 min制备得到的TiO2记为样品f。
1.3 TiO2纳米球的表征
采用X射线衍射仪(XRD)分别测定不同反应条件下微波处理得到的TiO2的晶体结构。主要测试条件:激发源为Cu靶,电压为40 kV,电流为300 mA,衍射角扫描范围为10°~90°。
采用场发射扫描电子显微镜(FESEM)分别观察不同反应条件下微波处理得到的TiO2表面形态的差异。
采用场发射透射电子显微镜(FETEM)观察TiO2的微观结构。
采用选区电子衍射(SAED)观察TiO2的晶体特征。
采用表面光电压谱仪(自组装:500 W氙灯作为光源、双光栅单色仪、锁相放大器和斩波器)测试TiO2的光电性能。
1.4 光催化性能测试
移取50 mL 浓度为5.0×10-5mol/L的罗丹明B溶液置于光反应试管中,加入0.03 g TiO2粉末作为光降解催化剂。在光催化之前,先将体系置于黑暗中搅拌30 min,然后在360 W汞灯发出的紫外光下照射90 min,取上层清液离心分离。采用分光光度法,根据测试光照射前后染料溶液吸光度的变化,计算出对应的浓度以及脱色率。
2 结果与讨论

(1)
(2)

(3)
在上述反应过程中,置换后形成的[Ti(OH)6]2-进一步受到微波辐射时,配位水分子中的O—H键产生快速振动,瞬间释放出大量的热,使[Ti(OH)6]2-迅速水解,生成水合TiO2分子,局部成为过饱和溶液。微波的热效应和非热效应造成的瞬间急剧升温,产生了大量的TiO2晶核[12],从而保证了水合TiO2晶体的纳米尺度。同时,不同于常规加热,微波加热更为均匀,使得体系内部产生的TiO2晶核的分布也更为均匀,从而得到尺寸均一的TiO2颗粒,这些都为形成纳米颗粒提供了必要条件。
2.1 微波加热时间对TiO2纳米球形貌及晶型的影响
不同微波加热时间(15、25、45和120 min)所制备的TiO2纳米球的XRD图谱如图1所示。
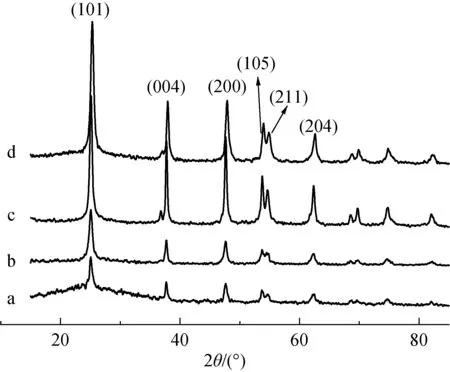
图1 TiO2纳米球(样品a~d)的XRD图谱Fig.1 XRD pattern of TiO2 nanospheres (samples a-d)
由图1可以看出,TiO2纳米球的晶型并不受微波加热时间的影响,均为锐钛矿相的TiO2。在2θ=25.4°、37.8°、47.8°、54.1°、54.5°和62.8°处都出现了衍射峰,分别对应锐钛矿型TiO2的(101)、(004)、(200)、(105)、(211)和(204)晶面。随微波加热时间延长,样品的衍射峰越来越尖锐,说明TiO2结晶度随时间延长而提高。根据谢乐公式(D=K/(β1/2cosθ))分别计算了各样品的晶粒尺寸。以最强衍射峰(101)面的半峰宽计算得到不同微波加热时间(15、25、45和120 min)制备的TiO2的晶粒尺寸分别为10.7、13.3、17.7和18.5 nm。由此可见,微波加热120 min得到的TiO2(样品d)较45 min(样品c)的晶粒尺寸并没有增加很多,这表明微波加热45 min时,晶粒生长已经基本完整,之后随时间延长而生长缓慢。由此表明,即使在低温下(<100 ℃),在微波辅助加热的条件下也能得到结晶度很好的锐钛矿型TiO2。传统加热方式需要在反应结束之后经过高温煅烧才能得到结晶度良好的锐钛矿型TiO2,而在微波条件下,[Ti(OH)6]2-迅速水解,使得TiO2晶粒迅速生成并生长。
不同微波加热时间所制备的TiO2纳米球的FESEM图如图2所示。由图2可以看出,随微波反应时间延长,TiO2形貌逐渐发生变化。当微波加热

(a) 样品a

(b) 样品b

(c) 样品c

(d) 样品d
时间为15 min时,样品a纳米粒子的形貌不规则,但是可以看出,(NH4)2TiF6水解产生了一个以一个椭圆形片状为中心的初级粒子,之后水解产生的片状小颗粒不断在其上沉积并生长,直至长大成为一个圆满的球形。当微波加热时间为45 min时,样品c纳米球形颗粒已基本长成,即使延长时间至120 min,TiO2纳米球的形貌也没有发生变化,只是平均粒径由500 nm增加至660 nm。由此可见,每个TiO2纳米球均具有层级结构,即纳米球是由大量的TiO2纳米粒子组成的,这种特殊的结构说明其是由纳米粒子聚集长大形成的。花形TiO2纳米球的生长示意图如图3所示。

图3 花形TiO2纳米球的生长机理Fig.3 Schematic diagram of the growth of flower-shaped TiO2 nanospheres
单分散粒子一般都遵从LaMer模型,即粒子的生长分为成核阶段和长大阶段。成核阶段只成核不长大,长大阶段不存在成核的情况,因此粒子可以同时长大,形成单分散粒子。该模型的一个显著特征是存在一个晶核孕育的过程,但是在图2中并没有发现这个过程,也就是说微波法制备TiO2颗粒其的形成机制并不符合LaMer机制。(NH4)2TiF6在微波加热的条件下与H3BO3发生反应,由于微波的特殊加热机制,在很短时间内(NH4)2TiF6发生水解反应生成TiO2片状粒子,这些片状粒子为一次粒子,然后一次粒子发生聚集生成二次粒子,二次粒子再吸附周围的一次粒子,一层一层吸附最终形成花状球形粒子。这种机制是聚集长大机制,即一次粒子通过源源不断地向二次粒子扩散并被吸附而导致二次粒子的长大[13]。
微波加热45 min制备的TiO2纳米球(样品c)的FETEM图和SAED图如图4所示。从图4(a)可以看出,TiO2花状颗粒是由多层片状粒子组装而成。从图4(b)可以看到片状粒子的晶格线完整,并可以观察到有两种晶格线存在,分别对应XRD的最强衍射峰d=0.35 nm的(101)面,以及次强衍射峰d=0.24 nm的(004)面。
当保持(NH4)2TiF6与H3BO3的摩尔比为1∶2,(NH4)2TiF6浓度降低为1.5×10-3mol/L时,采用微波辅助加热15 min,仍然可以制备得到锐钛矿型TiO2(样品e),其XRD图谱如图5所示。由图5可以看出,在短时间的微波辐射下,产物在25.4°、37.8°、47.8°、54.1°、54.5°和62.8°处出现了锐钛矿型TiO2的典型衍射峰,但结晶度较差。这可能是因为晶体生长需要一定时间,在较短时间内产生的TiO2的结晶度会较差。

(a) FETEM

(b) SAED
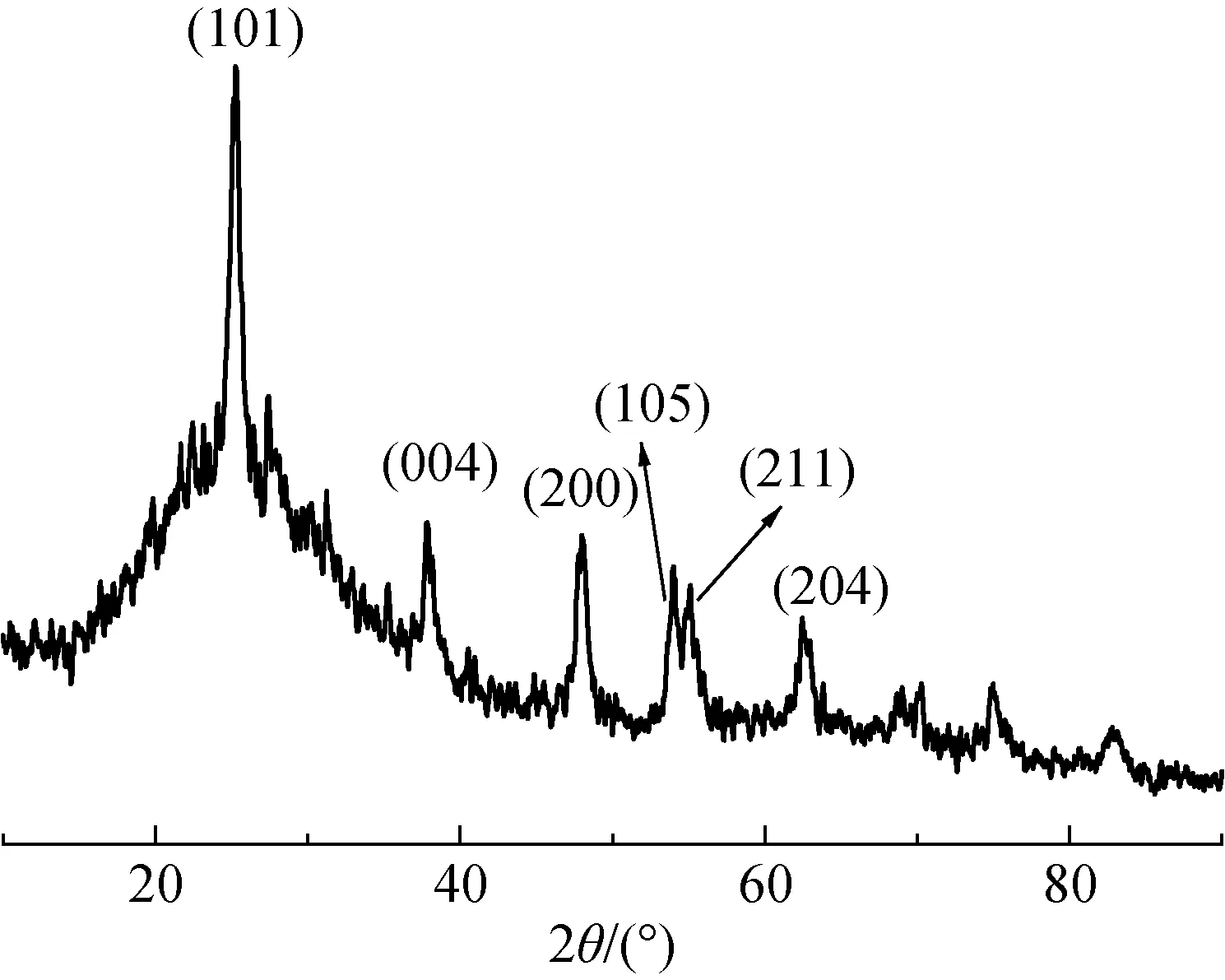
图5 TiO2(样品e)的XRD图Fig.5 XRD pattern of TiO2(sample e)
样品e的FESEM图如图6所示。由图6可以看出,得到的产物仍然为多晶的TiO2颗粒。当采用传统加热方式并以低浓度的钛源溶液进行反应时,在短时间内无法得到TiO2[14]。文献[15]报道,当[TiF6]2-离子的浓度高于0.2 mol/L时,才会发生均相成核产生沉淀。本试验充分说明了微波加热与传统加热方式的不同,微波加热直接作用于[TiF6]2-离子和水分子,提高了[TiF6]2-的水解速度,同时也促进了TiO2粒子的生成和晶化[16]。

图6 TiO2(样品e)的FESEM图Fig.6 FESEM image of TiO2(sample e)
样品f的XRD图如图7所示。从图7可以看出,在25.4°、37.8°、47.8°、54.1°、54.5°和62.8°处都出现尖锐的衍射峰,分别对应锐钛矿相的(101)、(004)、(200)、(105)、(211)和(204)晶面。这说明即使在低温(<100 ℃)微波辅助加热的条件下也能得到结晶度很好的锐钛矿型TiO2。样品f的FESEM图如图8所示。从图8可以看出,样品f也为花状纳米球,但是由于温度较低,组成花球的纳米TiO2颗粒没有生长完全,颗粒大小不规则。综合XRD和FESEM结果可知,当反应温度较低时,虽然TiO2颗粒尺寸分布不均匀,但仍然能够得到高结晶度的花状结构。
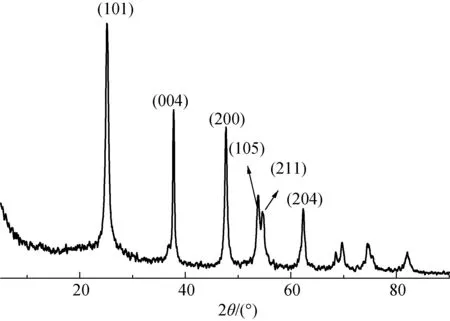
图7 TiO2纳米球(样品f)的XRD图Fig.7 XRD of TiO2 nanospheres (sample f)

图8 TiO2纳米球(样品f)的FESEM图Fig.8 FESEM image of TiO2 nanospheres (sample f)
表面光电压谱(SPS)能测量半导体材料的表面物性和界面间电荷转移过程,为探讨光催化机理提供了新手段[17]。样品c的SPS谱图如图9所示。
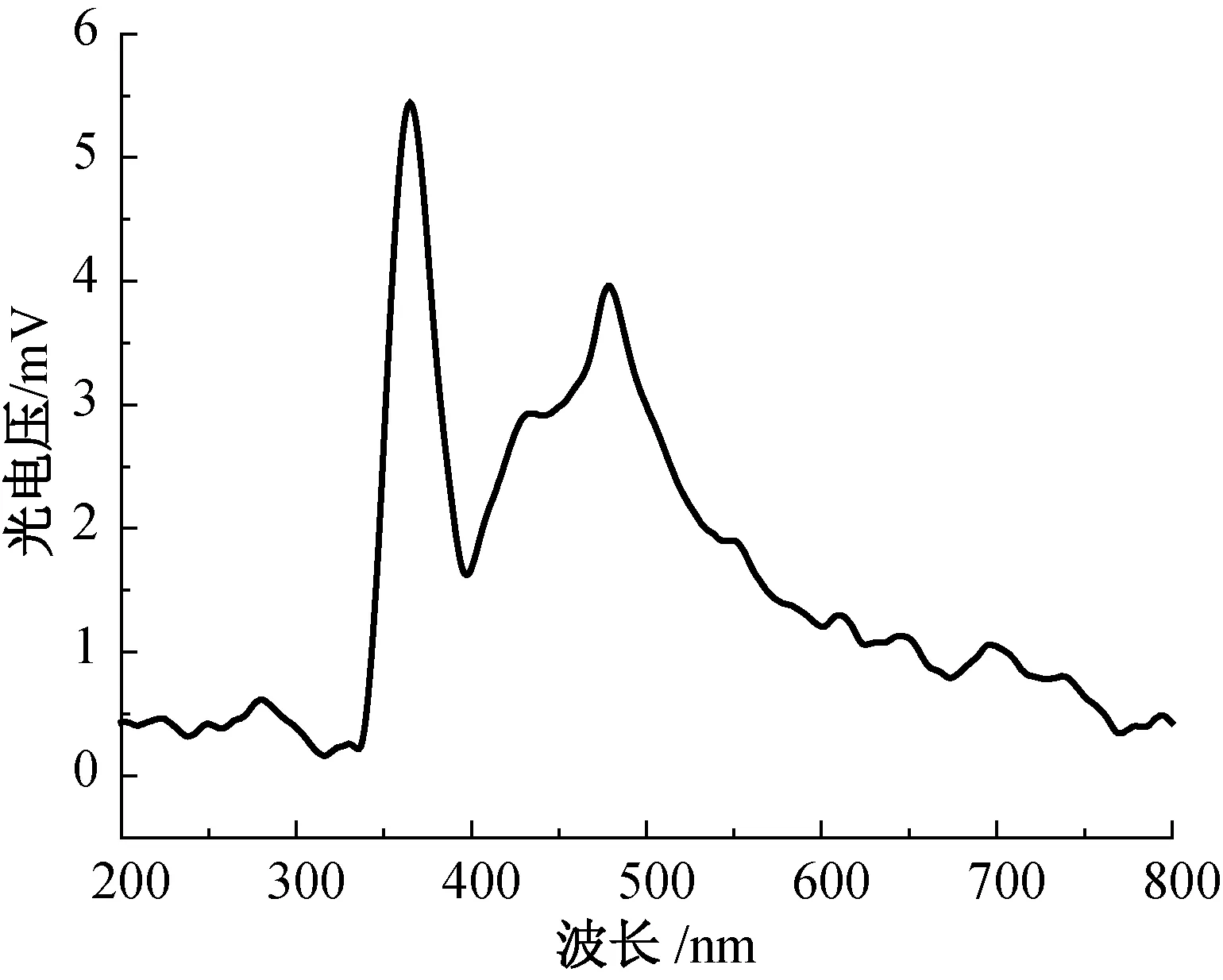
图9 TiO2纳米球(样品c)的SPS谱图Fig.9 Surface photovoltage spectra of TiO2 nanospheres (sample c)
从图9可以看出,TiO2(样品c)有两个响应峰,较尖锐的峰出现在350 nm左右,这个峰是由TiO2的电子从价带转移到导带引起的(O2p→Ti3d),另一个较宽的峰出现在400~500 nm,其是由TiO2表面氧空位及羟基等表面态的存在引起的带-态跃迁产生的[18]。400~500 nm范围的SPS响应峰可能是由于空穴被≡TiO-或者≡TiOH·+表面自由基捕捉造成的,而650 nm左右的SPS响应峰则可能是由电子被Ti3+中心(比如≡Ti3+—OH)捕捉引起的[19-20]。由于只有当钛原子作为电子陷阱(Ti4+→Ti3+)或者TiO2中有氧缺陷时会出现这些表面态[21],这说明制备的TiO2能在光的激发下发生电子跃迁,产生光生电子空穴,从而可以光催化降解污染物。
2.2 微波加热时间对TiO2纳米球光降解的影响
将制备的TiO2纳米球样品a~e作为光催化剂,以罗丹明B为降解目标,在紫外光下降解90 min后,探讨微波辅助法制备的TiO2的光催化性能。
不同微波加热时间制备的TiO2纳米球对罗丹明B的脱色率如表1所示。

表1 不同微波加热时间制备的纳米TiO2的光催化性能Table 1 Photocatalytic properties of nanometer TiO2 prepared at different microwave-assisted heating time
从表1可以明显看出,采用微波辅助法制备得到的TiO2对罗丹明B的脱色率都高于商品化P25-TiO2。这可能是因为微波辅助法制备的TiO2的结晶度较高,锐钛矿相的禁带宽度较大,氧化还原能力较高[22]。在样品a~d中,TiO2对罗丹明B的脱色率基本随着制备时间的延长而降低。其中,样品a对罗丹明B的脱色率最高,而样品c的脱色率和样品d的差别不大。样品e的制备时间虽然跟样品a相同,但其钛源浓度很低,导致两者形貌相差较大,从而使得样品e对罗丹明B的脱色率低于样品a。这是因为光催化反应发生在半导体的表面,因此有效接触面积越大,光催化效果越好。从图2和6可以看出,较短微波加热时间(样品a)及低浓度钛源(样品e)制备的TiO2颗粒形貌并不饱满,且粒径较小,组成颗粒的片状粒子能够较大面积地接触液体,从而使得与罗丹明B有效的接触面积增大。而随微波加热时间延长,片状TiO2颗粒自组装成花型球状颗粒,暴露在外面与罗丹明B接触的TiO2相对较少。因此,较短微波加热时间制备的TiO2(样品a)光催化性能最好。重复光催化试验5次后,TiO2纳米球的光催化降解率没有降低(如图10所示),说明此催化剂的稳定性能较好。
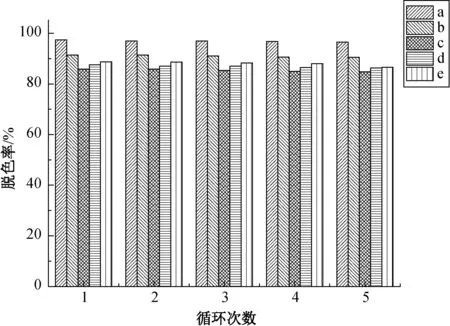
图10 紫外光照下TiO2催化罗丹明B脱色时的可循环性Fig.10 Cycling runs of photocatalytic decolourization of Rhodamine B using TiO2 nanosphers as catalysts under UV light irradiation
3 结 语
本文以六氟钛酸铵为钛源,以硼酸为F-消耗剂,在微波辅助加热条件下使Ti4+水解,可以制备出粒径均一、结晶度高的锐钛矿相TiO2纳米球。与传统加热方式相比,微波加热优势突出,即使浓度极低时,六氟钛酸铵也能在较短加热时间下发生水解反应,进而生成结晶度良好的锐钛矿相TiO2。采用微波辅助加热制备到的TiO2纳米球均具有优良的光催化性能。
参 考 文 献
[1] LIU Z Y, SUN D D, GUO P, et al. One-step fabrication and high photocatalytic activity of porous TiO2hollow aggre-gates by using a low-temperature hydrothermal method without templates[J]. Chem Eur J, 2007, 13(6):1851-1855.
[2] ZHANG Y F, FENG X H, LIU H, et al. Self-assembly TiO2hierarchical hollow microspheres with rutile nanorods by template-free hydrothermal method[J]. Chem Lett, 2008, 37(12):1264-1265.
[3] KIM D S, KWAK S Y. The hydrothermal synthesis of mesoporous TiO2with high crystallinity, thermal stability, large surface area, and enhanced photocatalytic activity[J]. Appl Catal A-Gen, 2007, 323 (3): 110-118.
[4] YU H G, YU J G, CHENG B, et al. Effects of hydrothermal post-treatment on microstructures and morphology of titanate nanoribbons[J]. J Solid State Chem, 2006, 179(2): 349-354.
[5] 云虹,林昌健,杜荣归.溶胶-凝胶-水热晶化法制备锐钛矿TiO2纳米膜的耐蚀性能[J].物理化学学报,2011,27(5):1122-1127.
[6] 张先如,徐政.微波技术在材料化学中的原理及其应用进展[J].辐射研究与辐射工艺学,2005,23(4):196-200.
[7] WANG H E, ZHENG L X, LIU C P, et al. Rapid microwave synthesis of porous TiO2spheres and their applications in dye-sensitized solar cells[J]. J Phys Chem C, 2011, 115(21):10419-10425.
[8] ZHANG D Q, WEN M C, ZHANG P, et al. Microwave-induced synthesis of porous single-crystal-like TiO2with excellent lithium storage properties[J]. Langmuir, 2012, 28(9): 4543-4545.
[9] SU W, LI R, XING Y J. Preparation and characterization of hollow carambola-shaped silver sulfide microspheres using a microwave-assisted template-free method[J]. Chin Chem Lett, 2016, 27(3): 451-453.
[10] 胡晓霞,赵林,赵数煜,等.微波法制备羟基磷酸铜及其光催化降解性能的研究[J].无机材料学报,2016,31(4):421-426.
[11] ZHANG C Y, ZHANG H H, LI R, et al. Morphology and adsorption properties of chitosan sulfate salt microspheres prepared by a microwave-assisted method[J]. RSC Adv, 2017, 7(76): 48189-48198.
[12] 李凡修,陆晓华,梅平.微波法制备纳米TiO2材料的研究进展[J].材料导报,2007,21(S3):61-64.
[13] PRIVMAN V, GOIA D V, PARK J, et al. Mechanism of formation of monodispersed colloids by aggregation of nanosize precursors[J]. J Colloid Interface Sci, 1999, 213(1): 36-45.
[14] PIZEM H, SUKENIK C N. Effects of substrate surface functionality on solution-deposited titania films[J]. Chem Mater, 2002, 14(6): 2476-2485.
[15] YU J G, YU H G, CHENG B, et al. The effect of calcination temperature on the surface microstrucure and photocatalytic activity of TiO2thin films prepared by liquid phase deposition[J]. J Phys Chem B, 2003, 107(50):137871-13879.
[16] 张留学.具有光催化活性的纳米TiO2复合抗菌纤维的低温制备及性能研究[D].兰州:兰州大学化学化工学院,2006.
[17] 井立强,李晓倩,李姝丹,等.纳米Au/TiO2光催化剂的XPS和SPS研究[J].催化学报,2005,26(3):189-193.
[18] 辛柏福,王鹏,任志宇.TiO2纳米粒子的表面光电压与光催化活性的关系[J].哈尔滨工业大学学报,2008,40(7):1121-1124.
[19] BAHNEMANN D W, HILGENDORFF M, MEMMING R. Charge carrier dynamics at TiO2particles: Reactivity of free and trapped holes[J]. J Phys Chem B, 1997, 101(35): 4265-4275.
[20] HOFFMANN M R, MARTIN F T, CHOI W, et al. Environmental applications of semiconductor photocatalysis[J]. Chem Rev, 1995, 95(1): 69-96.
[21] HILGENDORFF M, SUNDSTROM V. Dynamics of electron injection and recombination of dye-sensitized TiO2particles[J]. J Phys Chem B, 1998, 102(51): 10505-10514.
[22] 刘子传,郑经堂,赵东风,等.TiO2禁带宽度和光吸收系数对其光催化性能的影响[J].发光学报,2012,33(12):1329-1334.
