蝌蚪红细胞微核试验在水环境污染状况监测中的应用
2018-05-31常国亮
王 刚 ,蒋 洁,常国亮,刘 洋
(1.淮阴师范学院 科技处; 2.淮安市科学技术情报研究所 项目管理中心;3.淮阴师范学院 生命科学学院;4.淮阴师范学院 设备处,江苏 淮安 223300)
国外学者曾用荫鱼[1]、银大马哈鱼、有尾目肋螈幼体等作为实验动物[2]检测水体污染研究;我国也有学者先后使用黄鳝、鲫鱼、泥鳅、蝌蚪等作为实验动物进行微核试验,从而检测水中致变物的致变效应[3-5],国外研究结果表明,运用蝌蚪血红细胞微核试验进行水污染检测,是比较理想、有实用价值的生物指示器,可以检测水体中低浓度污染物[6].本人所在实验室以前使用蝌蚪进行过类似的红细胞微核试验,测定并报道了里运河水以及淮安市不同区域河流水质诱发蝌蚪红细胞微核及核异常的研究[7-8],本实验选择从淮安市区到楚州区的3条主要河流的河水为检测对象,采用中华大蟾蜍蝌蚪进行红细胞的微核试验,对淮安市市区到楚州区不同区域水质污染情况进行监测,以进一步了解淮安市及周边不同区域主要水质的污染情况和程度,从而为地方水环境的监测和治理提供初步的理论依据.
1 实验
1.1 材料
中华大蟾蜍变态期的蝌蚪,体重0.2g左右,2016年4月初采于淮安市桃花岛内的一段未受污染的河流中.染毒前10天,置于曝气后的自来水内饲养,水体温度保持在20~22℃.一周换水2次,每天使用磨细的饲料喂养一次,做试验时选择处于变态期发育状态良好蝌蚪为实验材料.
1.2 仪器
电热恒温水浴锅(上海医疗器械五厂)、JNOEC XS-212-202显微镜、XSJ-HS电脑显微分析系统(Panasonic WV-CP240摄像头)、SARTORIUS BS423S电子天平(北京赛多利斯仪器系统有限公司).
1.3 方法
1.3.1 药品及其配制
1)固定液
甲醇原液(GB 683-79分析纯,南京建设化学试剂厂产品).
2)Giemsa染色液
称取Giemsa粉(Q/GHSC 1092-97,上海试剂三厂产品)0.25g,甘油(GB687-77化学纯,上海制皂厂出品,上海化学试剂采购供应站试剂厂分装)16.5mL,甲醇16.5mL.首先将少量甘油倒入Giemsa粉中,使用研钵研磨至无颗粒,再将剩余的甘油全部倒入,最后将甲醇加入并混匀,用滤纸过滤.将混合液放在56℃水浴2h使其充分溶解.用时取1mL加19mL 1/15mol/L的磷酸缓冲液(pH=6.81)即成15%的Giemsa染液.
3)1/15mol/L磷酸缓冲液(pH=6.81)
称取0.272g KH2PO4(GB1274-77化学纯,上海试剂二厂产品),称取0.716g Na2HPO4·12H2O(GB1263-77分析纯,江苏省连云港市化学试剂厂产品),加蒸馏水60mL,混匀即可.
1.3.2 采水及预处理
对照组为经暴气后的淮安市自来水,A处为淮安市区里运河(淮海路段与黄河路交叉点);B处为淮安市开发区古淮河水(大同路和水渡口大道交叉点);C处为淮安市楚州区城区文渠水(大八字桥至北水关段);D处为淮安市楚州区城区萧湖水(河堤东侧);采水时间为2016年6月;水样预处理方法为自然沉淀后待用.
1.3.3 实验分组
对照组为经暴气后的淮安市自来水,实验组用A、B、C、D四组水样,每一组水样均分为原样100%、50%、33.3%三个浓度,用暴晒后的自来水配置,饲养密度每组20只/300ml.
1.3.4 染毒
选择来源相同,发育状况体重相似的蝌蚪随机放入每一试验水样中.每组投放20只蝌蚪,染毒时间均为一周,染毒一周后,蝌蚪全部存活,转移到经暴气后的自来水中,6h后处死制血涂片.每一浓度中随机取6到10只蝌蚪进行处理.每一组中,挑选20只来源相同,发育情况、体重、个头等基本情况一致的蝌蚪随机放入试验水样中.染毒一周后蝌蚪全部存活,然后,将蝌蚪全部放入经过暴晒的自来水,静养6h,并从每一种浓度中挑选6-10只处死,制作血涂片,以便实验使用.
1.3.5 血涂片的制备
取蝌蚪,用纱布将其体表的水分吸干(防止血细胞破裂),在躯干和尾巴连接处断尾,取血,涂片,自然晾干,用甲醇固定液固定15min,15%的Giemsa染液染色15min,流水冲洗后用电热吹风机吹干[9].
1.3.6 数据记录及结果分析
将做好的血涂片置于显微镜底下进行观察,寻找涂片均匀区域,每张片子需要观察2000个细胞,观察后记录微核和核异常细胞数量.结果统计时,使用千分率(‰)表示.微核试验中鉴定微核及核异常方法参考有关文献[10].
微核细胞率=具有微核的细胞总数/观察细胞总数×1000‰;
核异常细胞率=具有核异常(除微核)的细胞总数/观察细胞总数×1000‰;
将以上实验数据均做统计学方面分析(独立性检验)[11].
2 结果与分析
不同区域水质对蝌蚪红细胞微核的影响结果见表1.
从表1可知,生活在对照组中的蝌蚪,其红细胞的微核细胞率为0.112‰;A、B、C、D原液四组水质引起蝌蚪红细胞的微核细胞率分别为0.386‰、0.625‰、1.475‰、0.224‰,它们分别是对照组的3.44、5.58、13.17、2.00倍,与对照组相比较,除D组外,A组有显著性差异(P<0.05),B、C组都有极显著性差异(P<0.01)(见图1).

图1 不同区域水质诱发蝌蚪红细胞微核细胞率的比较
不同区域水质对蝌蚪红细胞核异常的影响见表2.从表2可知,对照组的蝌蚪红细胞核异常细胞率为0.441‰,四个实验组原液的核异常细胞率分别为2.053‰、3.026‰、3.475‰、1.162‰,它们分别是对照组的4.66、6.86、7.88、2.63倍,与对照组比较,除D组楚州城区萧湖水与对照组无差异(P>0.05)外,A组有显著性差异(P<0.05),B、C组都有极显著性差异(P<0.01) (见图2).
3 讨论
微核试验(micronucleus test, MN)是依据环境污染物能够引起细胞DNA损伤、诱发染色体畸变,从而在细胞核外形成微核的道理,以便检测污染物中诱变物质对染色体损伤的一种简单可行的方法.其原理是由于外源物质的干扰,染色体发生断裂,在细胞分裂过程无着丝点的染色体断片,无法正常进入到子细胞中,这样在细胞核外就产生了微小的核,涂片染色后,统计细胞微核率,检测染色体受损伤的程度,从而间接反映化学物的遗传毒性.
本实验之所以选择蝌蚪作为实验动物,是因为它具有如下5个优点:(1)蝌蚪易于采集,数量较多,基本上无成本,且易于观察和实验.(2)蝌蚪红细胞体积较大,分裂旺盛,对环境污染物反应相当灵敏.(3)蝌蚪对环境质量变异极其敏感,因为蝌蚪体表很薄、与水体完全接触,且没有保护性的隔离(如鱼的鳞片、昆虫的壳等)结构.(4)蝌蚪体内因为拥有转化前诱变剂或前致癌剂为具有活性成分的微粒体活性系统,除了对检测水体中的直接致突变物有较好适用性外,还可以检测水体中的前致突变物[12].(5)蝌蚪微核试验对水中单因子致突变效应和污水中混合污染物的联合致突变效应都具有较好的适用性,拥有很高的实用价值[13].
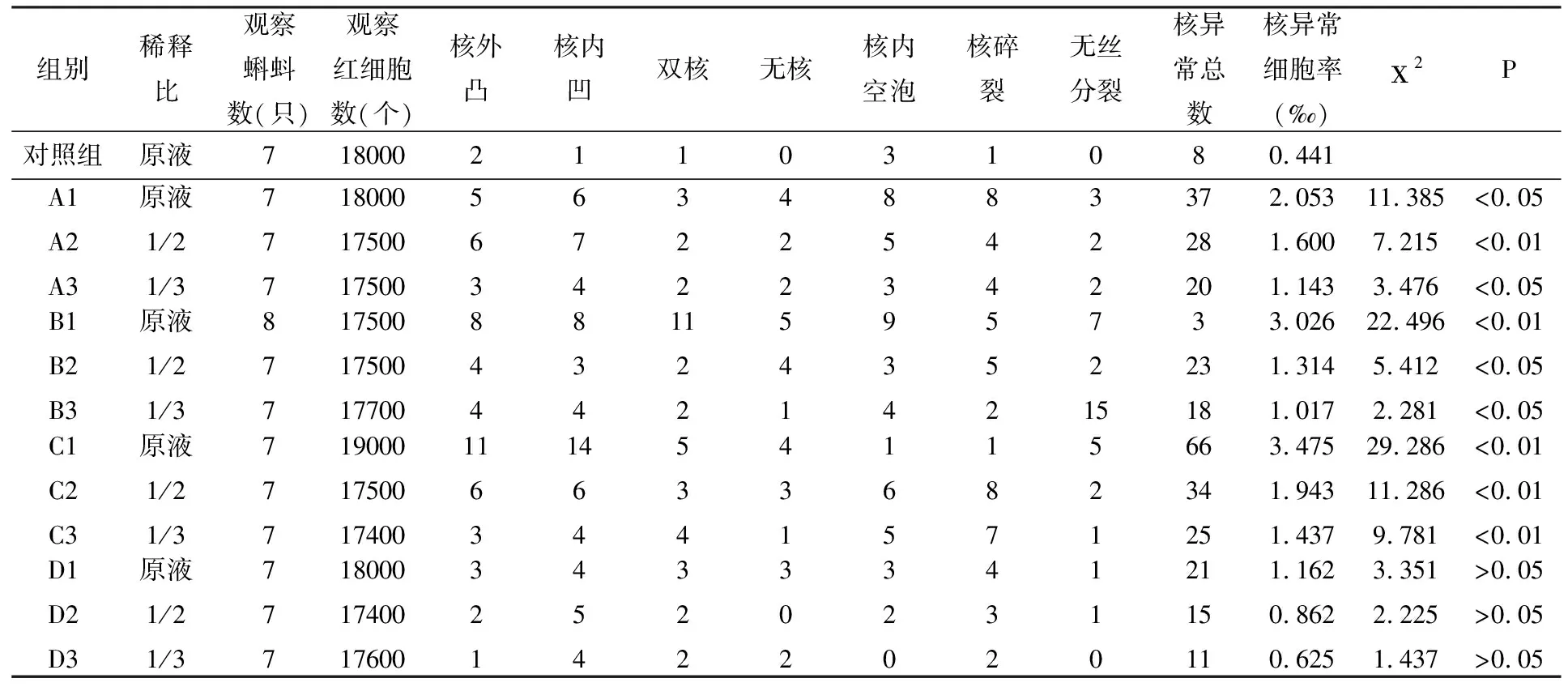
表2 不同区域水质引起蝌蚪红细胞的核异常比较

图2 不同区域水质诱发蝌蚪红细胞核异常细胞率的比较
实验发现,不同地区河水诱发蝌蚪血红细胞微核率呈现不同的特点.从表1可以看出, C组(淮安区城区文渠原液)微核率最高,达1.475‰,为对照组的13.17倍,二者差异极显著(P<0.01);A(市区)、B(开发区)组(均为原液)次之,其微核率分别为 0.386‰、0.625‰,与对照组相比, A组有显著性差异(P<0.05),B组都有极显著性差异(P<0.01);D组微核率为0.224‰,与对照组相比无明显差异(P>0.05).据查,四条河水污染程度不同主要是因为沿岸污染源分布不一.C组(楚州城区文渠河)是环城的一条主干河流,人口密集,居民众多,排入此河流的污染源主要有生活垃圾和粪便以及一些工厂排放的工业废水、废渣和废气,从而造成河水的严重污染;B(开发区)组河水污染程度处在市区里运河与城区文渠河之间;A组(市区里运河)从市区穿过,地处经济繁华地带,城市生活污水成分复杂,有生活日常垃圾和粪便、洗涤剂以及各种病原微生物等,并且此处有排污口,污水源源不断向河中排放;D组(萧湖)是位于淮安城区萧湖公园的一条河流,污染相对少一些.生活污水中的各种成分联合作用导致了蝌蚪红细胞的致突效应.首先,各种有机污染物的降解,需要消耗水中溶解氧气,直接造成水中缺氧,从而造成影响蝌蚪生长缓慢等情况,诱发蝌蚪体内染色体受损而产生微核;其次,在降解不饱和脂肪酸自身氧化过程中,会产生大量游离原子团、过氧化物、氢氧化物等,这些物质氧化性很强,摄入这些污染物,可引发蝌蚪产生微核与核异常[14].研究结果发现,不同浓度的河水致变蝌蚪血红细胞微核率不同.置于对照组中的蝌蚪,红细胞微核率仅为0.112‰,不同浓度河水水质处理后,微核率的上升幅度与浓度成正比,浓度越高,微核率越高.淮安城区文渠组1/3稀释度微核率为0.172‰;1/2稀释度微核率升高为0.286‰;而原液组微核率高达1.475‰,呈明显的剂量效应关系.
实验发现,细胞除产生微核外,同时出现了其他方面的核异常.核异常包括核质外凸、核固缩、核内凹、核变形、无核、双核、核碎裂、核内空泡、无丝分裂及小核等,是一种综合性的核损伤指标.实验表明在试验组微核率较高,出现核异常率亦较高.与此同时,我们还在微核率高的组中发现双微核和三微核等现象,这从某种程度上反映出遗传物质损伤的加重.该现象表明,核异常和多微核也可以作为检测致变效应的指标.本实验结果表明,淮安市区到淮安区的3条主要河流(市区里运河、开发区河水、淮安城区文渠水)的河水均含一定量的致突变活性物质,并且3个地区的河水的含量呈现出递增趋势,尤以淮安城区水体致突变性最高.这3条主要河流致变物的含量已经在一定程度上对沿岸百姓生活和农业生产构成了威胁,希望地方环保部门、有关厂商及时采取相关治理措施,迅速改善地方水质,为当地人民提供健康的保证.
[参考文献]
[1]Kligerman A.D.,et al.Umbra limi:amodel for the study of choromosome aberrations in fishes[J].Mutation Res,1975,31(4):225-233.
[2]Jaylet A,et al.A new micronucleus test using peripheral blood erythrocytes of the new t pleurodeles walt to detect mutagens in fresh-water pollution[J].Mutation Res,1986,164(4):245-257.
[3]刘爱华,等.鱼类血细胞的微核测定[J].动物学研究,1985,6(1):8-10.
[4]楼允东,等.亚硝基胍对泥鳅红细胞微核及核异常的诱发[J].中国环境科学,1986,16(4):275-278.
[5]贺维顺,等.一种水质污染生物监测的新方法-蝌蚪肠细胞染色体畸变分析[J].环境科学学报,1987,7(4):467-470.
[6]汤新慧.串场河水诱发蝌蚪血红细胞微核的研究[J].江苏预防医学,1997,7(1):83-86.
[7]周雪瑞.里运河水对蝌蚪红细胞微核率及核异常率的影响[J].江苏预防医学,2005,16(4):102-105.
[8]周雪瑞.淮安市不同区域河流水质诱发蝌蚪红细胞微核及核异常的研究[J].淮阴师范学院学报,2005,4(4):62-65.
[9]耿德贵,等.除草剂乙草胺对蝌蚪红细胞微核及核异常的影响[J].环境与健康杂志,2000,17(1):36-38
[10]耿德贵,等.四种除草剂对中华大蟾蜍蝌蚪红细胞微核及核异常的影响[J].动物学杂志,2000,35(1):12-16.
[11]李春喜,王志和,等.生物统计学[M].北京:科学出版社,2000.
[12]苑宇哲,等.应用蝌蚪快速检测环境变异的两种方法——微核试验和单细胞凝胶电泳[J].四川动物,2004,23(1):74-80.
[13]贺维顺,王蕊芳.蝌蚪血红细胞微核和核异常监测水质污染的研究[J].动物学研究,1990,11(1):1-6.
[14]刘清华,等.肝癌高发区饮用水对蝌蚪红细胞微核率影响的研究[J].广西预防医学,1999,4(5):72-74.
