β-tubulin在肾脏D5R与CCKBR相互调节中的重要作用
2018-05-31刘云鹏姜晓亮杨志伟中国医学科学院医学实验动物研究所北京协和医学院比较医学中心北京100021
刘 星,刘云鹏,付 慧,刘 雪,姜晓亮,杨志伟(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
钠水代谢障碍是导致高血压等多种心脑血管疾病的重要病因[1 - 3]。肾脏多巴胺D5受体(D5R)通过调节肾脏钠钾ATP酶(Na+, K+-ATPase)、钠氢交换体(Na+/H+exchanger 3,NHE3)的活性在钠水代谢和血压调节中起重要作用[4]。胃泌素(gastrin)是一种重要的胃肠激素,已被证实在调节机体钠水代谢中起重要作用[5]。Gastrin由胃和十二指肠内的G细胞分泌,并释放到血液循环中。与其他胃肠激素相比gastrin能够被肾皮质肾小管大量吸收,通过与其受体CCKBR结合参与钠离子调节的转运[6]。有研究发现D5R与CCKBR在肾脏近曲小管上皮细胞共表达,并通过相互调节参与机体钠水代谢[7],但其机制并不清楚。
微管(microtubule)是构成细胞骨架的主要成分,由α和β两种类型的微管蛋白亚基构成二聚体,在细胞内物质运输等生理过程中发挥重要作用[8]。β-tubulin是抗微管药物的主要靶点,是构成细胞骨架重构的关键蛋白[9],其表达异常与心肌损伤、癌症等多种疾病的发展密切相关。研究证明,有功能和活性的多巴胺受体在细胞质膜上是动态变化的,且需要完整的微管网络的介导[10]。微管蛋白抑制剂nocodazole可以破坏微管蛋白网络和并阻断循环利用的多巴胺受体迁移至细胞膜[11],但目前关于β-tubulin参与D5R和CCKBR的转运的研究甚少。本研究拟探讨β-tubulin在CCKBR和D5R相互作用及钠水代谢中的作用,并比较其在正常人和高血压患者中的表达差异。
1 材料和方法
1.1 实验材料
正常人肾近曲小管细胞(NT16)和高血压患者肾近曲小管细胞(HT14)由安徽医科大学教授惠赠。
1.2 主要试剂与仪器
胃泌素(南京金斯瑞生物科技有限公司,RP12740),fenoldopam(Sigma公司,SML0198),小鼠抗人多巴胺D5R抗体(Novus公司,NB110-60019),兔抗人CCKBR抗体(Santa Cruz公司,SC-33221),兔抗人Na+, K+-ATP酶抗体(Santa Cruz公司,SC-28800),β-tubulin抗体(杭州华安公司,M1305-2),羊抗小鼠IgG(Abcam 公司,Ab175473)。激光共聚焦扫描显微镜(Leica TCS SP2,德国),化学发光凝胶成像仪(Tanon-5500),CO2培养箱(Thermo 公司,FORMA 371)。
1.3 实验方法
1.3.1 细胞培养和实验分组
正常人肾近曲小管细胞(NT16)和高血压患者肾近曲小管细胞(HT14)用DMED/F12培养基,置于37℃、5% CO2的培养箱中培养。培养基中含有表皮生长因子EGF(10 ng/mL),地塞米松(36 ng/mL),三碘甲状腺氨酸T3(2 ng/mL),胰岛素铁硒传递蛋白ITS(1×),青霉素/链霉素(10 000 U/mL),胎牛血清(2%),细胞长满后用胰酶消化传代培养。
1.3.2 免疫荧光检测蛋白表达定位
细胞长至合适浓度,计数后调整浓度为2 × 104个/mL,接种于无菌盖玻片,长至50%进行实验。吸净培养基,无血清培养基洗一遍,分别加入gastrin、fenoldopam、nocodazole,37℃处理(分组如下),将正常人肾近曲小管细胞(NT16)分为四组:第一组:gastrin(10-8mol/L,30 min)组;第二组:nocodazole(10-4mol/L,30 min)+ gastrin(10-8mol/L,30 min)组,第三组:fenoldopam(10-6mol/L,30 min)组;第四组:nocodazole(10-4mol/L,30 min)+ fenoldopam(10-6mol/L,30 min)组。将高血压患者肾近曲小管细胞(HT14)分为两组:第一组:gastrin(10-8mol/L,30 min)组;第二组:fenoldopam(10-6mol/L,30 min)组。处理后加入PBS洗三遍,4%多聚甲醛常温固定20 min,PBS洗三遍,1% Triton 100破膜15 min,PBS洗三遍,10% FBS常温封闭30 min,β-tubulin抗体、D5R抗体、CCKBR抗体,4℃过夜,PBS洗三遍,羊抗小鼠IgG 1∶200室温1 h,PBS洗三遍,滴一滴DAPI,将圆形玻片取出,小心扣于载玻片上,封片,荧光显微镜观察。
1.3.3 Western blot检测蛋白表达
两种细胞分别按2 × 104个/mL浓度接种于100 mm细胞培养皿,37℃、5% CO2生长至合适浓度,无血清培养基漂洗一次,分为五组,第一组:对照组;第二组:fenoldopam(10-6mol/L,24 h)组;第三组:nocodazole(10-4mol/L,30 min)+ fenoldopam(10-6mol/L,24 h)组;第四组:gastrin(10-8mol/L,24 h)组;第五组:nocodazole(10-4mol/L,30 min)+ gastrin(10-8mol/L,24 h)组,37℃、5% CO2过夜培养,PBS洗三遍,胰酶消化细胞,PBS洗三遍,提取膜蛋白,测定蛋白浓度,制样,40 μg蛋白量10% SDS-PAGE电泳,2000 mA NC膜转移1 h,5%脱脂奶粉室温封闭3 h,分别与小鼠抗人D5R抗体、兔抗人CCKBR抗体、兔抗人Na+, K+-ATP酶抗体4℃过夜反应,二抗为羊抗小鼠IgG抗体(1∶5000),羊抗兔IgG(1∶5000),反应1 h,HRP-GAPDH为内参抗体(1∶10 000),化学发光,曝光。
1.4 统计学方法

2 结果
2.1 肾脏近曲小管细胞中CCKBR和D5R的相互作用
给予正常人近曲小管细胞(NT16)fenoldopam处理后细胞膜CCKBR的表达量显著增加,同样,给予细胞gastrin后细胞膜D5R的表达量显著增加(P< 0.05,图1A)。本课题组前期研究已经发现D5R和CCKBR间存在相互作用共同参与钠水代谢[7],但其相互作用的机制并不清楚。因此本研究使用微管抑制剂nocodazole预处理再加入fenoldopam,细胞膜CCKBR的表达量与对照组相比增加不显著(P< 0.05,图1A),同样使用nocodazole预处理再加入gastrin处理后,细胞膜D5R的表达量与对照组相比无差异,Na+, K+-ATP酶的表达也与对照组无异。该结果显示肾小管上皮细胞内D5R和CCKBR的相互作用与微管蛋白密切相关。
然而对高血压患者肾脏近曲小管细胞的研究发现,两种受体激动剂的加入对于D5R和CCKBR的相互作用并没有显著的促进作用,给予nocodazole预处理后细胞膜CCKBR及D5R的表达量差异无显著性(P> 0.05,图1B)。该结果提示高血压患者较正常人肾近曲小管细胞中D5R和CCKBR的相互作用存在显著差异,其机制可能与微管蛋白功能缺失有关,因此影响到相关蛋白的转运和钠水代谢。

注:A:正常人肾脏近曲小管细胞(NT16);B:高血压病人肾脏近曲小管细胞(HT14)。FEN: fenoldopam(D5R激动剂);GAS:胃泌素gastrin(CCKBR激动剂)。与对照组相比,* P< 0.05;与FEN组相比,# P< 0.05;与GAS组相比,& P< 0.05。图1 人肾脏近曲小管细胞中CCKBR和D5R的相互作用Note.A: Normotensive renal proximal tubule cells (NT16). B: Hypertensive renal proximal tubule cells (HT14). FEN: fenoldopam (D5R agonist); GAS: gastrin (CCKBR agonist). Compared with the control group,* P< 0.05. Compared with the FEN group,# P< 0.05. Compared with the GAS group,& P< 0.05.Fig.1 Microtubules are involved in the interaction between the cholecystokinin B receptor and dopamine D5 receptor in human renal proximal tubule cells
2.2 正常人与高血压患者肾近曲小管细胞微管蛋白β-tubulin差异
为了检测正常人与高血压患者肾脏近曲小管细胞微管蛋白是否存在表达差异,本研究通过免疫荧光方法,标记微管蛋白β-tubulin。如图2所示,NT16细胞的微管蛋白在细胞内呈现清晰的束网状分布,多聚集于细胞内部向细胞膜延伸;但HT14细胞的微管蛋白结构混乱,无序,在细胞膜上分布明显变多。有研究显示高血压病人红细胞中微管蛋白向细胞膜转移[12]。本研究则发现HT14细胞的微管蛋白同样表现出异常行为,可能是造成细胞中D5R和CCKBR等蛋白转运障碍的重要原因之一。
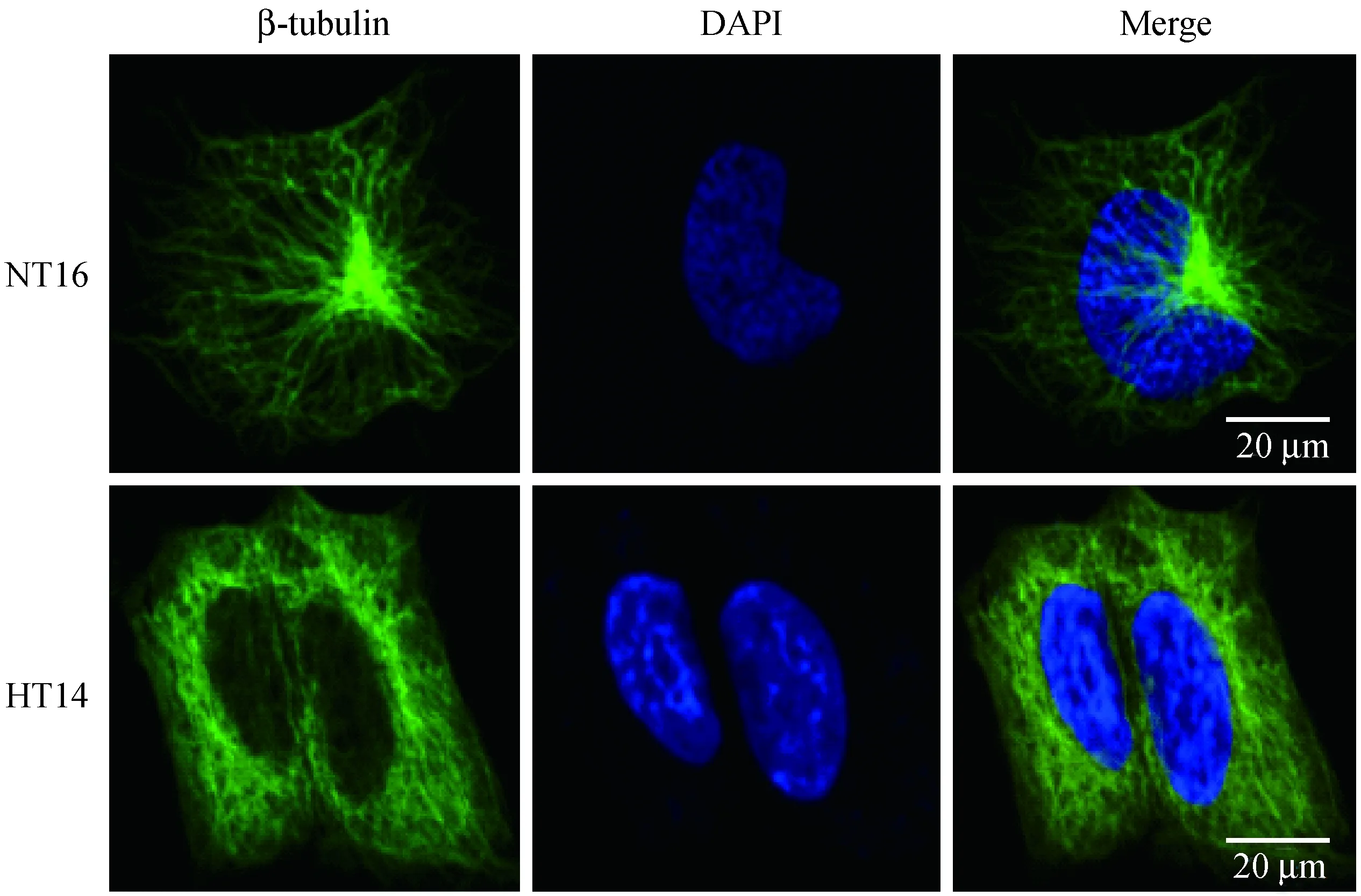
注:NT16:正常人肾脏近曲小管细胞;HT14:高血压病人肾脏近曲小管细胞。图2 微管蛋白在正常人和高血压病人肾脏近曲小管细胞中的表达Note.NT16: Normotensive renal proximal tubule cells; HT14: Hypertensive renal proximal tubule cells.Fig.2 Tubulin expression in normotensive and hypertensive renal proximal tubule cells
2.3 微管蛋白促进CCKBR和D5R在正常肾脏近曲小管细胞中的转运
已有研究发现多巴胺受体等多种蛋白在细胞质和细胞膜中的动态位移需要微管蛋白系统的介导[10]。为了进一步研究微管蛋白参与CCKBR和D5R的转运机制,本研究通过免疫荧光检测发现,fenoldopam处理NT16细胞后,D5R和CCKBR表达聚集在细胞膜上(图3A),nocodazole预处理再给予fenoldopam后,由激动剂诱发的D5R及CCKBR向细胞膜上的移动均无法发生,细胞膜上相应的受体蛋白表达也没有明显增加(图3C)。同样nocodazole能够阻断gastrin诱导的D5R和CCKBR向细胞膜转移(图3F),说明肾小管上皮细胞内D5R和CCKBR的转运与广泛存在的微管蛋白密切相关,当微管结构被破坏以后,受体间的招募活动无法完成,从而影响受体表达及对钠水代谢的调节功能。
高血压患者肾小管近曲小管HT14细胞使用fenoldopam和gastrin刺激后,D5R和CCKBR并未出现明显的细胞膜转移,细胞质中的表达仍然较多(图3B和图3D)。该结果进一步证实,高血压病人较正常人肾近曲小管细胞微管蛋白可能存在功能上的缺失,从而导致D5R和CCKBR等蛋白迁移至细胞膜的能力变弱,因此影响到相关蛋白的表达以及发挥生物学功能。

注:NT16:正常人肾脏近曲小管细胞;HT14:高血压病人肾脏近曲小管细胞。FEN: fenoldopam(D5R激动剂);GAS:胃泌素gastrin(CCKBR激动剂);nocodazole:微管抑制剂。图3 微管蛋白促进CCKBR和D5R在人肾脏近曲小管细胞中的转运Note.NT16: Normotensive renal proximal tubule cells; HT14: Hypertensive renal proximal tubule cells. FEN: fenoldopam (D5R agonist); GAS: gastrin (CCKBR agonist); nocodazole: microtubule inhibitor.Fig.3 Microtubules improve the interaction between the cholecystokinin B receptor and dopamine D5 receptor in human renal proximal tubule cells
3 讨论
钠水代谢障碍是导致高血压和心血管疾病的重要原因之一[2 - 3],机体内的钠水代谢受到胃肠道和肾脏的共同调控。胃泌素作为重要的胃肠道激素,通过与其受体CCKBR结合参与钠水代谢的调节[13]。胃泌素能被肾脏近曲小管细胞吸收从而调节肾脏钠离子转运[6]。胃泌素也能够抑制小肠粘膜钠离子的转运,增加钠排泄[14],因此本课题组首次通过人群实验证实胃泌素与高血压的发病机制密切相关[15],并且通过动物实验证实CCKBR能够与D5R相互作用参与机体钠水代谢调节和盐敏感性高血压的发展[7]。在对具体作用机制的进一步研究中,本课题组发现细胞骨架中的微管蛋白起着非常重要的调节作用。
微管是细胞骨架的主要成分之一,几乎存在于所有真核生物细胞之中。近年来,由于其在细胞形态的维持、细胞内物质运输、细胞内信号转导、细胞分裂及分化等生理过程中的重要作用,已成为多种疾病治疗的新靶点[8, 16]。β-tubulin是重要的微管蛋白,它作为钙离子相关蛋白,参与细胞内信号转导[17]。研究显示,糖尿病大鼠心肌细胞中β-tubulin表达增多。ATⅡ拮抗剂可有效阻断RAAS通路,抑制β-tubulin表达,从而对糖尿病心肌起到保护作用[18]。高血压患者的红细胞中微管蛋白向细胞膜移动,并与Na+, K+-ATP酶结合,导致酶活性受到抑制。应用诺考达唑治疗高血压患者的红细胞,引起细胞膜上乙酰化的微管蛋白减少,使Na+, K+-ATP酶激活[12]。本实验通过免疫荧光检测肾脏近曲小管细胞中β-tubulin的表达,同样发现正常人的微管蛋白β-tubulin在细胞中成清晰的网状结构,而高血压患者肾脏细胞中的β-tubulin表达杂乱无章,微管网络不清晰,有向细胞膜移动的趋势,显示高血压患者肾小管细胞中的微管蛋白表达异常。而研究显示,微管网络参与并且调控多巴胺受体由细胞内向细胞质膜的迁移,并在细胞质膜上保持动态变化,从而发挥调节钠水代谢等生理功能[19 - 20]。也有研究显示微管蛋白对于D5R及CCKBR等G蛋白偶联受体的转运起十分重要的作用[21 - 22]。高血压患者肾脏多巴胺系统表达异常,钠水代谢障碍[23 - 24]。因此微管蛋白可能成为调控CCKBR和D5R间相互作用,参与钠水代谢和血压调节的新靶点。
本研究通过给予正常人肾脏近曲小管细胞(NH16)CCKBR激动剂gastrin和D5R激动剂fenoldopam后,D5R及CCKBR均可以向细胞膜上移动,其在细胞膜上的表达量也有所增加。nocodazole可以破坏微管蛋白网络,进而影响受体迁移至细胞膜的能力,因此在对正常人肾小管近曲小管细胞进行nocodazole预处理后,激动剂并没有增加细胞膜上D5R及CCKBR的表达量,免疫荧光检测发现D5R及CCKBR仍然聚集在细胞内部,并没有向细胞膜移动。该结果证实微管蛋白在D5R及CCKBR相互作用中起重要作用,并且发现高血压患者体内肾脏近曲小管细胞中微管蛋白的异常可能是影响D5R及CCKBR相互作用及钠水代谢的重要原因之一。目前研究发现nocodazole能够抑制PKC的激活[10]。肾脏D5R可以激活磷脂酶C(PLC)-PKC途径[25],胃泌素能够与CCKBR结合激活PI3K/PKC途径[26]。因此,微管网络可能通过抑制PKC激活从而抑制D5R及CCKBR相互作用,也是本课题组下一步研究的内容。
综上所述,本研究首次发现微管蛋白β-tubulin参与肾脏近曲小管细胞内D5R与CCKBR相互作用及Na+, K+-ATP酶的调节,从而参与钠水代谢调节;同时发现高血压患者肾小管内β-tubulin存在表达和功能上的缺失,从而影响D5R与CCKBR相互作用及对钠水代谢的调节,可能成为盐敏感高血压治疗的新靶点。
参考文献:
[1] 水克冬, 祁华金, 陆昀, 等. 2002年和2012年我国成人高血压患病和治疗情况比较分析 [J]. 中国医药导报, 2016, 13(24): 170-173.
[2] Frame AA, Wainford RD. Renal sodium handling and sodium sensitivity [J]. Kidney Res Clin Pract, 2017, 36(2): 117-131.
[3] Hall JE. Kidney dysfunction mediates salt-induced increases in blood pressure [J]. Circulation, 2016, 133(9): 894-906.
[4] Cuevas S, Villar VA, Jose PA, et al. Renal dopamine receptors, oxidative stress, and hypertension [J]. Int J Mol Sci, 2013, 14(9): 17553-17572.
[5] Jose PA, Yang Z, Zeng C, et al. The importance of the gastrorenal axis in the control of body sodium homeostasis [J]. Exp Physiol, 2016, 101(4): 465-470.
[6] Melis M, Krenning EP, Bernard BF, et al. Renal uptake and retention of radiolabeled somatostatin, bombesin, neurotensin, minigastrin and CCK analogues: species and gender differences [J]. Nucl Med Biol, 2007, 34(6): 633-641.
[7] Jiang X, Chen W, Liu X, et al. The synergistic roles of cholecystokinin B and dopamine D5 receptors on the regulation of renal sodium excretion [J]. PLoS One, 2016, 11(1): e0146641.
[8] Sève P, Isaac S, Trédan O, et al. Expression of class III β-tubulin is predictive of patient outcome in patients with non-small cell lung cancer receiving vinorelbine-based chemotherapy [J]. Clin Cancer Res, 2005, 11(15): 5481-5486.
[9] Aquila-Pastir LA, DiPaola NR, Matteo RG, et al. Quantitation and distribution of β-tubulin in human cardiac myocytes [J]. J Mol Cell Cardiol, 2002, 34(6): 1513-1523.
[10] Kruse MS, Adachi S, Scott L, et al. Recruitment of renal dopamine 1 receptors requires an intact microtubulin network [J]. Pflugers Arch - Eur J Physiol, 2003, 44(5): 534-539.
[11] 禚银玲, 郭其森. 下调βIII-tubulin逆转肺腺癌A549/Taxol细胞株紫杉醇耐药 [J]. 中国肺癌杂志, 2014, 1(8): 581-587.
[12] Amaiden MR, Santander VS, Monesterolo NE, et al. Tubulin pools in human erythrocytes: altered distribution in hypertensive patients affects Na+, K+-ATPase activity [J]. Cell Mol Life Sci, 2011, 68(10): 1755-1768.
[13] Koh TJ. Extragastric effects of gastrin gene knock-out mice [J]. Pharmacol Toxicol, 2002, 91(6): 368-374.
[14] von Schrenck T, Ahrens M, de Weerth A, et al. CCKB/gastrin receptors mediate changes in sodium and potassium absorption in the isolated perfused rat kidney [J]. Kidney Int, 2000, 58(3): 995-1003.
[15] Jiang X, Wang W, Ning B, et al. Basal and postprandial serum levels of gastrin in normotensive and hypertensive adults [J]. Clin Exp Hypertens, 2013, 35(1): 74-78.
[16] Bhattacharya R, Cabral F. A ubiquitous beta tubulin disrupts microtubule assembly and inhibits cell proliferation [J]. Mol Biol Cell, 2004, 15(7): 3123-3131.
[17] 袁致海, 贺晓生, 陈延, 等. 大鼠创伤性脑损伤后脑组织β-微管蛋白表达及意义 [J]. 中华神经外科疾病研究杂志, 2013, 12(2): 134-137.
[18] 钟雯, 曾姣娥, 文重远, 等. 糖尿病大鼠心肌β-微管蛋白的表达及缬沙坦的保护性作用 [J]. 实用医学杂志, 2011, 27(14): 2526-2528.
[19] Padia SH, Kemp BA, Howell NL, et al. Mechanisms of dopamine D1 and angiotensin AT2 receptor interaction in natriuresis [J]. Hypertension, 2012, 59(2): 437-445.
[20] Brismar H, Asghar M, Carey RM, et al. Dopamine-induced recruitment of dopamine D1 receptors to the plasma membrane [J]. Proc Natl Acad Sci U S A, 1998, 95(10): 5573-5578.
[21] Brown D. Targeting of membrane transporters in renal epithelia: when cell biology meets physiology [J]. Am J Physiol, 2000, 278(2): F192-F201.
[22] Holtback U, Brismar H, DiBona GF, et al. Receptor recruitment: a mechanism for interactions between G protein-coupled receptors [J]. Proc Natl Acad Sci U S A, 1999, 96(13): 7271-7275.
[23] Armando I, Konkalmatt P, Felder RA, et al. The renal dopaminergic system: novel diagnostic and therapeutic approaches in hypertension and kidney disease [J]. Transl Res, 2015, 165(4): 505-511.
[24] 张艳荣, 全雄志, 董伟, 等. 多巴胺D5受体转基因小鼠的建立 [J]. 中国比较医学杂志, 2008, 28(5): 54-58.
[25] Nowicki S, Kruse MS, Brismar H, et al. Dopamine-induced translocation of protein kinase C isoforms visualized in renal epithelial cells [J]. Am J Physiol, 2000, 279(6): C1812-C1818.
[26] Tripathi S, Flobak A, Chawla K, et al. The gastrin and cholecystokinin receptors mediated signaling network: a scaffold for data analysis and new hypotheses on regulatory mechanisms [J]. BMC Syst Biol, 2015, 24(7): 29-40.
