高浓度氨氮或磷胁迫对亚洲苦草生理特性的影响
2018-05-31康彩霞戴星照
康彩霞,戴星照,刘 艳
(1.华东交通大学土木建筑学院,江西 南昌 330013;2.江西省山江湖开发治理委员会办公室,江西 南昌 330046; 3.江西省环境监测中心站,江西 南昌 330039)
亚洲苦草(Vallisneriaasiatica)是一种常见的沉水植物,分布广泛,有较强的吸污能力和耐污性,且再生能力强,是治理水体富营养化的重要水生植物[10]。目前生物方法以其低成本、高效安全的特点成为控制湖泊富营养化的研究热点[11]。因此,本文以富营养化水体为研究背景,以高等水生植物亚洲苦草为研究对象,通过室内静态模拟试验,对亚洲苦草叶片中叶绿素a、蛋白质含量以及超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性进行了分析,探讨了高浓度氨氮或磷营养盐对亚洲苦草抗氧化生理系统的影响,以便阐明水生植物消失的原因,并为富营养化水体中沉水植物的恢复提供理论依据。
1 材料与方法
1. 1 试验材料与装置
(1) 试验材料:选取于水体中根系发达的成熟亚洲苦草,去除泥土和枯叶,用曝晒过的自来水充分冲洗后浸泡3 d,选取健壮并长势一致的植株用于试验。
(2) 试验装置:试验装置为体积40 L的钢化玻璃水槽,其尺寸为30 cm(长)×30 cm(宽)×45 cm(高),见图1。

图1 试验装置示意图Fig.1 Schematic diagram of the experimental device
1. 2 试验方法
1. 3 测定方法
(2) 亚洲苦草叶片中叶绿素a的浓度的测定:取2 g亚洲苦草叶子,加入10 mL丙酮,用研钵研磨成浆,在离心力为12 000×g下离心10 min,取其上清液于645 nm和663 nm波长处测定吸光度值OD645和OD663。叶绿素a的浓度采用Chl.a(mg/g鲜重)=20.21OD645-8.02OD663公式计算[12]。
(3) 亚洲苦草叶片中蛋白质含量和氧化酶活性的测定:另取2 g亚洲苦草叶子,用8 mL的50 mM的磷酸钾缓冲液研磨,再在缓冲液中加入3 mM的EDTA和0.5% (W/V)的PVP,混合液在4℃、12 000×g离心力下离心10 min,取萃取上清液测定蛋白质的含量和氧化酶的活性。蛋白质的测定根据Lowry等[13]提出的方法进行,即取0.6 mL萃取上清液稀释5倍,加入3 mL由溶于0.1 M NaOH的2% Na2CO3和溶于1%酒石酸钠的0.5% CuSO4组成的混合液,在25°C水浴中反应10 min后加入50%(V/V)Folin试剂,静置30 min,于波长750 nm处测定吸光度值,计算蛋白质的含量。蛋白质标准曲线由牛血清蛋白标准物质在相同的步骤下测定得出。SOD活性单位以抑制氮蓝四唑(NBT)光化还原的50%为一个酶活性单位表示[14];CAT活性由萃取液和过氧化氢在24 °C常压下产生的氧气量决定[15]。
1. 4 数据处理
数据以平均值±标准偏差SD标记;处理前(0 d)的数据与处理后(20 d)的数据之间的显著性差异采用统计学单因素方差分析,并采用LSD 检验进行两两比较(p<0.05)。
2 结果与分析
2. 1 水体中pH值和营养盐浓度的变化
经过20 d处理后,各试验组水体中pH值和营养盐浓度见图2和表1。
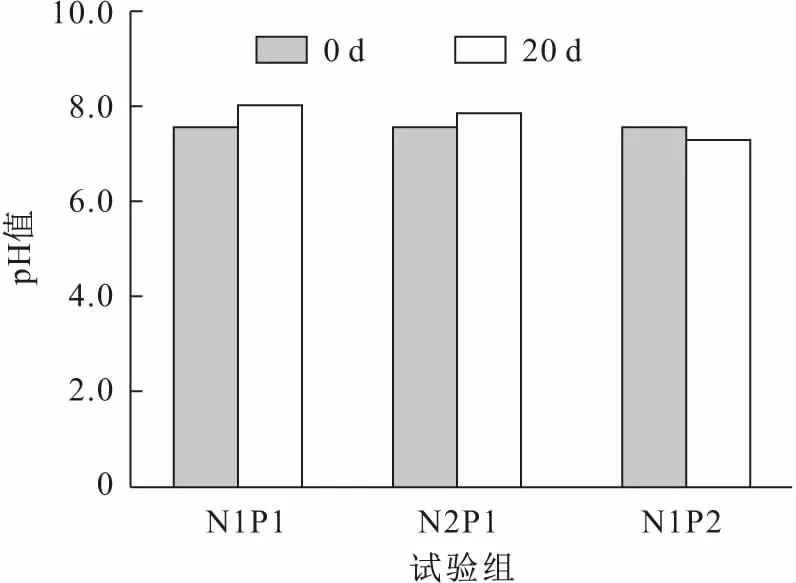
图2 试验前后各试验组水体中pH值变化Fig.2 Changes of pH at the beginning and the end of the experiments
由图2可见,各试验组水体中pH值没有显著差异,试验结束后各试验组水体中pH值在7.29~8.00之间。
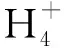
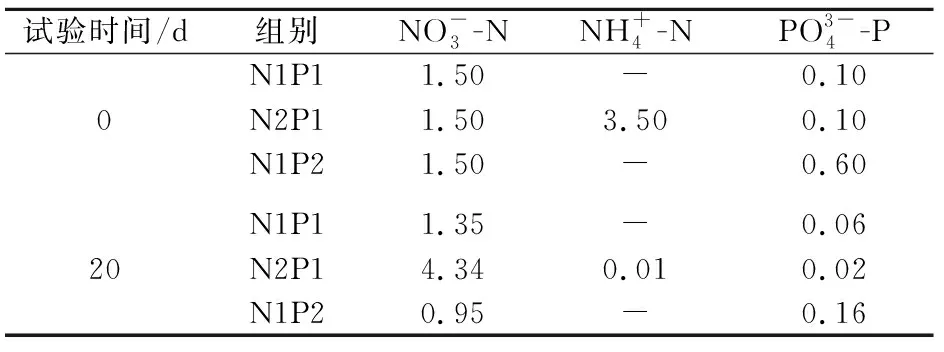
表1 试验前后各试验组营养盐的浓度(mg/L)Table 1 Concentrations of nutrients (mg/L) at the beginning and the end of the experiments
2.2 亚洲苦草叶片中叶绿素a和蛋白质含量的变化
由于本试验选取的亚洲苦草是健壮并长势一致的植株,所以在试验初期(0 d)其叶片中的叶绿素a和蛋白质含量基本一致。经过20 d处理后,亚洲苦草叶片中叶绿素a的含量明显上升,但与亚洲苦草适宜生存的中浓度氮磷营养盐(N1P1组)相比,高浓度氨氮(N2P1组)和高浓度磷(N1P2组)处理后的亚洲苦草叶片中叶绿素a含量的上升量要显著减小,各试验组之间均存在显著性差异(见图3)。与处理前相比,中浓度氮磷营养盐与高浓度氨氮营养盐处理后的亚洲苦草叶片中蛋白质含量没有显著性差异,见图4。
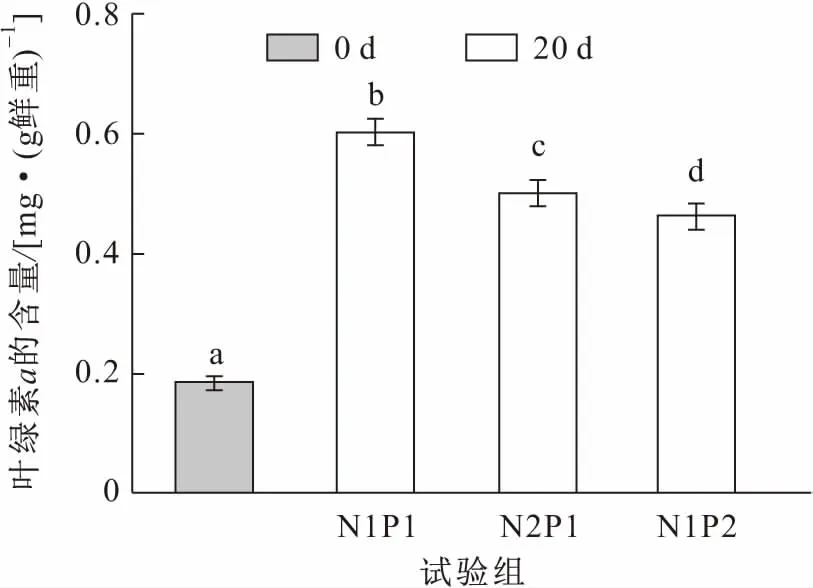
图3 试验前后各试验组亚洲苦草叶片中叶绿素a含量的变化Fig.3 Changes of chlorophyll a content in the leaves of V.asiatica at the beginning and the end of the experiments

图4 试验前后各试验组亚洲苦草叶片中蛋白质含量的变化Fig.4 Changes of protein contents of in the leaves of V.asiatica at the beginning and the end of the experiments
2. 3 亚洲苦草体内SOD和CAT活性的变化
试验前后各试验组亚洲苦草体内SOD和CAT活性的变化见图5和图6。
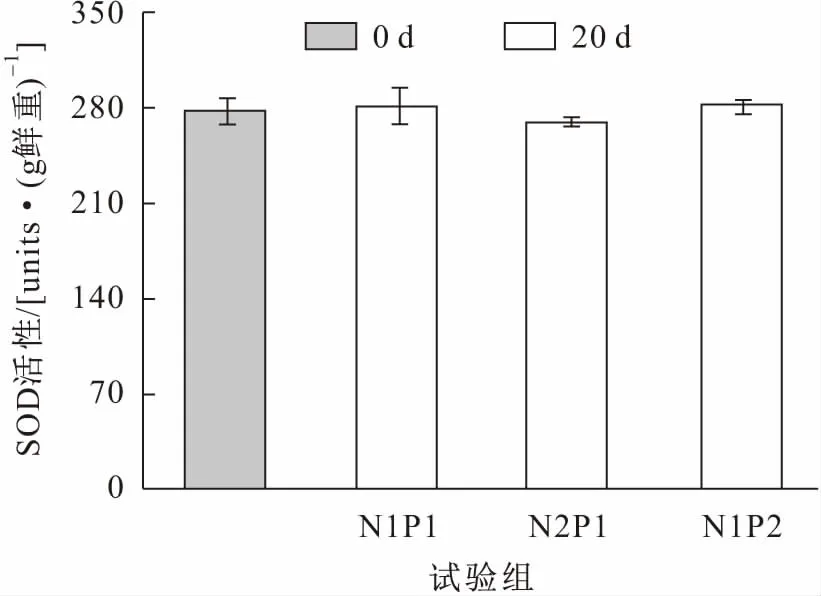
图5 试验前后各试验组亚洲苦草叶片中SOD活性的变化Fig.5 Changes of SOD activities in the leaves of V.asiatica at the beginning and the end of the experiments
由图5可见,各试验组的亚洲苦草体内SOD活性与试验初期相比无任何明显变化。
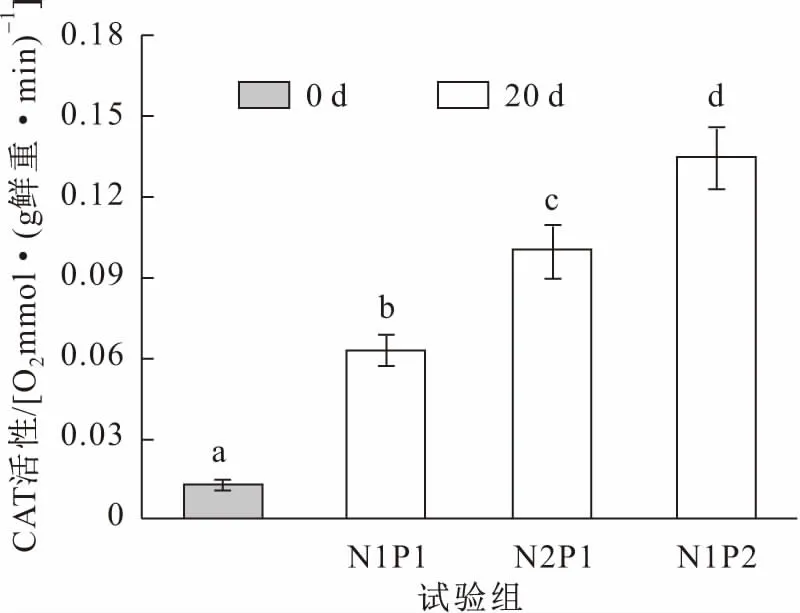
图6 试验前后各试验组亚洲苦草体内CAT活性的变化Fig.6 Changes of CAT activities in the leaves of V.asiatica at the beginning and the end of the experiments
由图6可见,各试验组的亚洲苦草体内CAT活性与试验初期相比明显上升,且高浓度氨氮(N2P1组)和高浓度磷(N1P2组)处理过的亚洲苦草体内CAT活性要比中浓度营养盐(N1P1组)处理过的亚洲苦草明显高很多。
3 讨 论
水生植物可以生存的pH值范围为4~12,适合生长的pH值范围为6~10[16]。本试验中,pH值在7.52~8.00之间变化,因此营养盐浓度是影响亚洲苦草生长的唯一因素。
3. 1 营养盐对亚洲苦草代谢反应的影响
氮是植物叶绿素的重要组成成分,磷在植物体内也参与光合作用及细胞分裂等其他一些过程,所以氮、磷的补充可以促进植物的生长。经过20 d处理后,亚洲苦草叶片中叶绿素a的含量有明显上升,表明中浓度氮、磷营养盐可以促进亚洲苦草的生理代谢;但随着氨氮或磷浓度的增加,亚洲苦草叶片中叶绿素a的含量与中浓度营养盐处理后的相比有所下降,表明高浓度氨氮或高浓度磷会抑制亚洲苦草的新陈代谢。叶绿素是植物进行光合作用必不可少的物质,而光合作用是植物体内极为重要的代谢过程,其作用强弱对植物生长及抗逆性具有十分重要的影响[17],因此叶绿素a含量的高低在很大程度上反映了植株的生长状况和光合作用的效率[17]。环境胁迫可使叶绿素a的含量降低。经中浓度营养盐处理后,亚洲苦草叶片中叶绿素a的含量显著增加,表明中浓度氮磷营养盐可以促进亚洲苦草的光合作用,但随着氨氮或磷浓度的增加,亚洲苦草光合作用系统受到损伤,光合作用效率受到抑制,这可能是因为高浓度氨氮或高浓度磷会胁迫亚洲苦草产生大量的活性氧,从而对叶绿体结构有损害作用。
植物新陈代谢涉及到的酶绝大多数属于蛋白质,所以植物体内蛋白质含量常被作为指示外界环境对植物生理影响的指标[17]。本试验中,各试验组之间亚洲苦草体内的蛋白质含量没有显著性差异,可能是因为处理时间仅为20 d,在短时间内亚洲苦草体内蛋白质的含量无法表现出明显的区别,而在长时间的高浓度氨氮或磷胁迫下可能会造成亚洲苦草体内蛋白质含量的下降。本试验结果证明了富营养化水体中高浓度营养盐是亚洲苦草和其他沉水植物大量衰退的主要原因之一,这与吴义锋等[18]的研究结果基本一致。
3. 2 营养盐对亚洲苦草抗氧化反应的影响
经高浓度营养盐处理后亚洲苦草体内CAT活性急剧上升,表明亚洲苦草受到高浓度营养盐的胁迫。活性上升的CAT和基本不变的SOD显示亚洲苦草通过提升自身的CAT酶活性来适应逆境胁迫[19],且CAT比SOD对于高浓度营养盐的胁迫更加敏感。SOD和CAT作为亚洲苦草自身保护系统的重要组成部分,可以保持活性氧在其产生和清除之间处于动态平衡,避免活性氧过量对植物造成的伤害。SOD通过歧化反应可将有害的超氧自由基转化为过氧化氢;尽管过氧化氢仍是对有机体有害的活性氧,但是CAT会立即将其分解为完全无害的水[20]。本试验中亚洲苦草体内SOD活性基本没有变化,未被SOD歧化降解的超氧自由基可以通过Haber-Weiss反应转化为毒性更强的羟自由基[21]。所以,高浓度氨氮或高浓度磷对亚洲苦草造成伤害可能一部分归因于超氧自由基和过氧化氢,另一部分则归因于毒性更大的羟自由基。在经过20 d处理后,亚洲苦草体内CAT活性急剧上升,表明在遭受高浓度氨氮或高浓度磷胁迫时,亚洲苦草体内保护酶系统启动,以抵御外界环境胁迫对亚洲苦草造成的氧化损伤。亚洲苦草对氮、磷营养盐的抗氧化反应机理见图7。
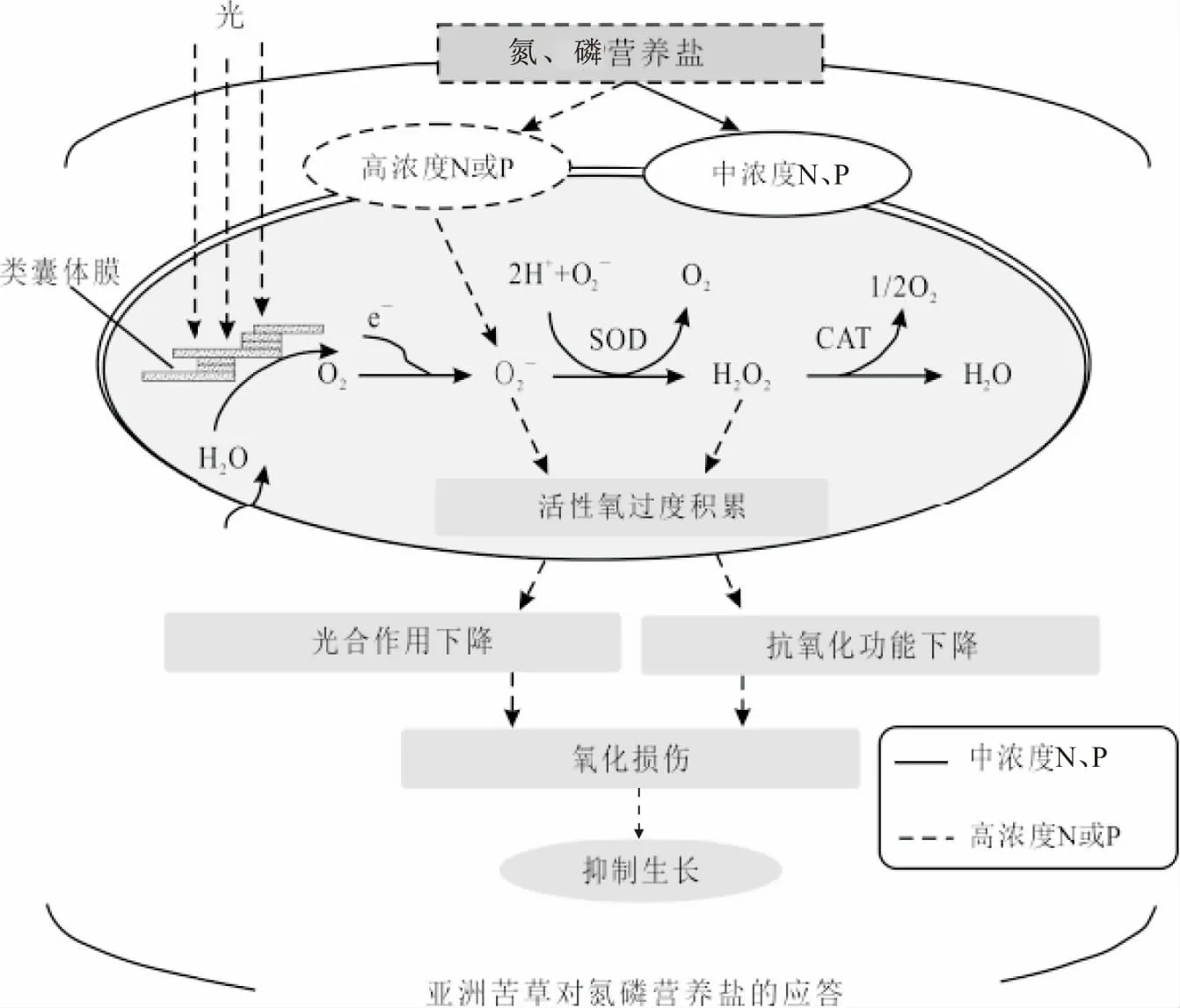
图7 亚洲苦草对氮、磷营养盐的抗氧化反应Fig.7 Antioxidant responses of V.asiatica to N and P nutrients
3. 3 营养盐对亚洲苦草生理反应的影响
由图7可知,中浓度的氮、磷营养盐可以促进亚洲苦草的生长。亚洲苦草在正常的有氧代谢过程中,不可避免地会产生活性氧,SOD和CAT发挥其清除过剩活性氧的功能使亚洲苦草体内活性氧在产生和清除之间维持动态平衡。充足的营养盐能保证亚洲苦草进行正常的光合作用,体内叶绿素a和蛋白质含量有所提高,生长健康。但是,随着氨氮或磷浓度的提高,亚洲苦草受到一定的胁迫,CAT活性明显提高以抵御外界的胁迫,但是抗氧化能力有限,活性氧的动态平衡被打破,产生的大量剩余活性氧对亚洲苦草造成了严重的氧化损伤,亚洲苦草的光合作用功能下降,其体内叶绿素a和蛋白质含量相对于中浓度氮、磷营养盐处理后的含量明显降低,表明高浓度氨氮或高浓度磷会对亚洲苦草产生胁迫,影响亚洲苦草的健康生长。因此,为了减少对亚洲苦草的氧化损伤,在富营养化水体中恢复沉水植物亚洲苦草时,对氮、磷营养盐进行双重控制是非常必要的。
另外,在贫营养水体中,沉水植物可以直接从水层和底泥中吸收氮、磷营养盐,降低水体中的氮、磷营养物质的浓度,从而抑制藻类生长[22]。随着水体中营养盐浓度的增加,藻类大量繁殖,从而对沉水植物产生遮光效应,同时形成的低CO2环境也会抑制沉水植物的生长[23]。虽然在本试验期间试验水槽中没有藻类生长,但在富营养化水体中恢复沉水植物时仍要注意藻类的生长繁殖对其生长的影响。
4 结 论
(1) 对于中高浓度氮、磷营养盐的胁迫,CAT比SOD更为敏感,亚洲苦草可以通过提高CAT活性来抵御外界环境的胁迫。
(2) 对于高浓度氨氮或高浓度磷胁迫,亚洲苦草的抗氧化保护系统虽然被激活,但是不能保证亚洲苦草的代谢系统免受损伤,直接危害表现为亚洲苦草叶片中叶绿素a的含量明显下降。
(3) 富营养化水体中沉水植物消失的重要原因之一是氮、磷营养盐浓度的增加,所以在富营养化水体中恢复沉水植物亚洲苦草时,对氮、磷营养盐进行双重控制是至关重要的。
参考文献:
[1] 何俊,谷孝鸿,刘国锋.东太湖水生植物及其与环境的相互作用[J].湖泊科学,2008,20(6):790-795.
[2] 楚建周,王圣瑞,金相灿,等.底质营养状况对黑藻生长及光合作用的影响[J].生态环境,2006,15(4):702-707.
[4] Nimptsch J,Pflugmacher S.Ammonia triggers the promotion of oxidative stress in the aquatic macrophyteMyriophyllummattogrossense[J].Chemosphere,2007,66:708-714.
[5] Wang X L,Lu Y L,He G Z,et al.Multivariate analysis of interactions between phytoplankton biomass and environmental variables in Taihu Lake,China[J].Environ.Monit.Assess.,2007,133:243-253.
[6] Zhu G W,Qin B Q,Gao G,et al.Effects of hydrodynamics on phosphorus concentrations in water of Lake Taihu,a large,shallow,eutrophic lake of China[J].Hydrobiologia,2007,581:53-61.
[7] 朱广伟.太湖富营养化现状及原因分析[J].湖泊科学,2008,20(1):21-26.
[8] 简敏菲,简美锋,李玲玉,等.鄱阳湖典型湿地沉水植物的分布格局及其水环境影响因子[J].长江流域资源与环境,2015,24(5):765-772.
[9] 毛玉婷,周晓宇,王毛兰.枯水期鄱阳湖水体富营养化状态评价[J].南昌大学学报(理科版),2014,38(6):596-599.
[10]孙祥钟,王徽勤,李清义,等.中国植物志[M].北京:科学出版社,1992:176-186.
[11]胡光济,张维昊.湖泊水华生物防治技术研究进展[J].安全与环境工程,2008,15(3):36-40.
[12]Arnon D I.Copper enzymes in isolated chloroplast:Polyphenoloxidase inBetavulgaris[J].PlantPhysiology,1949,24:1-15.
[13]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J].BiologicalChemistry,1951,193:265-275.
[14]Beauchamp C,Fridovich I.Superoxide dismutases:Improved assays and an assay applicable to acrylamide gels[J].AnalyticalBiochemistry,1971,44:276-287.
[15]Greenfield R E,Price V E.Liver catalase Ι:A manometric determination of catalase activity[J].BiologicalChemistry,1954,209:355-361.
[16]杨旻,吴小刚,张维昊,等.富营养化水体生态修复中水生植物的应用研究[J].环境科学与技术,2007,30(7):98-102,121.
[17]Wang C,Zhang S H,Wang P F,et al.Metabolic adaptations to ammonia-induced oxidative stress in leaves of the submerged macrophyteVallisnerianatans(Lour.) Hara[J].AquaticToxicology,2008,87:88-98.
[18]吴义锋,吕锡武,薛联青.水体富营养化驱动因子粗糙分析[J].安全与环境工程,2005,12(4):11-14.
[19]Cao T,Ni L Y,Xie P.Acute biochemical responses of a submersed macrophyte,PotamogetoncrispusL.,to high ammonium in an aquarium experiment[J].JournalofFreshwaterEcology,2004,19(2):279-284.
[20]Mishra S,Srivastava S,Tripathi R D,et al.Lead detoxification by coontail (CeratophyllumdemersumL.) involves induction of phytochelatins and antioxidant system in response to its accumulation[J].Chemosphere,2006,65:1027-1039.
[21]Yu B P.Cellular defenses against damage from reactive oxygen species[J].PhysiologicalReviews,1994,74:139-162.
[22]Pflugmacher S,Jung K,Lundvall L,et al.Effects of cyanobacterial toxins and cyanobacterial cell-free crude extract on germination of alfalfa (Medicagosativa) and induction of oxidative stress[J].EnvironmentalToxicologyandChemistry,2006,25:2381-2387.
[23]Simpson P S,Eaton J W.Comparative studies of the photosynthesis of the submerged macrophyteElodeacanadjensisand the filamentous algaeCladophoraglomerataandSpirogyrasp.[J].AquaticBotany,1986,24:1-12.
