多环芳烃污染土壤化学修复技术的研究进展
2018-05-31潘栋宇侯梅芳刘超男刘德洪
潘栋宇,侯梅芳,刘超男,郑 琛,刘德洪
(1.广东省生态环境技术研究所,广东 广州 510650;2.上海应用技术大学,上海 201418;3.湖南省环境监测中心站,湖南 长沙 410019)
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是一类含有两个或两个以上苯环的碳氢化合物,具有致癌、致畸、致突变性[1-3],其主要来源于生物质燃料和化石燃料的不完全燃烧[4-5]。PAHs多为非极性化合物,具有很高的稳定性,且熔点高、蒸汽压和水溶性低,难于被降解[6]。PAHs的疏水性使其易吸附于固体颗粒和水体沉积物中,能够长期存在于自然环境中[7]。另外,PAHs能在动植物体内积累,并可通过大气进行远距离迁移[8]。人和动物长期暴露在含PAHs的环境中,生命健康将会受到严重威胁,美国环境保护署和欧盟已将PAHs列入优先控制污染物[9-10]。由于工业化的快速发展,煤和石油资源大量被开采和使用,导致全球范围内环境中的PAHs浓度不断升高,我国环境中PAHs的污染状况也日益严峻。2003年,我国环境中PAHs的总排放量约为25 300 t,其中生物质燃料排放占60%,家庭燃煤排放占20%,焦化工业类排放占16%[11]。2007年,我国家庭燃煤排放量仍高于4 000 t[12]。长期大量排放的PAHs在干沉降和湿沉降的作用下富集在土壤中,导致土壤中PAHs浓度不断上升,如南京某冶炼企业周边农田土壤中PAHs的浓度高达31.08 mg/kg[13],因此急需寻求有效的方法对其进行治理。鉴于此,本文对PAHs污染土壤的化学修复技术的研究进展进行了综述。
1 PAHs污染土壤常用的修复技术
目前常用的PAHs污染土壤修复技术有物理修复技术、生物修复技术和化学修复技术。其中,物理修复技术主要是采用各种不同的物理手段将土壤中各种有机物去除或分离,如蒸汽抽提技术、超临界萃取技术、热脱附技术等,此类修复技术成本较高,而且只是将污染物进行了相转移,并未真正地从环境中消除该类污染物;生物修复技术又分为植物修复技术和微生物修复技术,植物修复技术主要利用植物及其根部对土壤中的污染物进行转移、降解,包括吸收和代谢、挥发和吸附、根际分泌物降解等[14],而微生物修复技术是指在适宜的环境条件下,利用经过培养驯化的土著微生物或引入具有特定降解效果的外源性微生物将土壤中有毒物质降解成低毒或无毒物质的生物修复技术[15],此类修复技术虽然成本低,但易受土壤土质以及环境等因素的影响,有时降解产物的毒性比原污染物毒性更高;化学修复技术是指利用一些化学物质的氧化、还原和催化等性能将土壤中污染物质转化或降解为低毒或无毒物质,此类修复技术无论是在有机物还是无机物污染修复方面都已有广泛的应用。
2 PAHs污染土壤的化学修复技术
目前PAHs污染土壤的化学修复技术主要有化学氧化法、光催化氧化法、电化学修复法、声化学修复法和机械化学法等,本文总结了近年来这些方法在降解土壤中PAHs方面的研究进展。
2. 1 化学氧化法
化学氧化法主要是利用氧化剂的氧化性或者其分解产生的自由基的强氧化性,破坏有机污染物的分子结构,使高毒性污染物转变为低毒或无毒物质,该类方法具有污染物降解速度快、降解彻底等优点。目前常见的化学氧化法有Fenton法、类Fenton法、H2O2氧化法、O3氧化法、高锰酸盐氧化法和过硫酸盐氧化法等。
2.1.1 Fenton法
在19世纪90年代,法国科学家Fenton[16]发现Fe2+和H2O2共存的酸性水溶液可以有效氧化酒石酸,后人为纪念这一发现,将Fe2+/H2O2命名为Fenton试剂,由Fenton试剂参与的反应称为Fenton反应。在Fe2+/H2O2体系中,H2O2在Fe2+的催化作用下被分解,并产生羟基自由基(·OH)[17]:
Fe2++H2O2→·OH+OH-+Fe3+
(1)
而·OH具有强氧化能力和亲电子能力,可以将有机物分子氧化成CO2和H2O等无机小分子化合物。众多研究表明,Fenton法在降解有机污染物方面具有很好的效果[18-19]。对于PAHs污染土壤的修复,Fenton法也表现出较为突出的降解效果。如Bavel[20]的研究发现,利用Fenton法在343K、pH值为3的条件下处理PAHs浓度范围为140~9 300 mg/kg的污染土壤,其去除率为40%~86%。
Fenton法在实际应用中具有氧化反应速率快、设备简单、操作方便、效率高等优点,但同时也存在一定的缺陷,如H2O2消耗量大且难以充分利用,在pH值为2.0~6.0的酸性条件下才具有明显的活性等。
2.1.2 类Fenton法
类Fenton法是指利用含铁的针铁矿、磁铁矿等无机/有机材料或者Fe3+的盐溶液等代替Fenton试剂中所使用的Fe2+来分解H2O2,产生·OH。随着研究的深入,后人在传统的Fenton法的基础上应用光、电、微波等辅助手段促使Fenton反应,由此衍生出光-Fenton法、电-Fenton法、微波-Fenton法等类Fenton法。类Fenton法与传统Fenton法相比,具有更高的污染物降解效率。如Baldrian等[21]采用金属螯合物与H2O2组成的类Fenton反应体系降解PAHs,试验结果表明该体系不仅能有效去除PAHs,而且还具有循环催化效果以及更广的pH值适应范围;Iglesias等[22]采用电-Fenton法处理海洋底泥中的菲,并加入表面活性剂吐温80,经1 d反应后,菲的降解率达到了92%。
类Fenton法与传统Fenton法相比,前者拓宽了活化H2O2反应的pH值范围,因而具有更好的应用前景,但由于类Fenton法仍以H2O2作为氧化剂,因此H2O2消耗量大的问题依然存在。
2.1.3 H2O2氧化法
H2O2是一种强氧化剂,通常用作漂白剂和消毒剂,其与有机污染物反应后的产物为H2O和O2,不会引起二次污染,是一种“绿色”的高效氧化剂,自身分解产生的·OH具有非选择性强氧化性,能与大多数有机污染物进行反应,已被广泛应用于环境领域[23],但H2O2的稳定性差,易分解成H2O和O2:
2H2O2→2H2O+O2
(2)
从而影响了H2O2对环境中有机污染物的去除效果,因此在选择H2O2作氧化剂时,可以通过添加催化剂或采用紫外线照射、超声等手段加速H2O2分解,以提高·OH的产率,来强化H2O2的修复效果。如Gabriel等[24]以Cu2+作为催化剂组成Cu2+/H2O2体系来降解芘、菲和荧蒽,结果发现经Cu2+/H2O2体系处理后,芘、菲和荧蒽的降解率均超过了80%。
H2O2氧化法对土壤酸碱度和土壤类型要求较低,能适用于大多数PAHs污染土壤的修复。但由于H2O2可与多种金属(如Mn、Pb、Au、Fe)化合物发生催化氧化反应,且在光照条件下或贮存在表面粗糙的容器(具有催化活性)都会引起H2O2分解,因此在实际应用过程中,H2O2溶液的安全存放和预防H2O2分解是非常重要的问题。
2.1.4 O3氧化法
臭氧(O3)在水中的氧化还原电位为2.07 V,具具有极强的氧化能力,常用作消毒剂。O3因其强氧化能力而在去除无机污染物和有机污染物方面均有良好的效果[25],尤其对低挥发性和不挥发性有机污染物的处理更是表现出巨大的潜力。O3在水相氧化污染物的过程中会发生链式自分解反应,并产生·OH,该反应速率受pH值影响,即pH值越高,自分解速率越快[26]。因此,O3不但可以利用自身的强氧化性来直接对污染物进行氧化,还能通过其分解产生的·OH来间接氧化污染物:
污染物+O3→产物
(3)
污染物+·OH→产物
(4)
如O’mahony等[27]采用O3处理不同类型的含菲土壤,结果表明在相同的条件下各类土壤中菲的去除率都达到了50%以上,而砂质土壤中菲的去除率更是高达85%,其原因在于砂质土壤中含有更多的空隙可供O3流动和传递;Yu等[28]研究发现,O3能高效去除土壤中C12~C24范围内的无挥发性柴油有机物(Diesel Range Organics,DRO),当DRO浓度为1 485 mg/kg的土壤经(119±6) mg/L的O3在流速为50 mL/min的条件下处理14 h,DRO的去除率达到了94%。
除了以单一的O3氧化去除污染物外,还可以结合超声和紫外线照射等物理手段,来获得更加突出的污染物去除效果。如Garoma等[29]采用O3/UV技术对地下水中汽油成分(BTEX、MTBE和TBA)进行处理,结果表明地下水中99%以上的汽油成分得到了有效去除。
O3本身具有很高的氧化电位,对难降解有机物的降解能力较强,但在土壤修复过程中由于需要以土壤中的空隙作为O3流动和传递的途径,才能与污染物充分接触反应,因此在实际应用过程中O3氧化法在砂质类污染土壤修复中会表现出更明显的修复效果。但O3对各种金属和非金属具有较强的腐蚀性,故在实际应用过程中对设备的耐蚀性要求较高。
2.1.5 高锰酸盐氧化法
高锰酸盐氧化法具有操作简单、适用范围广、修复效率高等优点,而高锰酸盐在酸性条件下的强氧化性使得其在酸性类PAHs污染土壤的修复中具有潜在的优势。但在应用高锰酸盐进行土壤修复时,须确定最佳高锰酸盐的投加量,若投加过量,则可能导致土壤板结,而且还会增加土壤中Mn的含量,进而可能对地下水造成污染。因此,从安全的角度考虑,应用高锰酸盐氧化法进行土壤修复时,需要通过试验确定高锰酸盐的最佳投加量。
2.1.6 过硫酸盐氧化法

(5)
(6)


2.1.7 其他化学氧化法
除了以上所列的化学氧化法外,还可将高铁酸盐、ClO2、次氯酸盐等氧化剂应用于PAHs污染的水土修复中。如Tan等[36]采用K2FeO4降解pH值为9.5的水溶液中的菲,经氙灯照射反应60 min后,菲的去除率为65.5%;Liu等[37]采用ClO2降解水中的蒽、芘和苯并[a]蒽,结果显示三者的去除率可高达99.0%、67.5%和89.5%;Nakamura等[38]采用NaClO降解PAHs,当水环境pH值为5时,硅胶中的芘、芴和荧蒽的回收率分别为0%、0%和5%,虽然PAHs的回收率低,但大多数PAHs并未被矿化,只是转化成了Cl取代物(Clx-PAHs),因此采用次氯酸盐处理PAHs存在一定的环境风险。
2. 2 光催化氧化法
光催化氧化法是利用光辐射在光催化剂表面产生的活性自由基来降解有机污染物的环境污染修复技术,具有氧化性强、净化彻底和“绿色”环保等优点。目前常用的光催化剂有TiO2、ZnO、α-Fe2O3、ZnS和CdS等。此外,人们为了追求更好的光催化效果,通过掺杂过渡金属[39]或贵金属[40]、采用染料光敏化作用[41]、光催化材料复合[42]等手段来提高光催化剂的氧化性能。如Kohtani等[43]采用Ag负载BiVO4对PAHs进行光催化降解试验,结果发现Ag-BiVO4对蒽的光催化降解速率高于BiVO4,苯并[a]蒽经Ag-BiVO4光催化8 h后,其去除率达75%;Kou等[44]采用Pt负载TaON对PAHs进行光催化降解试验,结果发现Pt-TaON对菲、蒽、苊、苯并[a]蒽和芘的光催化降解速率比TaON高出10倍,其中菲、苯并[a]蒽、苊和蒽经Pt-TaON光催化2 h、3 h、4 h、6 h后均被完全氧化。
此外,Kohtani等[43]、Kou等[44]和Jia等[45]对PAHs的光催化降解机理进行了研究和分析,结果表明水相中光催化剂经光照后产生的·OH会与PAHs反应生成羟基取代物 (OH)x-PAHs,羟基取代物在脱氢作用下形成醌类物质(如蒽醌和菲醌),随后进一步发生开链、加氢和脱水等反应而被分解和净化。图1表示了光催化降解蒽的一般途径。
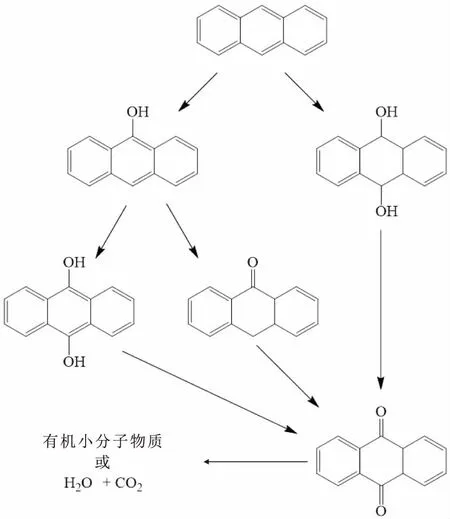
图1 光催化降解蒽的一般途径Fig.1 General degradation pathway of phenanthrene by photocatalysis
光催化氧化法具有反应条件温和、氧化能力强、绿色无污染等优点,但由于紫外光的吸收范围较窄,光能利用率较低,且土壤对光的通透性差,其光催化效果受到一定的影响,因此在实际的土壤修复中,该法往往耗能较大,其修复效果不理想。
2. 3 电化学修复法
利用电化学对土壤进行修复一般都是以电动提取为主,其机理为电极与土壤中的水发生电解反应:
正极:2H2O→O2+4H++4e-
(7)
负极:4H2O+4e-→2H2+4OH-
(8)
正极析出O2、产生H+使环境酸化,负极析出H2、产生OH-使环境碱化,水相中的阴、阳离子在电场作用下迁移到相反的带电电极形成电迁移,水本身也会进行迁移形成电渗析作用,土壤中的污染物在电迁移和(或)电渗析作用下迁移到电极室而被收集去除[46]。
由于PAHs具有疏水性,解吸速率慢,传统的电动修复难以实现对PAHs污染土壤的修复,因此可通过添加共溶剂、表面活性剂和环糊精来提高PAHs的解吸率。表面活性剂虽然可以提高PAHs的解吸率,但随着其浓度的增加会降低电渗析流速,进而影响PAHs的修复效果[47],一般可采用控制pH值和投加电解质的方法来提高电渗析速率,从而提高PAHs的修复效果[48]。如Alcántara等[47]研究了电动修复菲污染土壤,采用40%乙醇和0.1 mol/L Na2SO4作冲洗液,土壤中菲的去除率可超过95%;Hahladakis等[49]研究发现,新型非离子表面活性剂Poloxamer 407和Nonidet P40对电动修复PAHs污染土壤有明显的促进作用,两者参与的电动修复对PAHs的去除率分别达到了43%和48%,其中芴的去除率分别达到了84%和92%。
电化学修复法是使用最洁净的“电子”为反应试剂,不会引起二次污染,同时该方法具有安全、操作简便和易控制等优点。但电化学修复法存在如下问题:①能耗高、电流效率低、运行费用大等;②受土壤理化性质影响大,包括土壤吸附、离子交换、缓冲能力等;③电极表面由于反应物及反应中间产物的吸附,导致电极易失活,降低了电极的分解效率,同时也缩短了电极的使用寿命。这些问题都严重地限制了电化学修复法的发展与应用。
2. 4 声化学修复法
声化学是指利用超声波辐射提高化学反应效率和产率的一门新型交叉学科,其在环境污染修复中的应用被称之为声化学修复技术。目前对于声化学修复机理的解释存在4种不同的理论:热点理论、电学理论、等离子体放电理论和超临界理论,但在科学研究中大多采用热点理论[50]。热点理论认为:超声波辐射液体时,液体中溶剂受到绝热压缩和稀释,在声波稀释区,由于压力降低,会产生微泡,微泡不断吸收周围液体蒸气或气体而膨胀变大;在声波压缩区,微泡很快破裂、崩溃,并在崩溃瞬间会产生极其短暂的局部强压力脉冲和高温,其压力高达1 000 atm(1 atm=101 325 Pa),温度达5 000 K[51-52];在空化效应下形成的高温高压环境,可使水分子裂解成具有高活性的自由基·OH和·H[53-54]:
H2O →·OH +·H
(9)
这些自由基能够驱动很多氧化还原反应,可与无机物和有机物进行快速反应[55]。
在环境领域,声化学降解污染物可分为·OH氧化和热解两种途径,其中疏水性和挥发性物质在气液相交界面和微泡里面被·OH氧化和热解,而亲水性和无挥发性物质则聚集在液相被·OH氧化[50]。由于PAHs具有疏水性和半挥发性,因而可认为在声化学降解PAHs时部分PAHs会通过热解被去除[56]。如Psillakis等[57]研究发现,声化学降解PAHs的效率会随着超声波能量和频率的增强、温度的升高以及反应时间的延长而提高。
尽管单独使用超声波降解污染物具有设备简单、操作容易、适用范围广等优点,但从能量角度来看,该方法并不经济,存在能耗大、费用高、降解不彻底等问题。
在土壤修复过程中,单一的声波能量对PAHs的去除仍以解吸为主,为了实现PAHs的真正降解,可加入强氧化性物质或者与其他修复技术联用,以产生高浓度的·OH来对PAHs进行氧化。
2. 5 机械化学法
机械化学法降解有机污染物是利用机械力引发化学降解反应,使有机污染物得以去除的污染修复技术,可用于持久性有机污染物的降解。如Joseph-ezra等[58]对含PAHs的磁铁矿、水钠锰矿、Na-蒙脱石和Cu-蒙脱石进行研磨并设置无研磨对照组,试验结果表明:研磨组和对照组水钠锰矿和Na-蒙脱石中的芘均没有变化,磁铁矿中的芘去除率为50%,Cu-蒙脱石中的芘经研磨5 min后的去除率与对照组相同(约25%);经过更长时间的研磨(24 h),研磨组Cu-蒙脱石中的芘没有取得进一步的去除效果,而对照组中芘的去除率达到40%;由此得出研磨对磁铁矿中的芘有去除效果,对Cu-蒙脱石中的芘的去除有抑制作用。
虽然目前机械化学法降解土壤中PAHs已经取得了一些成果,但是其降解机制尚不明确,由于只对土壤中极少数的PAHs进行了降解试验研究,其结论是否具有普遍性还有待进一步验证。
3 土壤环境因素对PAHs污染土壤化学修复效果的影响
以上诸多化学修复技术对土壤中PAHs的去除效果不仅与技术本身有关,还受土壤环境中各种因素的影响,如土壤的酸碱度、湿度、温度、有机质含量等。
对于化学氧化法中Fenton试剂、过硫酸盐和高锰酸盐氧化剂,土壤的酸碱度对它们的修复效果有着重要的影响,与中性或碱性环境相比,三者在土壤酸性环境下对PAHs会表现出更好的降解效果。
土壤的湿度会影响PAHs的解吸率和土壤的孔隙率。一方面,适当增加土壤的含水率有利于PAHs的解吸,提高PAHs与氧化剂之间的接触几率,促进PAHs的降解;另一方面,土壤含水率的增加会降低土壤的孔隙率,阻碍气体氧化剂(如O3)在土壤中的传递,减少气体氧化剂与PAHs的接触机会,从而影响修复效果。
土壤环境温度的高低对PAHs的解吸和氧化剂活性均会产生一定的影响,温度的升高会加快PAHs的解吸,提高氧化剂的活性,有利于PAHs的降解。
土壤中的有机质和污染物均能与氧化活性物质发生反应,因而两者之间会形成竞争性关系。土壤有机质含量越高,氧化活性物质的消耗越多,污染物的降解效率也就越低。
4 研究展望
国内对PAHs污染土壤的化学修复技术研究起步较晚,很多技术都还处于初始研究阶段,因而发展化学修复技术在实际土壤修复中的应用具有重大的意义。化学氧化法具有便捷、降解效率高的特点,但在实际修复中氧化剂投加量大;光催化氧化法可以利用太阳能进行土壤修复,但在原位修复中却无法对深层土壤进行修复;电化学修复法和声化学修复法属“绿色”修复技术,二次污染风险小,但能源消耗大;机械化学法已进入研究阶段,但技术尚不成熟。
目前PAHs污染土壤的化学修复技术在以下几个方面还需要深入研究:①研究各种化学修复技术对土壤中各种PAHs的降解机理;②采用两种或者多种化学修复技术联用来处理土壤中目标污染物;③研发成本低、效率高的氧化剂、催化剂;④设计高级修复设备和工艺,提高修复效果,并降低修复成本。相信随着科学研究的不断深入和创新以及实际应用技术的改进,化学修复技术将会在PAHs污染土壤的修复中发挥越来越重要的作用。
参考文献:
[1] Baird W M,Hooven L A,Mahadevan B.Carcinogenic polycyclic aromatic hydrocarbon-DNA adducts and mechanism of action[J].EnvironmentalandMolecularMutagenesis,2005,45(2/3):106-114.
[2] Billiard S M,Meyer J N,Wassenberg D M,et al.Nonadditive effects of PAHs on early vertebrate development:Mechanisms and implications for risk assessment[J].ToxicologicalSciences,2008,105(1):5-23.
[3] Sakai M,Yoshida D,Mizusaki S.Mutagenncity of polycyclic aromatic-hydrocarbons and quinones on salmonella-typhimurium-TA97[J].MutationResearch,1985,156(1/2):61-67.
[4] 张勇,刘浩,张家泉,等.黄石市夏季大气颗粒物中多环芳烃污染特征解析[J].安全与环境工程,2014,21(2):28-31.
[5] Shen G,Tao S,Chen Y,et al.Emission characteristics for polycyclic aromatic hydrocarbons from solid fuels burned in domestic stoves in rural china[J].EnvironmentalScience&Technology,2013,47(24):14485-14494.
[6] Vela N,Martínez-menchón M,Navarro G,et al.Removal of polycyclic aromatic hydrocarbons (PAHs) from groundwater by heterogeneous photocatalysis under natural sunlight[J].JournalofPhotochemistryandPhotobiologyA:Chemistry,2012,232:32-40.
[7] Jonsson S,Persson Y,Frankki S,et al.Degradation of polycyclic aromatic hydrocarbons (PAHs) in contaminated soils by Fenton’s reagent:A multivariate evaluation of the importance of soil characteristics and PAH properties[J].JournalofHazardousMaterials,2007,149(1):86-96.
[8] Rivas J,Gimeno O,De La Calle R G,et al.Remediation of PAH spiked soils:Concentrated H2O2treatment/continuous hot water extraction-oxidation[J].JournalofHazardousMaterials,2009,168(2/3):1359-1365.
[9] Wild S R,Jones K C.Polynuclear aromatic hydrocarbons in the United Kingdom environment:A preliminary source inventory and budget[J].EnvironmentalPollution,1995,88(1):91-108.
[10]Henner P,Schiavon M,Morel J L,et al.Polycyclic aromatic hydrocarbon (PAH) occurrence and remediation methods[J].Analusis,1997,25(9/10):M56-M59.
[11]Xu S S,Liu W X,Tao S.Emission of polycyclic aromatic hydrocarbons in China[J].EnvironmentalScience&Technology,2006,40(3):702-708.
[12]Huang W,Huang B,Bi X,et al.Emission of PAHs,NPAHs and OPAHs from residential honeycomb coal briquette combustion[J].Energy&Fuels,2014,28(1):636-642.
[13]吴宇澄,林先贵,朱清禾,等.冶炼企业周边农田土壤的多环芳烃污染及其细菌群落效应[J].生态毒理学报,2016,11(2):484-491.
[14]范淑秀,李培军,何娜,等.多环芳烃污染土壤的植物修复研究进展[J].农业环境科学学报,2007,26(6):2007-2013.
[15]侯梅芳,潘栋宇,黄赛花,等.微生物修复土壤多环芳烃污染的研究进展[J].生态环境学报,2014,23(7):1233-1238.
[16]Fenton H J H.Oxidation of tartaric acid in presence of iron[J].JournaloftheChemicalSociety,Transactions,1894,65:899-910.
[17]Barb W G,Baxendale J H,George P,et al.Reactions of ferrous and ferric ions with hydrogen peroxide.Part I.—The ferrous ion reaction[J].TransactionsoftheFaradaySociety,1951,47:462-500.
[18]张亚南,申哲民,李亚红,等.Fenton氧化法处理有机污染物的降解规律探讨[J].安全与环境工程,2013,20(5):57-61.
[19]Ma X H,Zhao L,Dong Y H,et al.Enhanced Fenton degradation of polychlorinated biphenyls in capacitor-oil-contaminated soil by chelating agents[J].ChemicalEngineeringJournal,2018,333:370-390.
[20]Bavel B.Comparison of Fenton's reagent and ozone oxidation of polycyclic aromatic hydrocarbons in aged contaminated soils[J].JournalofSoilsandSediments,2006,6(4):208-214.
[21]Baldrian P,Cajthaml T,Merhautová V,et al.Degradation of polycyclic aromatic hydrocarbons by hydrogen peroxide catalyzed by heterogeneous polymeric metal chelates[J].AppliedCatalysisB:Environmental,2005,59(3):267-274.
[22]Iglesias O,Sanromán M A,Pazos M.Surfactant-enhanced solubilization and simultaneous degradation of phenanthrene in marine sediment by electro-Fenton treatment[J].Industrial&EngineeringChemistryResearch,2014,53(8):2917-2923.
[23]韩佳颐,侯永江,左欠,等.ZSM-5分子筛疏水改性及催化H2O2氧化苯酚的性能研究[J].安全与环境工程,2017,24(3):91-96.
[24]Gabriel J,Shah V,Nesměrák K,et al.Degradation of polycyclic aromatic hydrocarbons by the copper(II)-hydrogen peroxide system[J].FoliaMicrobiologica,2000,45(6):573-575.
[25]Orge C A,Pereira M F R,Faria J L.Photocatalytic-assisted ozone degradation of metolachlor aqueous solution[J].ChemicalEngineeringJournal,2017,318:247-253.
[26]Elovitz M S,Von Gunten U,Kaiser H P.Hydroxyl radical/ozone ratios during ozonation processes.II.The effect of temperature,pH,alkalinity,and DOM properties[J].Ozone:Science&Engineering,2000,22(2):123-150.
[27]O’mahony M M,Dobson A D,Barnes J D,et al.The use of ozone in the remediation of polycyclic aromatic hydrocarbon contaminated soil[J].Chemosphere,2006,63(2):307-314.
[28]Yu D Y,Kang N,Bae W,et al.Characteristics in oxidative degradation by ozone for saturated hydrocarbons in soil contaminated with diesel fuel[J].Chemosphere,2007,66(5):799-807.
[29]Garoma T,Gurol M D,Osibodu O,et al.Treatment of groundwater contaminated with gasoline components by an ozone/UV process[J].Chemosphere,2008,73(5):825-831.
[30]Li Z,Hanlie H.Combination of surfactant solubilization with permanganate oxidation for DNAPL remediation[J].WaterResearch,2008,42(3):605-614.
[31]Brown G,Barton L,Thomson B.Permanganate oxidation of sorbed polycyclic aromatic hydrocarbons[J].WasteManagement,2003,23(8):737-740.
[32]Ding Y,Zhu L,Wang N,et al.Sulfate radicals induced degradation of tetrabromo bisphenol A with nanoscaled magnetic CuFe2O4as a heterogeneous catalyst of peroxymonosulfate[J].AppliedCatalysisB:Environmental,2013,129:153-162.
[33]Niu C G,Wang Y,Zhang X G,et al.Decolorization of an azo dye Orange G in microbial fuel cells using Fe(II)-EDTA catalyzed persulfate[J].BioresourceTechnology,2012,126:101-106.
[34]Neta P,Huie R E,Ross A B.Rate constants for reactions of inorganic radicals in aqueous solution[J].JournalofPhysicalandChemicalReferenceData,1988,17(3):1027-1284.
[35]Usman M,Faure P,Ruby C,et al.Application of magnetite-activated persulfate oxidation for the degradation of PAHs in contaminated soils[J].Chemosphere,2012,87(3):234-240.
[36]Tan X M,Ji F Y,Wang X D,et al.Preparation of potassium ferrate and ferrate (VI) oxidation of phenanthrene[J].AdvancedMaterialsResearch,2012,518:784-789.
[37]Liu J,Huang J,Su L,et al.Degradation of anthracene,pyrene and benzo[a]-anthracene in aqueous solution by chlorine dioxide[J].ScienceinChinaSeriesB:Chemistry,2006,49(6):565-572.
[38]Nakamura H,Tomonaga Y,Miyata K,et al.Reaction of polycyclic aromatic hydrocarbons adsorbed on silica in aqueous chlorine[J].EnvironmentalScience&Technology,2007,41(7):2190-2195.
[39]Simon T,Bouchonville N,Berr M J,et al.Redox shuttle mechanism enhances photocatalytic H2generation on Ni-decorated CdS nanorods[J].NatureMaterials,2014,13(11):1013-1018.
[40]Waterhouse G I N,Wahab A K,Al-Oufi M,et al.Hydrogen production by tuning the photonic band gap with the electronic band gap of TiO2[J].ScientificReports,2013,3:2849.
[41]Wang L,Shang J,Hao W,et al.A dye-sensitized visible light photocatalyst-Bi24O31Cl10[J].ScientificReports,2014,4:7384.
[42]Luan P,Xie M,Liu D,et al.Effective charge separation in the rutile TiO2nanorod-coupled α-Fe2O3with exceptionally high visible activities[J].ScientificReports,2014,4:6180.
[43]Kohtani S,Tomohiro M,Tokumura K,et al.Photooxidation reactions of polycyclic aromatic hydrocarbons over pure and Ag-loaded BiVO4photocatalysts[J].AppliedCatalysisB:Environmental,2005,58(3):265-272.
[44]Kou J,Li Z,Yuan Y,et al.Visible-light-induced photocatalytic oxidation of polycyclic aromatic hydrocarbons over tantalum oxynitride photocatalysts[J].EnvironmentalScience&Technology,2009,43(8):2919-2924.
[45]Jia H,Zhao J,Fan X,et al.Photodegradation of phenanthrene on cation-modified clays under visible light[J].AppliedCatalysisB:Environmental,2012,123:43-51.
[46]Pazos M,Rosales E,Alcántara T,et al.Decontamination of soils containing PAHs by electroremediation:A review[J].JournalofHazardousMaterials,2010,177(1):1-11.
[47]Alcántara T,Pazos M,Cameselle C,et al.Electrochemical remediation of phenanthrene from contaminated kaolinite[J].EnvironmentalGeochemistryandHealth,2008,30(2):89-94.
[48]Gómez J,Alcántara M,Pazos M,et al.A two-stage process using electrokinetic remediation and electrochemical degradation for treating benzo[a] pyrene spiked kaolin[J].Chemosphere,2009,74(11):1516-1521.
[49]Hahladakis J N,Lekkas N,Smponias A,et al.Sequential application of chelating agents and innovative surfactants for the enhanced electroremediation of real sediments from toxic metals and PAHs[J].Chemosphere,2014,105:44-52.
[50]Adewuyi Y G.Sonochemistry:Environmental science and engineering applications[J].Industrial&EngineeringChemistryResearch,2001,40(22):4681-4715.
[51]Suslick K S.Sonochemistry[J].Science,1990,247:1439-1445.
[52]Flint E B,Suslick K S.The temperature of cavitation[J].Science,1991,253:1397-1399.
[53]Makino K,Mossoba M M,Riesz P.Chemical effects of ultrasound on aqueous solutions.Formation of hydroxyl radicals and hydrogen atoms[J].TheJournalofPhysicalChemistry,1983,87(8):1369-1377.
[54]Riesz P,Berdahl D,Christman C.Free radical generation by ultrasound in aqueous and nonaqueous solutions[J].EnvironmentalHealthPerspectives,1985,64:233-252.
[55]Buxton G V,Greenstock C L,Helman W P,et al.Critical review of rate constants for reactions of hydrated electrons,hydrogen atoms and hydroxyl radicals (·OH/·O-) in aqueous solution[J].JournalofPhysicalandChemicalReferenceData,1988,17(2):513-886.
[56]Laughrey Z,Bear E,Jones R,et al.Aqueous sonolytic decomposition of polycyclic aromatic hydrocarbons in the presence of additional dissolved species[J].UltrasonicsSonochemistry,2001,8(4):353-357.
[57]Psillakis E,Goula G,Kalogerakis N,et al.Degradation of polycyclic aromatic hydrocarbons in aqueous solutions by ultrasonic irradiation[J].JournalofHazardousMaterials,2004,108(1):95-102.
[58]Josephezra H,Nasser A,Benari J,et al.Mechanochemically enhanced degradation of pyrene and phenanthrene loaded on magnetite[J].EnvironmentalScience&Technology,2014,48(15):5876-5882.
